盘龙七片通过调节Wnt/β-catenin通路对BMSCs成骨分化的影响
吴泽荣,王明潮,林荣坤,张冬雅,孙东平,刘红财,庞瑞明
(深圳市宝安中医院(集团)骨科,广东 深圳,518133)
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是从骨髓中分离出的干细胞,具有良好的可塑性和分化成不同类型细胞的潜能[1]。BMSCs是骨组织工程的重要种子细胞,在一定条件诱导下可以分化成软骨、脂肪和成骨细胞等[2]。BMSCs的成骨分化是目前干细胞和骨关节疾病研究领域的热点之一。盘龙七片是一种具有消肿镇痛,活血化瘀和抗炎作用的中成药,临床多应用于骨关节炎,软骨损伤和骨折等的治疗中,但其作用机制尚不明确[3]。本文通过体外培养观察盘龙七片对BMSCs成骨分化的影响并探讨其作用机制,为盘龙七片的药理研究提供理论参考。
1 材料与方法
1.1 材料
人骨髓间充质干细胞BMSCs(ATCC®PCS-500-012TM)购于美国菌种保藏中心;盘龙七片购于陕西盘龙药业集团股份有限公司;DEME血清、青霉素、链霉素和成骨诱导液购于美国Sigma公司;RT-PCR所用引物由上海生工生物工程有限公司合成;骨钙素(osteocalcin)检测试剂盒购于南京建成生物工程研究所;碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒购于碧云天生物技术公司。
1.2 实验方法
1.2.1 BMSCs细胞培养
BMSCs细胞常规培养于含有10%胎牛血清,100 U·mL-1青霉素和链霉素的DEME培养基中。盘龙七片用DEME培养基配置为90 μg·mL-1的母液。对数期生长的BMSCs细胞接种至96孔板分组培养。对照组:加入成骨诱导液(含8×10-8mol·L-1地塞米松,50 mg·L-1维生素C和10 mmol·L-1β-甘油磷酸钠)培养的BMSCs细胞;盘龙七片组:加入成骨诱导液的同时加入不同质量浓度的盘龙七片(30、60、90 μg·mL-1)培养的BMSCs细胞。每24 h换液1次,培养7 d。
1.2.2 细胞增殖检测
待测细胞中加入终质量浓度为5 mg·mL-1的MTT,37 ℃孵育4 h。弃上清,加入150 μL的DMSO,490 nm波长测OD值。实验重复3次。
1.2.3 成骨基因mRNA表达检测
Runx2、Osterix和COL1A1的mRNA表达水平用RT-PCR检测。细胞分组培养1周后,按Trizol试剂盒说明提取总RNA并检测其浓度。反转录获得cDNA,PCR检测基因的表达。反应条件为:95 ℃ 15 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,30个循环,72 ℃ 10 min。以内参基因β-actin为对照,用2-△△Ct法计算基因mRNA的相对表达水平。引物序列如表1。

表1 引物序列
1.2.4 Western blot检测蛋白表达
待测细胞中加入蛋白裂解液反应30 min,用SDS-PAGE电泳分离蛋白。转膜1 h后,加入5%脱脂牛奶室温封闭1 h。分别加入Runx2、Osterix、COL1A1、Wnt3、p-GSK-3β、β-catenin和β-actin的一抗4 ℃过夜。加入二抗孵育1 h后,用凝胶成像仪对条带进行定量分析。实验重复3次。
1.2.5 酶联免疫吸附法检测骨钙素水平
细胞分组培养1周后,1000 r·min-1离心20 min,提取细胞上清液。检测该上清液中骨钙素的水平,具体操作按照试剂盒说明进行,用酶标仪在450 nm波长处检测各组吸光度值。实验重复3次。
1.2.6 ALP活性检测
细胞分组培养1周后,加入Triton X-100后收集细胞裂解液。按照ALP检测试剂盒说明在细胞裂解液中加入p-硝基苯磷酸二钠,37 ℃孵育15 min后加入氢氧化钠溶液终止反应,测定405 nm波长吸光度,计算ALP活性。实验重复3次。
1.3 统计学方法
用SPSS22.0统计学软件对数据进行分析,结果以均数±标准差表示,组间比较用单因素方差分析(One-Way ANOVA)分析,两两比较采用Dunnett-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs形态学观察
BMSCs细胞培养后逐渐贴壁,呈梭形或多角形。随着培养时间的延长,细胞克隆式生长,按一定方向紧密排列,呈旋涡状或放射状,呈长梭形(图1)。
图1 倒置显微镜下BMSCs形态观察(200×)
2.2 盘龙七片对BMSCs细胞增殖的作用
与对照组相比,加入盘龙七片30、60、90 μg·mL-1处理的BMSCs细胞增殖提升(P<0.05),并且细胞增殖随盘龙七片质量浓度的升高提升,如图2。提示盘龙七片可提升BMSCs细胞的增殖,在后续实验选用90 μg·mL-1作为盘龙七片的处理浓度。
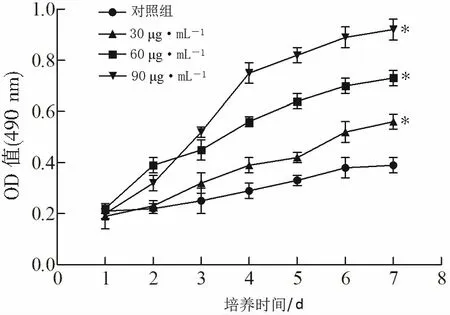
*P<0.05与对照组比较。图2 盘龙七片对BMSCs细胞增殖的作用
2.3 盘龙七片对BMSCs细胞中成骨分化基因mRNA和蛋白表达的影响
BMSCs细胞培养1周后,检测成骨基因Runx2、Osterix和COL1A1的表达。与对照组相比,Runx2,Osterix和COL1A1的mRNA表达在盘龙七片组中提升(P<0.05)。Western blot检测结果显示,盘龙七片组中Runx2、Osterix和COL1A1的蛋白表达高于对照组(P<0.05)。见图3。提示盘龙七片可促进BMSCs细胞的成骨分化基因表达。

*P<0.05与对照组比较。图3 盘龙七片对BMSCs细胞中成骨分化基因mRNA和蛋白表达的影响
2.4 盘龙七片对BMSCs细胞中骨钙素水平和ALP活性的作用
盘龙七片组BMSCs细胞中骨钙素的水平高于对照组(P<0.05)。与对照组相比,盘龙七片组BMSCs细胞中ALP的活性显著提升(P<0.05)。见图4。提示盘龙七片提升BMSCs细胞中骨钙素水平和ALP活性。
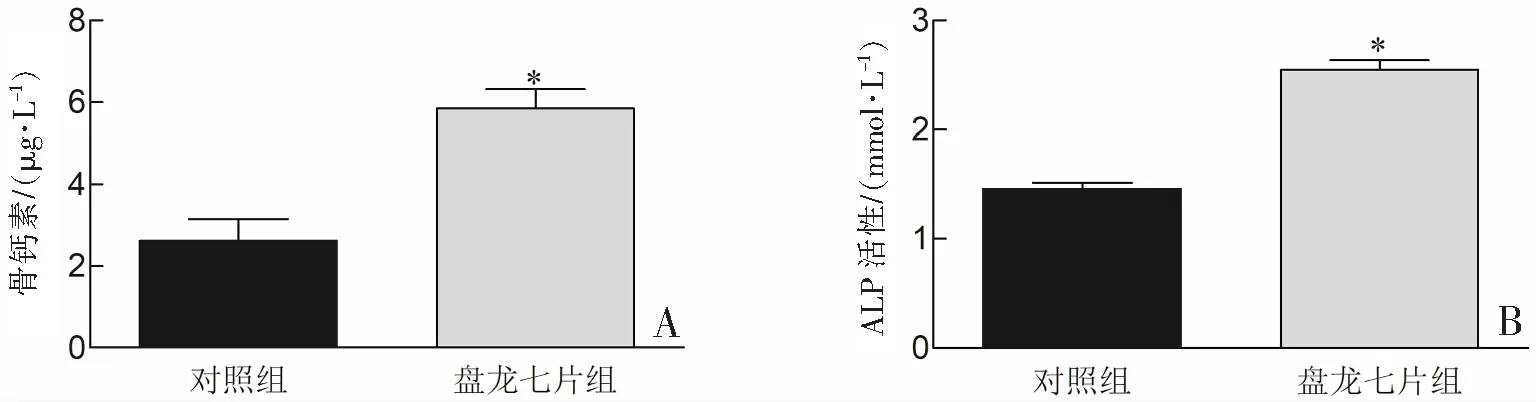
*P<0.05与对照组比较。图4 盘龙七片对BMSCs细胞中骨钙素水平和ALP活性的作用
2.5 盘龙七片对BMSCs细胞中Wnt/β-catenin信号通路蛋白表达的作用
Western blot结果显示,与对照组相比,Wnt3和β-catenin的蛋白表达在盘龙七片组中提升,p-GSK-3β的蛋白表达在盘龙七片组中降低(P<0.05)。见图5。提示盘龙七片可激活BMSCs细胞中Wnt/β-catenin信号通路。
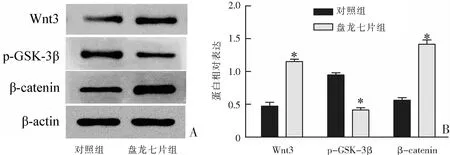
*P<0.05与对照组比较。图5 盘龙七片对BMSCs细胞中Wnt/β-catenin信号通路蛋白表达的作用
3 讨论
骨髓间充质干细胞作为骨组织工程的常用细胞,具有来源广泛、易于培养和自体移植排斥少等特点[4]。BMSCs具有高度的自我更新和多向分化的潜能。探索药物对BMSCs成骨分化的调控作用,可为临床各类骨科疾病的治疗提供方向和依据。
中成药盘龙七片是由著名老中医、中国《中医辞典》编写顾问王家成所献祖传秘方研制而成,主要由盘龙七、草乌、当归、川乌、丹参等中药组成[5]。临床应用表明,盘龙七片对多种骨科疾病有明显的治疗效果,但其作用机制还未完全研究清楚。本文选取人骨髓间充质干细胞BMSCs为靶标进行盘龙七片药理作用研究,首先观察不同浓度的盘龙七片对成骨诱导的BMSCs细胞增殖的影响。30、60和90 μg·mL-1的盘龙七片均对BMSCs细胞增殖有促进作用,且其作用随着药物质量浓度的升高而提升,因此在后续实验中选取了效果最大的90 μg·mL-1作为盘龙七片处理浓度。
成骨相关基因的表达是BMSCs向成骨细胞分化的标志。成骨分化过程中,Runx2、Osterix和COL1A1等成骨相关基因表达上调,这些基因在成骨分化的不同时期表达[6]。其中,Runx2是成骨分化形成过程中关键的转录分子,亦是骨形成过程中最早期的特征性蛋白[7]。Osterix和COL1A1同样是骨髓间充质干细胞成骨分化的重要参与因子,在骨形成的胶原蛋白分泌和骨钙化等过程中起重要调节作用[8]。实验结果显示,与对照组相比,在经盘龙七片处理后BMSCs细胞中Runx2、Osterix和COL1A1的mRNA表达显著上调,蛋白表达量增加,表明盘龙七片具有促进BMSCs成骨细胞分化的作用。
骨钙素是由成熟成骨细胞分泌出的一种多肽,能够抑制软骨矿化的速度,并促进骨组织矿物质沉积钙化,其含量的高低能够反映成骨细胞的分化程度[9]。从骨髓间充质干细胞成骨分化的早期开始,细胞内酶ALP水平显著增加,通过破坏钙化抑制剂促进骨钙化的发生。ALP被认为是骨髓间充质干细胞成骨分化的标志,ALP的活性越强,表明成骨分化程度越高[10]。本文中盘龙七片的处理明显提升了BMSCs细胞中骨钙素和ALP的水平,再次验证了盘龙七片对BMSCs细胞成骨分化的促进作用。
成骨分化的过程被多种分子信号通路调节。Wnt/β-catenin信号通路在成骨分化以及BMSCs细胞的自我更新中起关键作用[11]。β-catenin是该通路的核心蛋白,当通路激活后,Wnt蛋白可以与受体结合抑制GSK-3β的磷酸化,提升β-catenin的表达[12]。有研究[13]表明,盘龙七片可通过激活Wnt/β-catenin信号通路促进胫骨骨折大鼠的愈合。本研究中盘龙七片的处理显著提升了BMSCs细胞中Wnt3和β-catenin的蛋白表达,抑制了p-GSK-3β的表达,表明盘龙七片激活细胞中的Wnt/β-catenin信号通路。
综上所述,盘龙七片能够提升BMSCs细胞增殖,促进细胞成骨分化,且其作用可能是通过激活Wnt/β-cateinin信号通路产生的。今后还需进一步在动物模型中探索和验证盘龙七片对BMSCs细胞的作用,以期为盘龙七片在骨科疾病临床治疗中的应用提供更多实验依据和理论基础。

