免疫层析试纸条信号放大技术研究进展
闫灵芝
(运城学院生命科学系,山西运城 044000)
随着经济全球化和食品国际贸易的发展,食品从生产、加工、包装、运输、储存到消费的各个环节均比以往更容易被食源性致病微生物、农药、兽药、激素和非法添加物等污染。为了保障人民的健康,食品安全的检测技术显得尤为重要。在对食品中有毒有害物质进行检测时,基于高效液相色谱法(high performance liquid chromatography,HPLC)、气相色谱质谱联用法(gas chromatography-mass spectrometry,GC-MS)、液相色谱串联质谱法(liquid chromatography-tandem mass spectrometry,LC-MS)、酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)等仪器分析方法,虽然检测灵敏度较高,结果准确性较好,但是样品前处理比较繁琐,检测时间较长,设备昂贵,需要专业的技术人员操作仪器,因此,不适用于食品安全的现场快速检测[1]。免疫层析试纸条(Immunochromatographic Test Strip,ICTS)结合了层析技术的分离能力和免疫分析方法的特异性,具有操作简单、无需专业技术人员、检测成本较低、检测快速(测定结果可在10~20 min内进行判定)等特点,特别适用于在实验室外对大批量食品样品的快速检测。然而传统的基于球状金纳米材料的ICTS,检测灵敏度相对较低,仅可实现定性和半定量的检测,因此,依赖于ICTS 的信号放大技术,通过信号放大技术提高ICTS 的检测灵敏度可满足当前对食品安全检测的要求。本文对ICTS 的信号放大策略进行综述并提出了未来的发展方向,以期为食品安全快速检测技术的发展提供技术参考。
1 传统免疫层析试纸条的检测原理
传统的ICTS 主要由样品垫、结合垫、硝酸纤维素(nitrocellulose,NC)膜、吸水垫以及PVC 衬板五部分组成,其相互堆叠顺序如图1 所示。在结合垫上固定有球状金纳米材料标记的抗体,硝酸纤维素膜上划有两条预先固定免疫试剂的检测线(test line,T 线)和质控线(control line,C 线),T 线用于判定检测结果,C 线用于判断试纸条的有效性。
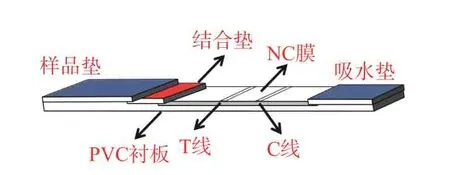
图1 免疫层析试纸条的示意图Fig.1 Schematic diagram of ICTS
传统基于球状金纳米材料的ICTS 的检测原理是样品借助层析作用沿试纸条流动,然后与结合垫上的金标抗体和固定于NC 膜T 线和C 线上的免疫试剂相互作用,从而产生红色的条带,用于评估测试结果[2−4]。分为两种模式:双抗体夹心法和竞争抑制法。双抗体夹心法采用一对单克隆抗体,其中一个抗体标记金纳米材料,另外一个抗体喷涂于T 线,在有目标物存在的情况下,即可在T 线处形成金纳米材料-单克隆抗体1-目标物-单克隆抗体2 的夹心结构,该方法主要用于检测大分子目标物(蛋白质、病原菌、病毒等),检测直观性强,灵敏度高,但是需要开发一对抗体和大分子目标物的不同抗原表位结合,无疑增加了检测的成本。竞争法则用于具有单一抗原表位的小分子抗原的检测,如:农兽药残留、激素、毒素等。待检目标小分子物质和喷涂于T 线上的抗原竞争地和纳米金标记的抗体相结合。该方法抗体和小分子的亲和性对检测灵敏度的影响很大。两种模式下结合垫、T 线和C 线固定的免疫试剂及结果判定方法不同,其区别如表1 所示。

表1 夹心免疫层析和竞争性免疫层析的区别Table 1 Difference between sandwich and competitive spherical gold-based immunochromatography assay
2 免疫层析试纸条信号放大方法
2.1 开发本身信号强度高的纳米标记材料
球状金纳米材料是ICTS 中最常用的信号标记材料,传统的ICTS 通常采用30~40 nm 的球状金纳米材料,但是该粒径范围的金纳米材料发光强度不足,且对抗体的捕获率不高(<5%),最终导致试纸条的检测灵敏度不高[5]。100 nm 的球状纳米金由于具有较高的摩尔消光系数和光强度,被认为是制作试纸条较为理想的粒径[6]。而当纳米金的粒径过大时,由于存在空间位阻效应和较强的光散射性,会影响试纸条的检测性能[7]。金纳米材料的粒径虽然对ICTS 的检测性能有较大影响,但是仅通过优化金纳米材料的粒径并不能满足对目标物质高灵敏的检测需求,因此需要合成本身发光强度更高的新型纳米标记材料用于试纸条的信号放大。表2 列出了在ICTS 中采用的本身信号强度较高的纳米材料,各类方法相较于传统的基于球状金纳米材料的ICTS 的性能提高情况,检测目标物和检测限。
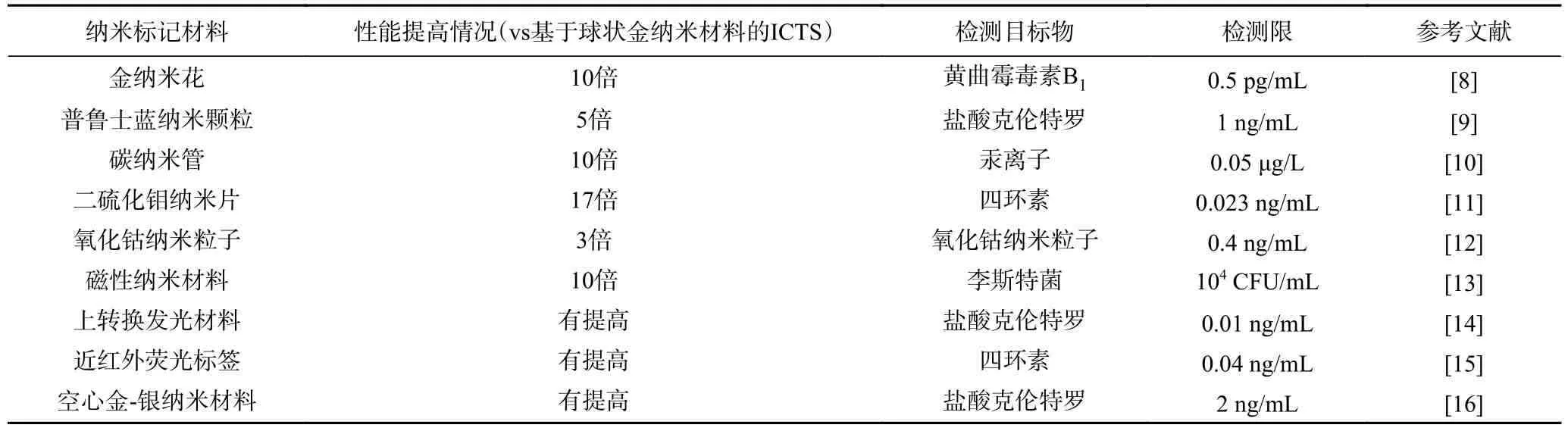
表2 本身信号强度高的纳米材料Table 2 Nanoparticles with high signal intensity in ICTS
2.2 纳米材料聚集法信号放大技术
单个的纳米材料发光强度是有限的,为了增强检测信号强度,研究者开始探索将纳米材料聚集在一起来实现信号增强的目的。第一种使纳米材料聚集的方法是借助中间载体,将纳米材料大量聚集于该载体上或者被包裹在该载体内,进而形成新的信号标记材料,以该材料作为试纸条的信号标签,由于其带有较多的纳米材料,纳米材料的聚集而使得该标签具有更强的发光强度,因此在试纸条的检测过程中可以在测试线上获得更深的条带颜色,由此实现放大检测信号的目的[17]。表3 列出了第一种使得纳米材料聚集的方法以实现信号放大目的的ICTS,总结了采用的中间载体、被富集的纳米材料、性能提高倍数、检测目标物及检测限。

表3 纳米材料聚集法实现信号放大的ICTS Table 3 Nanoparticles aggregations method for signal amplification in ICTS
第二种使纳米材料聚集的方法是双层法,即采用一对可特异性结合的物质分别结合纳米材料,目前利用的该类物质主要为抗体-抗抗体、生物素和链霉亲和素(streptavidin,Sa)以及牛血清白蛋白(bovine serum albumin,BSA)-抗BSA 的抗体,在免疫层析的过程中,利用这些物质之间的相互作用实现纳米材料的聚集进而增强检测信号的发光强度。Chen 等[35]将金纳米材料分别标记抗体和抗抗体,免疫层析的进行即可在试纸条测试上形成纳米金-抗体-抗抗体-纳米金复合物进而实现了金纳米材料的聚集,用该方法检测大肠杆菌O157:H7,对其检测限为1.14×103CFU/mL。Yan 等[36]则利用抗体和抗抗体之间的相互作用实现了磁性纳米材料的聚集,对呋喃唑酮代谢物的检测限为0.044 ng/mL,和传统方法相比,灵敏度提高了10 倍。Fang 等[37]将金纳米材料分别标记链霉亲和素和生物素化的单克隆抗体,进而形成纳米金-Sa-生物素-抗体-纳米金复合物,该方法实现对农药吡虫啉的检测,灵敏度为传统方法的160 倍。用于试纸条的纳米信号标记材料通常会采用BSA来封闭非特异性的结合位点,Zhong 等[38]将金纳米材料分别标记单克隆抗体和抗BSA 的抗体,进而形成纳米金-抗BSA 抗体-BSA-纳米金-单克隆抗体复合物,该方法对食品中的三聚氰胺的检测限为1.4 ng/mL,检测灵敏度和传统方法相比提高了25 倍。双层法虽然提高了ICTS 的检测灵敏度,但是繁琐的双标记过程增加了试纸条的制备时间,影响试纸条的大规模生产,同时会存在一定的空间位阻效应影响待检目标物和抗体之间的结合效率,影响检测结果的重复性。
2.3 应用增强试剂信号放大技术
在ICTS 中通过应用增强试剂之间的相互作用,反应会形成新的金属而在试纸条的测试线上沉积,金属的沉积加深了测试线的颜色,进而提高了检测的灵敏度。目前应用增强试剂放大信号的方法主要有“金增强方法”、“银增强方法”、“铂增强方法”以及“铜增强方法”。被称为“金增强方法”的信号放大策略是利用金增强试剂氯金酸(HAuCl4)和还原剂盐酸羟胺(NH2OH·HCl)之间的反应,在试纸条原始的纳米金表面形成新的一层金纳米颗粒,从而增大金纳米材料的尺寸而实现信号放大的目的(图2a)。与直接合成大粒径金纳米材料信号放大的方法相比,该方法是在常规免疫层析结束后再引入增强试剂继续增大纳米材料的粒径。因此材料粒径增大并不会影响抗原抗体的结合效率,不存在空间位阻效应影响反应的灵敏度。Bu 等[39]利用该策略检测食品中的肠炎沙门氏菌,检测信号增强了100 倍。银增强方法是在试纸条金纳米材料的催化下,还原剂对苯二酚将银盐溶液中的银离子还原为银单质,银单质沉积于原先的金纳米材料上,形成银-金纳米复合物,该复合物在试纸条上形成黑色的检测条带(图2b)。与原始的红色条带相比,黑色条带颜色较深,且和试纸条白色的背景对比更加明显[40]。Yu 等[41]利用该方法检测伏马菌素B1和脱氧雪腐镰刀菌烯醇,对其检测限分别为2 和40 ng/mL,检测限和传统方法相比至少降低了两倍。Anfossi 等[42]利用银增强方法检测食品中的赭曲霉毒素A,灵敏度和传统方法相比提高了10 倍。虽然上述方法可提高试纸条的检测灵敏度,但是添加银增强试剂需要额外的二次操作,因此会延长试纸条的分析时间,为了解决这一问题,Kim 等[43]将银增强试剂和水溶性的核壳纳米纤维相结合,并将该纳米纤维置于试纸条检测线之前,随着免疫层析过程的进行,银增强试剂可从纤维中释放,从而实现一步信号放大的目的,该方法对目标物的检测灵敏度提高了10倍,但是并不影响分析时间。铜增强方法是利用抗坏血酸将Cu2+还原为金属铜单质(图2c),铜单质在测试线上的沉积增强了测试线的颜色[44]。Zhou 等[45]利用该方法对牛奶中的大肠杆菌O157:H7 进行检测,检测限可达到6 CFU/mL。铂增强方法是利用对苯二酚将银离子还原为金属银单质,然后利用抗坏血酸将氯铂酸(H2PtCl6)中的Pt4+还原为金属铂而沉积到测试线上(图2d),测试线颜色加深使得检测灵敏度提高,该方法对肌红蛋白的检测限为5.47 ng/mL[46]。
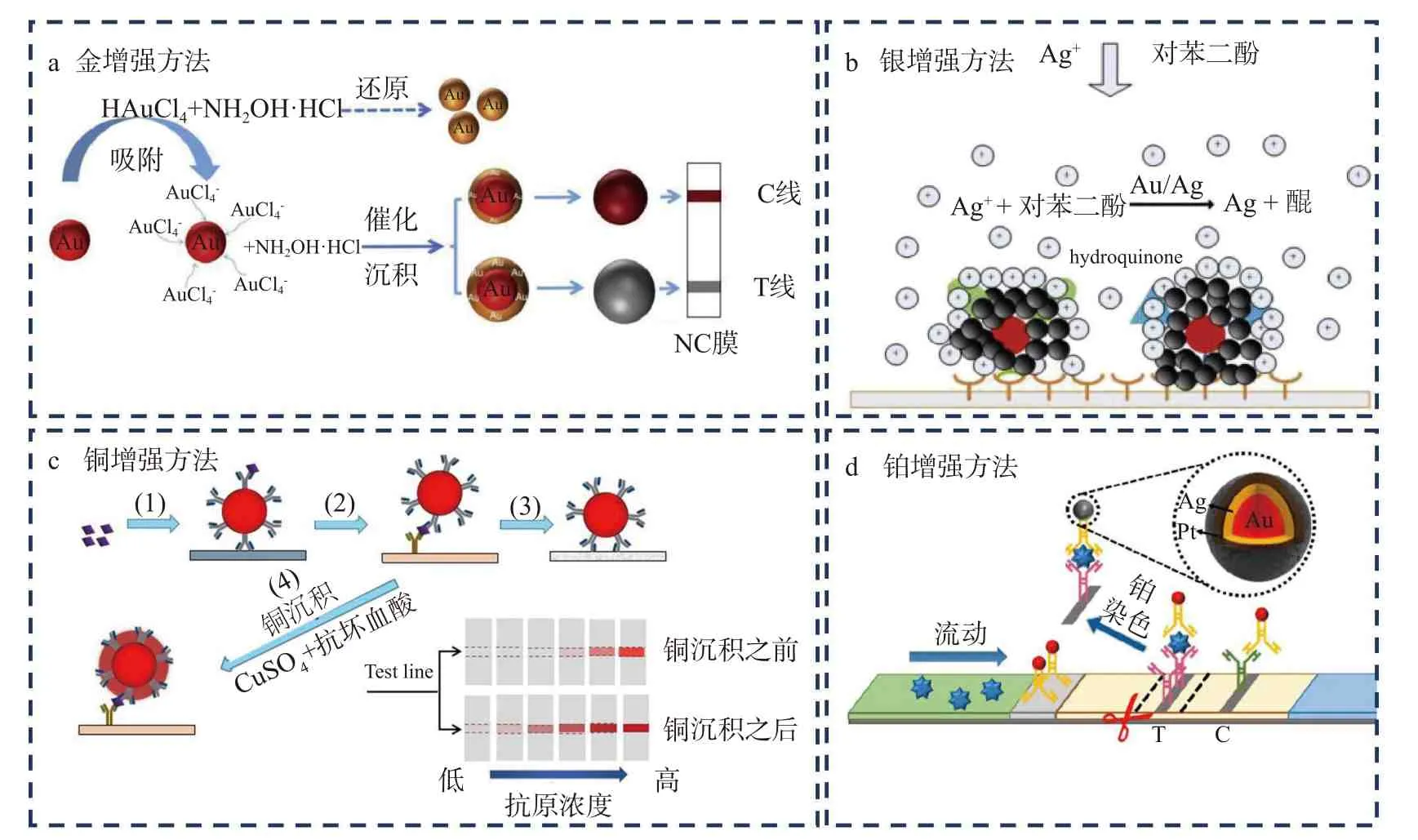
图2 应用增强试剂信号放大技术[39,41,44,46]Fig.2 Signal amplification technology by applying enhanced reagent[39,41,44,46]
应用增强试剂的信号放大技术虽然提高了试纸条的检测灵敏度,但是添加增强试剂通常是在常规免疫层析之后进行的二次操作,会增加试纸条的分析时间,影响检测效率。因此一步法实现信号放大的技术是未来研究的重点方向。
2.4 纳米材料修饰酶信号放大技术
该方法是将纳米材料同时标记蛋白酶和单克隆抗体,利用蛋白酶催化底物的高效性和产物的显色性,使得试纸条检测线颜色加深而实现信号放大的目的[47−49]。目前,辣根过氧化物酶(horseradish peroxidase,HRP)在ICTS 信号放大技术中应用较为广泛,其催化效率高,一个酶分子可在1 s 内催化产生103个颜色产物[50]。Parolo 等[51]开发了基于HRP 催化底物的信号放大ICTS,同时研究了三种不同类型的HRP 催化底物3, 3’, 5, 5’-四甲基联苯胺(tetramethylbenzidine,TMB)、3, 3’-二氨基联苯胺盐酸盐(diaminobenzidine tetrahydrochloride,DAB)和3-氨基-9-乙 基 咔 唑(3-amino-9-ethyl-carbazole,AEC)对试纸条检测性能的影响(图3),结果表明TMB 是HRP 催化底物信号放大技术中理想的物质选择。Panferov 等[52]则利用碱性磷酸酶实现试纸条的信号放大,用该方法检测马铃薯X 病毒,对其检测限为0.3 ng/mL,检测限比常规试纸条降低了27 倍。

图3 纳米材料修饰酶信号放大技术[51]Fig.3 Signal amplification technology by modifying enzyme on nanoparticles[51]
该方法虽然对ICTS 的性能提升效果明显,信号放大过程简单(室温、水溶液、5 min 反应时间),但是蛋白酶相对较差的热稳定性和化学稳定性是一个潜在的问题,同时酶分子会和抗体竞争地结合在纳米材料的表面,导致抗体在纳米材料上的结合量减少,酶的空间位阻效应还可能会影响抗体与分析物结合的效率。酶的结合量以及最终信号放大的幅度会受到纳米材料有限表面积的限制[53]。
2.5 利用纳米催化材料信号放大技术
纳米催化材料,也称为纳米酶,是一种基于纳米材料的人工酶,其具有和酶相似的催化活性,催化性能受外界环境条件的影响较小,化学性质稳定,易于表面修饰,同时比蛋白酶的生产成本低[54]。利用纳米酶催化底物产生的颜色而增强测试线的信号也可实现ICTS 的信号放大。Loynachan 等[55]在15 nm 的纳米金颗粒上生长铂,进而合成多孔的核壳纳米催化剂,以该材料作为试纸条的信号标签(图4a),对目标物质的检测限可降低100 倍。Gao 等[56]在金纳米材料表面覆盖铂层,以形成的纳米金@铂作为信号标记材料,由于铂的高效过氧化物模拟酶活性,其催化底物显色使得试纸条的检测灵敏度提高了两个数量级,如图4b 所示。
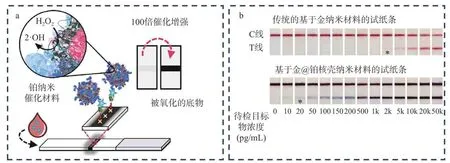
图4 应用纳米催化材料信号放大技术[55-56]Fig.4 Signal amplification technology by applying nanocatalytic materials[55-56]注:*代表试纸条的检测限。
近年来应用于ICTS 中的纳米催化材料以及使用催化材料之后试纸条的性能提高情况如表4 所示。

表4 在ICTS 中为实现信号放大的目的使用的纳米催化材料Table 4 Catalytic nanomaterials used in ICTS for signal amplification purpose
2.6 富集样品中检测目标物信号放大技术
近年来富集样品中检测目标物的方法主要采用磁性分离技术,因为磁性纳米材料合成成本低廉、结构易于控制、具有良好的生物相容性,特别是可以由一块简单的磁铁进行富集操作,使所有的分离过程都在一个离心管中完成,无需耗时的离心过程。在对检测目标物进行富集时,将抗体偶联的磁性纳米材料添加到样品基质中,孵育一定时间后,在样品基质中会形成抗原-抗体-磁性纳米材料复合物,然后使用外部磁场的作用提取该复合物,再将分离物重悬到溶液中(磷酸盐缓冲溶液或去离子水),使用该重悬液进行ICTS 快速检测分析。因此磁性分离技术除了可以富集检测目标物以外,还可以将目标物从复杂的样品基质中分离出来,进而可消除试纸条检测过程中样品基质的干扰,提高检测的灵敏度[64−67]。Zhang 等[27]采用免疫磁分离技术对待检样品进行预处理,富集样品中的待检目标物,同时消除样品基质的影响(图5a)。对鼠伤寒沙门氏菌的检测限为103CFU/mL。Guo等[29]采用磁分离技术对酱油中的黄曲霉毒素进行分离和富集,同时消除了酱油黑色的样品基质对ICTS检测过程中的干扰(图5b),也可提高检测的灵敏度。

图5 富集样品中检测目标物信号放大技术[27,29]Fig.5 Signal amplification technology by enriching detection target[27,29]
2.7 降低层析速度法信号放大技术
在ICTS 中,试剂层析的速度相对较快,导致免疫试剂之间的结合时间较短,通过降低液体的流动速度可以提高免疫试剂之间的结合效率,使得试纸条检测线上结合的信号标签增多,最终起到ICTS 信号放大的目的。Tsai 等[68]在测试区域和结合垫之间额外增加一个“叠加垫”(图6),这种设计有助于将抗体和抗原积累在“叠加垫”上进行反应,从而减慢免疫试剂的流动速度,延长抗原/抗体的相互作用时间,提高试验的检测灵敏度。与传统的ICTS 测试相比,该方法可以提高2 倍的检测信号。

图6 降低层析速度信号放大技术[68]Fig.6 Signal amplification technology by reducing chromatography speed[68]
近年来通过降低层析速度提高ICTS 灵敏度的方法如表5 所示,同时列出了和传统的不降低层析速度的方法相比试纸条的性能提高情况。

表5 降低免疫层析速度实现信号放大的ICTS Table 5 Reduce the immunochromatographic speed for signal amplification in ICTS
2.8 非比色法信号放大技术
在传统的ICTS 中,作为信号标签的纳米材料,其光学特性通常作为信号输出的基础,检测结果采用比色的方法,导致纳米材料所具有的出色的光热传感能力和表面增强拉曼(Surface-enhanced Raman Spectroscopy,SERS)信号的能力被忽视。研究表明,利用纳米材料的热信号和表面增强拉曼信号对目标物质进行分析,可提高ICTS 的灵敏度[79−85]。
金纳米材料在光刺激下通过表面等离子体共振(surface plasmon resonance,SPR)产生热,特别是在吸收532 nm 的光时。Zhang 等[86]建立了一种基于金纳米材料光热效应的快速定量试纸条检测方法,该检测方法利用激光笔和温度传感器用于记录温度信号(图7a),光热方法对盐酸克伦特罗和鼠伤寒沙门氏菌的检测限降低了一个数量级。Zhang 等[33]则建立了基于纳米金功能化花状二氧化锰纳米材料光热效应的ICTS,该方法对脱氧雪腐镰刀菌烯醇的检测限为0.013 ng/mL,灵敏度和传统的基于金纳米材料的试纸条相比提高了58 倍(图7b),同时该方法消除了肉眼在低目标物浓度下无法区分测试条差异的缺点。
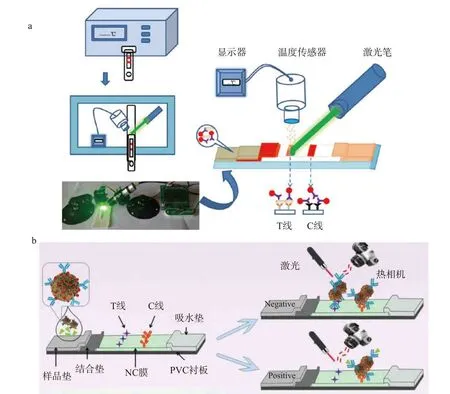
图7 光热信号放大技术[33,86]Fig.7 Photothermal signal amplification technology[33,86]
SERS 是一种超灵敏的振动光谱技术,具有抗光漂白、响应时间短、波段分辨率高、信息丰富等优点。基于SERS 的免疫层析方法不仅具有SERS 的高灵敏度和光谱分辨的能力,而且具有免疫层析技术的特异性和便捷性。一个典型的SERS 信号标签由三部分组成:金或者银纳米颗粒作为拉曼增强的基底、吸附在材料上的信号分子用于产生特征拉曼信号、特异性抗体用于识别目标分析物[87−89]。Lin 等[90]通过在金纳米星表面吸附4-氨基苯硫酚分子,以其作为试纸条的信号标签,通过采集试纸条的拉曼信号,对双酚A 的检测限为0.073 ng/mL(图8a),灵敏度是基于比色方法的20 倍。Su 等[91]开发了纳米金为核,金纳米星为壳的核壳纳米材料,拉曼信号分子5,5'-二巯基(2-硝基苯甲酸)位于核壳的中间,以形成的夹心结构的纳米材料作为ICTS 拉曼信号标签(图8b),对盐酸克伦特罗进行检测,对其检测限为0.05 ng/mL,灵敏度比传统的基于金纳米材料的试纸条提高了200 倍。

图8 表面增强拉曼信号放大技术[90-91]Fig.8 SERS signal amplification technology[90-91]注:DTNB 代表5,5'-二硫基(2-硝基苯甲酸)。
3 结语
ICTS 经过多年的发展在食品安全快速检测领域已经占据重要地位,传统的基于球状金纳米材料的ICTS 检测灵敏度低,不能满足食品安全高灵敏检测的需求。本文总结了近年来ICTS 信号放大技术,尽管使得ICTS 的检测性能有了极大的提升,但在实际应用过程中仍然存在很多问题。目前存在的主要问题及未来的发展方向简述如下:a.新型纳米标记材料的合成过程相对复杂,耗时耗力,有些材料还需要比较严苛的合成条件,同时存在材料稳定性较差的问题,因此,开发合成简单快速、性质稳定的纳米材料仍然是目前研究的一大方向;b.基于增强试剂的信号放大方法需要额外的二次操作以滴加试剂,无疑增加了试纸条的分析时间,因此,开发一步信号放大的方法可极大地提升试纸条的检测性能;c.基于光热和拉曼信号的试纸条,需要相应的传感器,增加了试纸条检测的成本,开发便携廉价的传感器是未来发展的趋势;d.在试纸条上设置障碍降低免疫试剂的流动速度,虽然可使试剂反应时间增长,提高检测的灵敏度,但是障碍物在试纸条上的设置比较复杂,使试纸条难以实现大规模生产,因此,亟需开发简单易行的方法来降低流体层析的速度,使得试纸条的生产简单化。

