LED 光照增强Ag2O/TiO2复合材料抗变异链球菌的作用机理
尹莉慧,黄乔木,吕 中
武汉工程大学环境生态与生物工程学院,湖北武汉430205
0 引 言
龋齿是一种慢性细菌性口腔疾病。细菌对食物中的碳水化合物进行发酵会产生酸性有害物质,这些有害物质通过局部破坏敏感的牙齿硬组织形成龋齿[1]。龋齿对全球60%的儿童和几乎所有的成人造成影响,若治疗不及时,细菌会在牙齿表面产酸并形成牙菌斑生物膜,导致牙齿出现空洞或腐烂[2]。变异链球菌(Streptococcus mutans,S. mutans)是致龋齿的主要病原菌,广泛存在于口腔中,与糖代谢产酸和牙菌斑有关[3]。目前最常用的口腔抗菌药物有洗必泰[4]和抗生素[5]等。但是这些药物都存在着一些不足,如长时间使用洗必泰会造成牙齿变色、牙龈脱落和刺激口腔黏膜等问题[6],而过度使用抗生素会造成致龋细菌产生耐药性[7]。因此,研究新的口腔抗菌策略具有重要意义。
近年来,光催化技术在抗菌领域的应用引起人们的广泛关注。光催化剂在光诱导下产生活性氧物种(reactive oxygen species,ROS),如羟 基 自由基(·OH)、超氧阴离子(O2-·)等,它们通过破坏细胞膜进入细胞内影响细菌活性[8]。二氧化钛(TiO2)因性能稳定、催化效率高、生物相容性好等优点而被广泛地应用于催化和抗菌领域[9,10],同时,因其长效抗菌效率、表面防腐蚀特性被广泛应用于口腔疾病的治疗[11]。TiO2在紫外光照射下对口腔致病菌白色念珠菌有抑制作用[12]。但TiO2的广泛应用受到其宽带隙(如锐钛矿型TiO2带隙为3.2 eV)的限制[13]。宽带隙使TiO2只能被波长小于390 nm 的紫外光激发,光利用率较低[14,15]。将金属和金属氧化物负载至TiO2的晶格中对其表面进行光敏化,能有效增强TiO2的光利用率[16]。铜等金属掺入TiO2使其带隙向可见光谱移动,这使其在暴露于可见光时表现出光催化活性增强[17]。少量的银掺入TiO2也能在可见光照射下对S. mutans产生抗菌作用[18],但其抗菌机理尚未见报道。
发光二级管(light-emitting diode,LED)固化灯常用于牙科复合树脂等修复材料的光固化,其波长在420~480 nm 可见光范围[19]。有报道将LED 固化灯与光敏剂联合应用于口腔细菌的治疗[20],但是这些光敏剂多为有机染料,具有生物相容性和稳定性较差等缺点。根据已有的研究[21],Ag/ZnO 纳米复合材料与LED 联合使用在5 min 内能杀灭99.8%的S. mutans。Liu 等[13]也发现Ag2O/TiO2复合材料能够在可见光下被激发产生ROS 抑制大肠杆菌的生长。本实验室前期发现单独的Ag2O/TiO2长时间(24 h)作用于S. mutans有明显的抗菌效果[22],但长时间的药物作用不利于牙科疾病的治疗。基于上述工作,本研究将Ag2O/TiO2复合材料与牙科常用的LED 固化灯结合,测定材料在LED 光照下短时间(5 min)的抗菌活性以及抗菌机理,为其用于牙科疾病治疗提供理论基础。
1 实验和方法
1.1 试剂和仪器
试剂:钛酸四丁酯(TBT)(天津百世有限公司),硝酸银(AgNO3)、N-乙酰-L-半胱氨酸(NAC)(阿拉丁试剂有限公司),活死细菌染色试剂盒LIVE/DEAD BacLightTMBacterial Viability Kit1897713(Thermo Fisher 公司),对苯二甲酸(TA)、氯化硝基四氮唑蓝(NBT)(Adamas 试剂有限公司),厌氧产气袋(三菱瓦斯化学株式会社AnaeroPack),二氯二氢荧光素-乙酰乙酸酯(DCFH-DA)(Sigma 有限公司);上述试剂均为分析纯,使用前未经进一步纯化;变异链球菌UA159 (Streptococcus mutansUA159,S. mutans)来自武汉大学口腔医学院,培养基为心浸液肉汤培养基(BHI,Oxoid 公司)和琼脂粉(Bio-Froxx 生物试剂公司)。
仪器:D8 ADVANCE 型X 射线粉末衍射仪(XRD,Bruker 公 司),JSM 5510LV 型 扫 描 电 镜(SEM,日本电子株式会社),GeminiSEM 300 型场发射 电 子 扫 描 电 镜(FE-SEM,Carl Zeiss 公 司),F-4700 型荧光分光光度计(日本电子株式会社),UV-2600 型紫外-可见分光光度计(UV-Vis,岛津公司),Ⅸ73 型倒置荧光显微镜(奥林巴斯公司);采用牙科临床常用的LED55-B 型LED 灯(TPC 医疗器械有限公司,420 nm<λ<480 nm,150 mW/cm2)作为光源,灯源截面直径为0.6 cm,灯源与混合液液面保持0.5 cm 的距离。
1.2 Ag2O/TiO2的制备和表征
Ag2O/TiO2的制备参照文献方法[23]。取2 mL TBT 溶液(质量分数98%)逐滴加入60 mL 冰醋酸中,超声分散后将混合液倒入反应釜中,于160 °C反应5 h,8 000 r/min 离心10 min,所得沉淀经洗涤、干燥后研磨得到白色TiO2粉末。将Ag2O 和TiO2按摩尔比1∶10 制备Ag2O/TiO2。称取0.2 g 合成的TiO2超声分散于25 mL 去离子水中,与25 mL 20 mmol/L AgNO3溶液超声混合,在避光条件下向上述混合液中逐滴加入25 mL 0.2 mol/L NaOH 溶液,反应30 min 后以8 000 r/min 转速离心10 min,所得沉淀经洗涤、干燥后研磨得到淡黄色Ag2O/TiO2粉末。
样品的组成通过XRD 在2θ=10°~80°范围内表征,漫反射光谱(DRS)通过紫外-可见分光光度计在200~800 nm 范围扫描获得,形貌通过FE-SEM观察。
1.3 抗菌实验和活死细菌染色
过夜培养的S. mutans用BHI 液体培养基稀释至2×107CFU/mL,分别与终浓度为0.125、0.250、0.500 mg/mL 的Ag2O/TiO2BHI 悬浮液和1 mg/mL 的TiO2BHI 悬浮液在96 孔板中混合均匀,总体积为120 μL。LED 固化灯光照5 min,将菌液倍比稀释后取10 μL 均匀涂布在培养皿上,于37 °C 培养24 h 后进行平板计数。未被材料和LED 光作用的细菌设为对照组,实验重复3 次。
用活死细菌染色试剂盒对光照作用完成后的菌液进行染色处理0.5 h。其中染色剂SYTO 9 和PI 的终浓度分别为6 μmol/L 和30 μmol/L。取10 μL 染色后的菌液滴加到载玻片上,用荧光显微镜观察。未被材料和LED 光作用的细菌作为对照组。
1.4 细菌形貌观察
LED 固 化 灯 照 射Ag2O/TiO2(0.500 mg/mL)和S. mutans的混合液5 min,用2.5% 戊二醛在4°C 固定细菌细胞2 h,然后用酒精(50%)将细菌脱水3 min,再分别用75%、85%、95%和100%酒精进行梯度脱水,用FE-SEM 观察细菌的形貌。未被材料和LED 光作用的组设为对照组。
1.5 ROS 检测
反应过程中产生的ROS 利用TA 和NBT 检测。TA 本身无荧光,但与·OH 反应生成2-羟基对苯二甲酸复合物时产生荧光,且荧光强度与·OH 浓度直接相关;NBT 在259 nm 处有吸收峰,当与反 应 后 此 吸 收 峰 消 失[24]。将0.125、0.250、0.500 mg/mL 的Ag2O/TiO2悬浮液分别与终浓度为20 μmol/L TA 溶液和20 μmol/L NBT 溶液混合,LED光照5 min 后检测混合溶液在315 nm 光的激发下,425 nm 处发射峰的荧光强度和259 nm 处吸收峰的光强度。
细胞内ROS 利用荧光探针DCFH-DA 检测。DCFH-DA 本身没有荧光,进入细胞后被酯酶水解生成DCFH。细胞内的ROS 能够氧化无荧光的DCFH 生 成 有 荧 光 的 二 氯 荧 光 素(DCF)[25]。用LED 分 别 光 照0.125、0.250、0.500 mg/mL 的Ag2O/TiO2和2×108CFU/mLS. mutans混 合 液,再向体系中加入100 μmol/L DCFH-DA,检测混合溶液在488 nm 光激发下,在535 nm 处发射峰的荧光强度。
2 结果与讨论
2.1 Ag2O/TiO2复合材料的表征
图1(a)为复合材料的XRD 图,所合成的TiO2衍射峰与锐钛型TiO2(JCPDS 4-477)的特征峰相一致;复合材料中除了能观察到TiO2的衍射峰以外,还能观察到Ag2O 的特征峰(JCPDS 1-1041),表明Ag2O/TiO2成功合成。图1(b)是合成样品的DRS图,TiO2仅能吸收波长小于390 nm 的光,负载Ag2O颗粒后,Ag2O/TiO2在200~800 nm 波长范围内都表现出高的吸收,表明Ag2O/TiO2具有广谱的光吸收能力。TiO2和Ag2O/TiO2的SEM 图分别如图1(c)和(d)所示,可以观察到TiO2为直径1~2 μm 的微球,TiO2负载Ag2O 后形貌和大小均无明显改变。
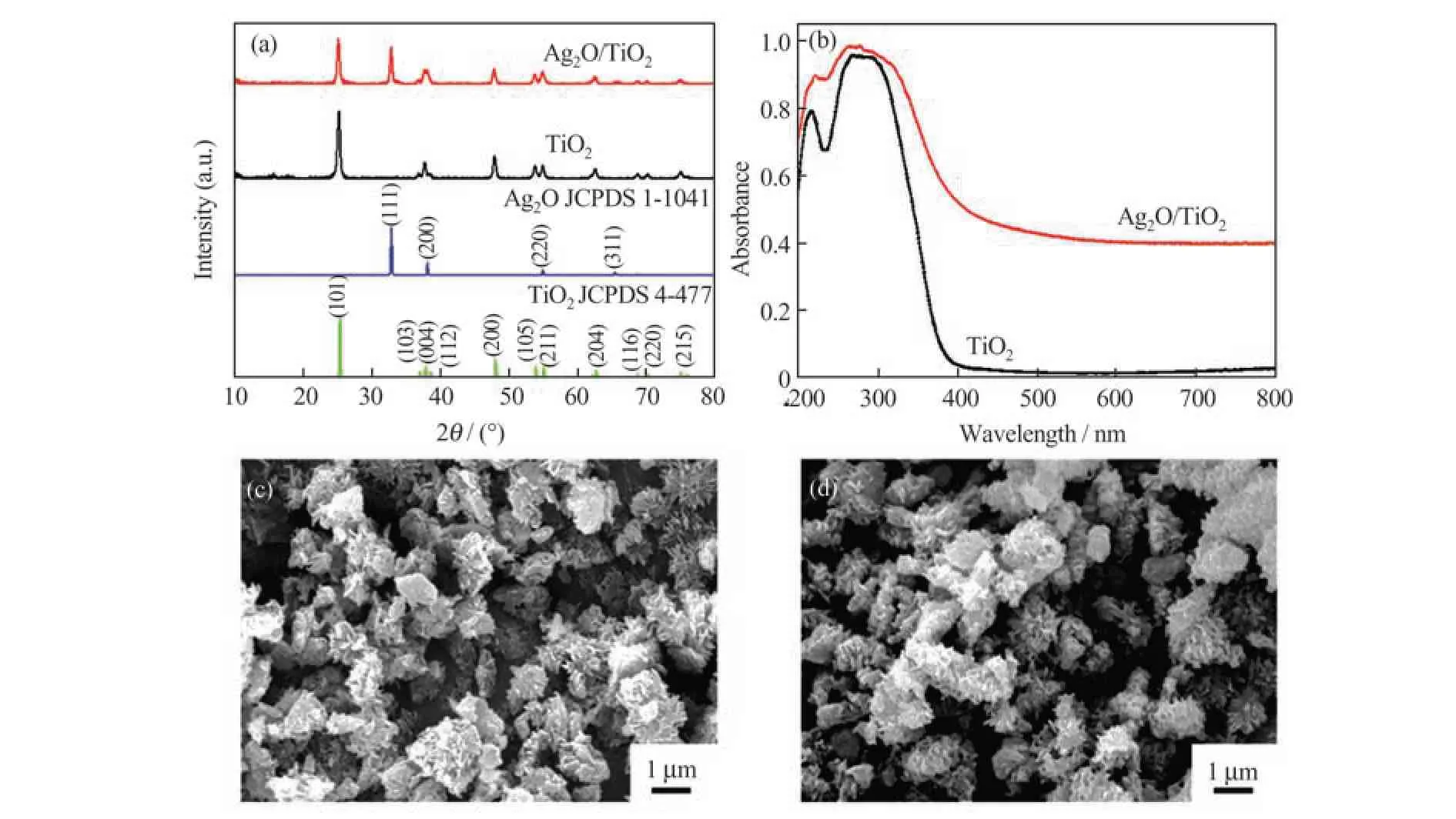
图1 Ag2O/TiO2的表征(a)XRD 图;(b)DRS 图;TiO2(c)和Ag2O/TiO2(d)的SEM 图Fig.1 Characterization of Ag2O/TiO2:(a)XRD patterns;(b)DRS spectra;SEM images of TiO2(c)and Ag2O/TiO2(d)
2.2 Ag2O/TiO2+LED 对S. mutans的 抗 菌 活 性
图2(a)~(b)显 示 了LED 光 照 下Ag2O/TiO2对S. mutans的抗菌活性。由图2(a)可知,1 mg/mL TiO2在5 min LED 光照下对浮游态S. mutans几乎无抗菌作用,0.500 mg/mL Ag2O/TiO2在无LED 光照时对S. mutans的存活数量也无明显影响(图2(b))。但Ag2O/TiO2在LED 照射5 min 后,S. mutans的菌落数明显减少。与无光照相比,LED 光照使0.125、0.250 mg/mL Ag2O/TiO2作用S. mutans的菌落数的lgCFU 分别下降了1.33 和3.58,使0.500 mg/mL Ag2O/TiO2将S. mutans全部杀死(图2(b))。以上结果表明LED 光照有效增强了Ag2O/TiO2在短时间内对S. mutans的杀灭作用。根据报道,氧化铜纳米颗粒对S. mutans的最低抑菌浓度为1 mg/mL[26];二氧化铈纳米颗粒对S. mutans的最低抑菌浓度为1 mg/mL[27];银修饰的还原石墨烯纳米复合物对S. mutans的最低抑菌浓度为1.28 mg/mL[28];锂掺杂的生物玻璃对S. mutans的最低抑菌浓度为50 mg/mL[29];1 mg/mL Ag/ZnO 在LED 光 照 条 件下能杀死99.8%的S. mutans[21]。可见,利用LED光照增强Ag2O/TiO2抗菌活性,可以使用相对较小量的催化剂达到与文献相当的抑菌效果。
为了更加直观地观察LED 光照增强Ag2O/TiO2的抗菌效果,加入荧光染色剂SYTO 9(绿色荧光)和PI(红色荧光)分别对活、死细菌进行染色。如图2(c)所示,未经处理的空白组(Control)和仅用LED 或仅 用Ag2O/TiO2作用5 min 的 组 别,呈现 的几乎都是绿色荧光,表明上述操作均不能杀灭浮游态S.mutans;而在Ag2O/TiO2与LED 固化灯联用的组别中,可以看到荧光全部呈现红色,说明浮游态S. mutans几乎被完全杀灭。
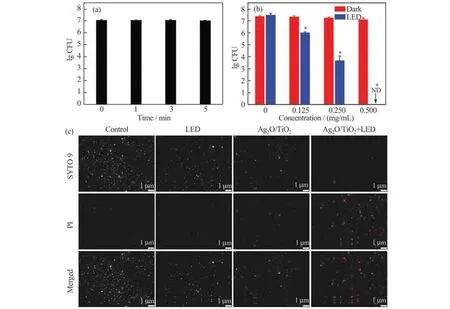
图2 LED 光照下Ag2O/TiO2对S.mutans的抗菌活性(a)LED 光照下TiO2作用后的细菌存活率;(b)有无LED 光照下Ag2O/TiO2作用后的细菌存活率;(c)有无LED 光照下Ag2O/TiO2作用后S.mutans的荧光染色照片;ND:未检测到细菌;*p<0.05:与Ag2O/TiO2同浓度无光照处理组存在显著差异Fig.2 Antibacterial activity of Ag2O/TiO2againstS. mutansunder LED light(a)Bacteria viability of TiO2under LED light;(b)bacteria viability of Ag2O/TiO2with or without LED light;(c)fluorescence staining ofS.mutanswith Ag2O/TiO2with or without LED light;ND:no bacteria were detected;*p<0.05:significantly different from the group without LED illumination at equivalent Ag2O/TiO2doses
2.3 Ag2O/TiO2+LED 作 用 后S. mutans的 形 貌
细菌结构的破坏是导致其死亡的原因之一。如图3(a)~(d)所示,在未经处理的空白组(图3(a))和仅用LED(图3(b))或仅用Ag2O/TiO2作用5 min(图3(c))的组别中,细菌细胞表面光滑圆润,形貌未受到影响。而在Ag2O/TiO2与LED 联用(图3(d))的组别中,可以明显观察到细菌细胞表面变得粗糙、皱缩,出现破损,表明细菌遭到破坏。
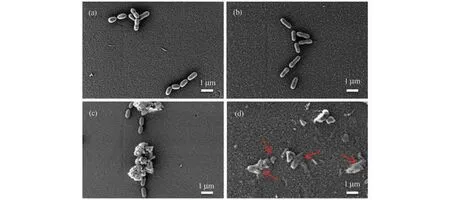
图3 LED 光照下Ag2O/TiO2作用于S.mutans的FE-SEM 图(a)空白组;(b)LED;(c)Ag2O/TiO2;(d)Ag2O/TiO2+LED;红色箭头指示细胞破损Fig.3 FE-SEM images of Ag2O/TiO2onS. mutansunder LED light(a)Control;(b)LED;(c)Ag2O/TiO2;(d)Ag2O/TiO2+LED;The red arrow indicates cell damage
2.4 Ag2O/TiO2+LED 产 生 的ROS 种 类
光催化材料在光照条件下产生的ROS 主要为·OH 和O2-·[11]。本文考察了LED 光照下Ag2O/TiO2产生的ROS 种类,结果如图4(a)~(d)所示。为了检测LED 光照Ag2O/TiO2所产生的ROS 种类,引 入·OH 的 捕 获 剂TA 和O2-·的 捕 获 剂NBT。Ag2O/TiO2和TA 在无LED 光照条件下作用5 min,反应体系中仅0.500 mg/mL 的Ag2O/TiO2可以检测 到 少 量 的·OH 产 生(图4(a));而Ag2O/TiO2在LED 光照后,即使Ag2O/TiO2浓度低至0.125 mg/mL 也能产生·OH,且·OH 的生成量显著高于未加光照的高浓度组的生成量(图4(b))。图4(c)和(d)是NBT 捕获O2-·的实验结果,可以看到,无论在有或无LED 光照射下,Ag2O/TiO2均没有O2-·的产生。以上结果表明,在LED 光照下Ag2O/TiO2的体系中产生的ROS 为·OH。
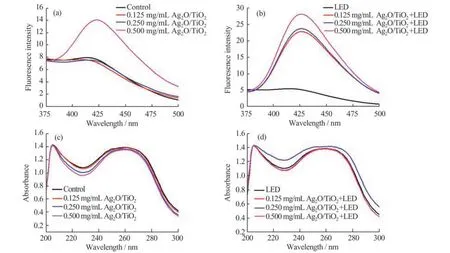
图4 LED 光照下Ag2O/TiO2产生的ROS 种类Ag2O/TiO2+TA 在无光照(a)和LED 光照(b)下的UV-Vis 图;Ag2O/TiO2+NBT 在无光照(c)和LED 光照(d)下的UV-Vis 图Fig.4 ROS species produced by Ag2O/TiO2under LED light UV-Vis spectra of Ag2O/TiO2+TA without(a)and with (b)LED light;UV-Vis spectra of Ag2O/TiO2+NBT without(c)and with (d)LED light
2.5 LED 光照增强Ag2O/TiO2抗菌活性的机理
光催化材料在光照时产生ROS,这些ROS 进入细菌内部会氧化DNA、脂质、蛋白质等生物大分子,导致细菌死亡[30]。
为了探究Ag2O/TiO2在LED 光照下是否通过产生ROS 发挥抗菌作用,加入ROS 捕获剂NAC 对材料在光照下产生的ROS 进行捕获并测定其抗菌活性。由图5(a)可知,单独的NAC (5 mmol/L)在LED 光照下对S. mutans无抗菌作用;Ag2O/TiO2+LED 能 够 在5 min 内 杀 灭S. mutans;而Ag2O/TiO2+LED 组 在 加 入NAC 后,S. mutans的存活率与空白组相比几乎无改变。上述结果表明,LED 增强Ag2O/TiO2的抗菌活性主要通过光照使材料产生ROS,从而发挥抗菌作用。
为了进一步确定ROS 能否进入细菌细胞内使细菌发生氧化损伤,采用DCFH-DA 荧光探针检测胞内ROS。如图5(b)所示,无光照条件下Ag2O/TiO2作用5 min 仅产生低的荧光强度,表明胞内ROS 产 生 较 少;而LED 光 照Ag2O/TiO2作 用S. mutans5 min 后,荧光强度显著提高,说明LED光照Ag2O/TiO2使S. mutans细胞内的ROS 显著地增加(图5(c))。这些ROS 氧化了胞内生物大分子,导致了细菌死亡。
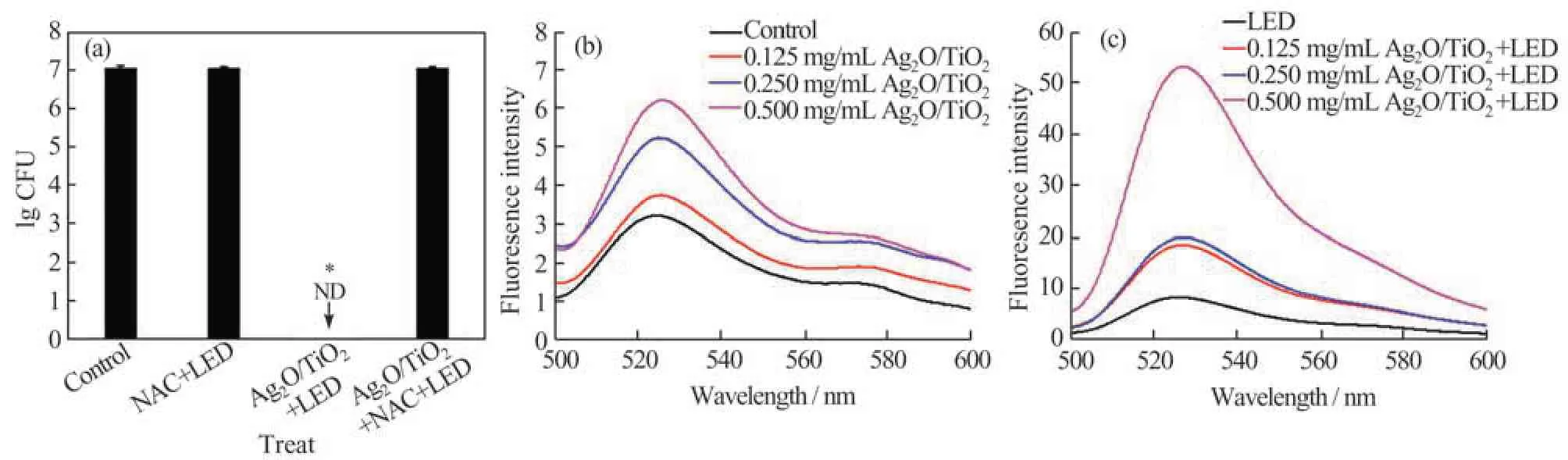
图5 LED 光照增强Ag2O/TiO2抗菌活性机理(a)细胞存活率;无光照(b)和LED 光照(c)下的胞内ROS 含量;ND:未检测到细菌;*p<0.05:与空白组存在显著差异Fig.5 Mechanism of LED light enhancing the antibacterial activity of Ag2O/TiO2(a)Bacteria viability;intracellular ROS content of Ag2O/TiO2without(b)or with (c)LED light;ND:no bacteria were detected;*p<0.05:significantly different from control
3 结 语
本文将Ag2O/TiO2复合材料与牙科常用LED固化灯结合,测定在LED 短时间(5 min)照射下Ag2O/TiO2复合材料对龋齿主要致病菌S. mutans的抗菌活性,并探讨了其作用机理。根据本文的结果,LED 固化灯光照显著增强了Ag2O/TiO2复合材料在短时间内对S. mutans的杀灭能力。其机制涉及LED 光照使Ag2O/TiO2产生·OH,破坏了细菌细胞结构,并进入细菌细胞内,促使细菌细胞内ROS含量增加,从而破坏生物大分子的功能。LED 光照射Ag2O/TiO2复合材料的抗菌治疗方法简便、易行,作用时间短,抗菌效果显著,具有应用于牙科临床抗菌的潜力。

