烟草黑胫病生防菌筛选及对根际土壤微生物群落的影响
杨应美, 卢灿华, 罗朝旺,苏家恩,吴德喜, 夏振远
(1.云南农业大学植物保护学院,昆明 650201; 2.云南省烟草农业科学研究院,昆明 650021; 3.云南农业大学烟草学院,昆明 650201;4.云南省烟草公司大理州公司,云南 大理 671000)
【研究意义】烟草黑胫病(Phytophoraparasiticavar.nicotiana)是全球烟区普遍发生的一种重要土传病害,在全球引起的经济损失通常难以估计[1],是制约中国烟草优质安全生产的重要因素[2]。【前人研究进展】目前,防控烟草黑胫病的主要措施是化学防治,但接踵而至的是黑胫病抗药性的增强,且造成大量的农药残留,进而破坏了土壤环境[3]。此外,在烤烟种植过程中,植烟土壤由于长期使用化肥,导致土层板结,肥力下降,土壤微生物多样性减少,将严重影响烟叶品质[4]。而生防菌既可以抑制病原菌[5],又可以改良农作物田间土壤[6],还可以诱导植物抗病基因的表达[7]。生防菌、病原菌、植物、土壤微生物4者之间是环环相扣、密切互作的。生防菌的应用会影响根际土壤微生物群落的变化,根际环境生物多样性是影响烟病害的重要因素[8-9]。烟草根际微生物群落结构越丰富,多样性越高,病原菌越难存活,烟草根际土中有益微生物数量会增加,潜在致病菌等有害微生物数量会减少,烟草的抗病能力会增强,烤烟的产质量就会越高[10-11]。因此,施用生防菌防治烟草黑胫病是一种有效途径。陆宁[12]、张永春[13]、王万能[14]、杨廷[15]、张慧丽[16]、赵秀香[17]等做了相关研究报道。【本研究切入点】针对云南省烟草种植面积较大,烟草产区普遍发生烟草黑胫病,对烟草产业的经济影响十分巨大。本研究开展了烟草黑胫病生防菌的筛选鉴定,并研究其对烟草根际土壤中微生物群落的影响。【拟解决的关键问题】筛选鉴定烟草黑胫病生防菌,丰富云南省烟草黑胫病生防菌资源,评价生防菌对烟草根际土壤中疫霉菌的孢子数、烟草根际微生物的群落结构、微生物的多样性和丰富度的影响,为研究烟草黑胫病发生的微生态机制及其生物防治提供理论指导。
1 材料与方法
1.1 根际土壤微生物的诱集
采用根际土壤微生物诱集法[18]诱集根际微生物,具体步骤如下。
步骤1,微生物培养。①分选土壤:将土壤样品去除杂质和较大块状物后,装入培养皿中,用蒸馏水将土壤润湿;②制作微生物诱集装置:首先在微孔滤膜边缘涂布胶水,将不锈钢平底垫圈置于微孔滤膜上;然后向垫圈内腔加入固体培养基;再用胶水涂布金属垫圈上表面,盖上另一微孔滤膜;将所述微生物诱集装置置于①中湿润的土壤上,轻轻压实该诱微生物集装置,确保微孔滤膜与土壤充分接触,再用土壤将微生物诱集装置完全覆盖,并用蒸馏水再次润湿土壤;③培养:盖好培养皿,用封口膜将玻璃培养基封好,即制作成微生物培养装置,并置于培养箱培养。步骤2,微生物分离。①制备菌悬液并梯度稀释:从培养箱中取出经过微生物诱集的培养装置,将固体培养基捣碎,加入无菌水放置10 min后,梯度稀释至10-4;②涂布寡营养平板并培养:取10-4菌液涂布于寡营养培养基,每个梯度涂布5皿,于超净工作台吹干,并置于培养箱培养。步骤3,微生物保存。①根据菌落形态、颜色等不同,将代表性单菌落划线于纯化培养基平板,置于培养箱培养,获得单菌落即为纯培养物;②接种纯培养物于保存培养基,置于恒温振荡培养箱培养后,离心收集菌体,加保存液悬浮菌体,置于-80 ℃超低温冰箱保藏。
1.2 烟草黑胫病拮抗细菌的筛选
将分离获得的单菌落采用平板拮抗的方式进行拮抗菌的筛选。用直径0.5 cm的无菌打孔器打出黑胫病菌饼接到燕麦琼脂培养基中心,在距离中心位置约3 cm的4个点接种拮抗菌菌块。将培养皿放入28 ℃ 的培养箱中培养5 d后,测定菌落半径,并采用公式(1)计算抑菌率。
抑菌率(%)=(对照菌落半径-处理菌落半径)/对照菌落半径×100
(1)
1.3 烟草黑胫病拮抗细菌防效测定
选取抑菌率较好的2株拮抗菌79-14和05-1506进行温室盆栽试验,试验设3个处理:处理1,拮抗菌79-14;处理2,拮抗菌05-1506;处理3(CK),清水对照。苗龄60 d的烟苗移栽缓苗7 d后采用灌根法接种烟草疫霉菌,接种浓度为1×105个/mL(每株100 mL),病原菌接种后6 h内完成拮抗菌灌根处理,处理1灌根拮抗菌79-14,浓度为1×105CFU/mL(每株100 mL);处理2灌根拮抗菌05-1506,浓度为1×105CFU/mL(每株100 mL);处理3灌根100 mL 蒸馏水。每个处理进行3个平行试验,每个平行试验处理10株烟苗。30 d后调查发病情况,并按公式(2)和公式(3)分别计算病情指数和防治效果。参照Zhao等[19]的根际土采集方法,按发病重度、中度、轻度和不发病各采取4株烟草根际土样,混合均匀,放入无菌密封袋装入冰盒,带回实验室-80 ℃ 保存,用于实时荧光定量PCR检测以及细菌和真菌群落结构与多样性的分析。
病情指数=[∑(各病级株数 × 各病级代表值)/(调查总株数×最高病级代表值)]×100
(2)
防治效果(%)=(对照病情指数-处理病情指数)/对照病情指数 ×100
(3)
1.4 生防菌的鉴定
取1.5 mL活化的菌液,用DNA提取试剂盒提取基因组DNA。以细菌基因组DNA为模板,13F(5′-TGTAAAACGACGGCCAGT-3′)和13R(5′-CAGGAAACAGCTATGACC-3′)为通用引物进行16S rDNA基因序列扩增。扩增产物经过Trans-T1 感受态细胞进行连接,连接产物用T5 Zero进行转化,取50 μL转化产物在LB培养基上培养16 h,得到菌落,经菌落 PCR产物经凝胶电泳检测后送上海英潍捷基测序公司测序。测序后利用BLAST软件进行同源性比较,用软件MEGA 7.0的Neighbor-Joining 法构建系统发育树。
1.5 土壤中烟草疫霉菌的MGB探针实时荧光定量PCR检测
采用血球计数板计数法将烟草疫霉菌游动孢子悬浮液添加无菌水稀释成 1×108、1×107、1×106、1×105、1×104和 1×103共6 个浓度,分别取 2 mL,加入到装有2 g土壤(无烟草疫霉菌)的离心管中,混匀,以加入无菌水灭菌土壤为空白对照,将样品自然风干,每个样品3个重复,使用PowerSoil DNA Isolation Kit(MO BIO,Inc.)试剂盒,提取其基因组 DNA,用于扩增绘制标准曲线。利用实验室前期筛选到的特异性探针引物ZH1:5′-GCAGATCTTGCCGTTCGAAT-3′,ZH2:5′-GCTCGCTTGCAGGTTTATT TG-3′,P-ZH:FAM-5′-CTACACGGTACAACAGCT-3′-NFQ-MGB,同时扩增标准品和实验土壤DNA样品。扩增反应体系:2×TaqMan Fast qPCR Master Mix 10 μL,探针引物各0.4 μL,DNA模板2 μL,DNF Buffer 2 μL,用 ddH2O 补足体积至20 μL。反应条件:94 ℃ 预变性3 min;94 ℃ 变性5 s,56 ℃ 退火15 s,72 ℃ 延伸30 s,45个循环。每个土样做3个平行实验,结果取平均值。
1.6 烟草根际土壤细菌和真菌多样性分析
使用MP Fast®DNA试剂盒(MP Biomedicals,CA,USA)提取土壤DNA,使用PowerClean®DNA Clean-up Kit(MoBio,CA,USA)进行纯化,使用NanoDrop ND-1000分光光度计(NanoDrop Technologies,DE,USA)检测DNA浓度和纯度,然后委托北京诺禾致源科技股份有限公司完成高通量测序。烟草根际土壤细菌扩增子多样性分析中应用细菌16S rDNA 的V3~V4 区序列,所用引物为341F:5′-CCTAYGGGRBGCASCAG-3′,806R:5′-GGACTACNNGGGTATCTAAT-3′,真菌扩增子多样性采用ITS1-5F区序列,引物为ITS5-1737F:5′-GGAAGTAAAAGTCGTAACAAGG-3′,ITS2-2043R:5′-GCTGCGTTCTTCAT CGATGC-3′。
1.7 数据处理与分析
经高通量测序得到的双端序列经拼接与质控过滤得到优化序列,采用Usearch(version 7.0 http://drive5.com/uparse/)进行OTU聚类,对97%相似水平的OTU与Unite(Release 7.2 http://unite.ut.ee/index.php)数据库比对并进行OTU物种注释;采用软件Mothur(version v.1.30.1)计算Alpha多样性指数,Alpha多样性分析,可以反映微生物群落的丰富度与多样性。
2 结果与分析
2.1 烟草黑胫病生防菌的筛选及鉴定
通过土壤细菌诱集法,从来自云南省不同地区的20份植烟土壤中分离了120株土壤细菌,将每株菌进行平板拮抗试验,结果找出2株拮抗烟草黑胫病最明显的菌株79-14和05-1506,其抑菌率分别为76%和72%(表1)。防效试验结果表明,2株拮抗菌的防效分别为64%和76%(表2)。将2株生防菌79-14和05-1506的16S rDNA 序列通过BLAST程序对比分析,发现79-14与贝莱斯芽孢杆菌(Bacillusvelezensis)进化关系最近,同源性达100%,05-1506与苏云金芽孢杆菌(B.thuringiensis)进化关系最近,同源性100%(图1),由此将2株菌鉴定为芽孢杆菌。

表1 平板对峙结果
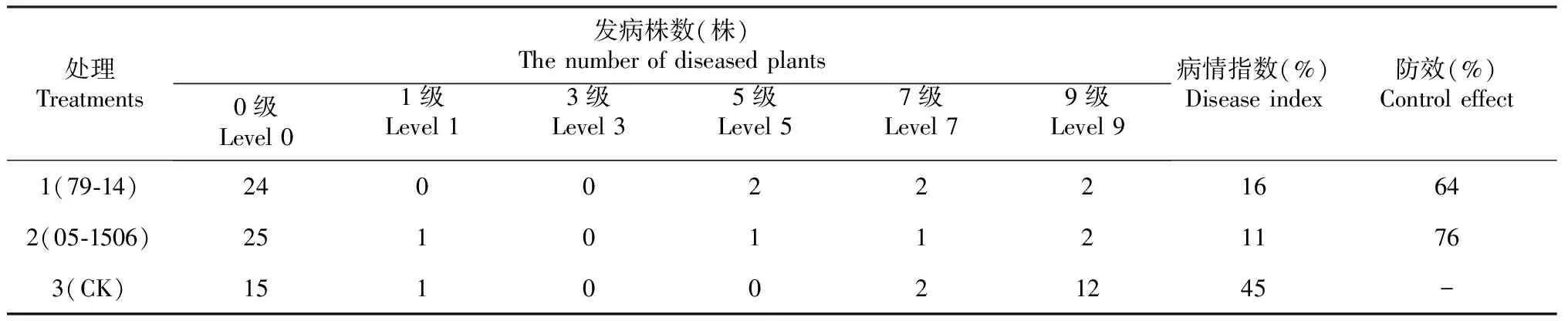
表2 生防菌盆栽防效

图1 菌株79-14和05-1506的16S rDNA 系统发育树
2.2 根际土壤中烟草疫霉菌的MGB探针实时荧光定量分析
由表3可知,处理1、处理2和处理 3(CK)的每克土壤所含烟草疫霉菌孢子数量分别为3.02×104、8.13×103和4.07×106个,处理1和处理2均比处理 3(CK)降低了2个数量级。可见,施入筛选的2株芽孢杆菌 79-14 和 05-1506 后显著降低了土壤中烟草疫霉菌孢子的数量,菌株05-1506降低程度更大。

表3 土壤中烟草疫霉菌检测结果
2.3 烟草根际土壤细菌和真菌群落 α 多样性分析
对烟草根际土壤中细菌和真菌群落进行测序分析,细菌 α 多样性指数总体上均高于真菌,说明细菌在烟草根际土壤微生物中占主导地位。各处理中细菌和真菌测序覆盖率分别在98%和 99%以上,表明样品中的序列绝大多数被测出,测序结果能够较好反映烟草根际土壤细菌、真菌群落组成的真实情况(表4)。

表4 不同处理根际土壤细菌和真菌群落的a多样性指数
在细菌群落 α 多样性指数中,OTUs 数目和Chao1指数排序均为 处理3 >处理1 >处理2,Shannon 指数排序为处理3 >处理2 >处理1;在真菌群落 α 多样性指数中,OTUs 数目和Chao1指数排序均为处理2 >处理1 >处理3,Shannon 指数排序为处理1 >处理2 >处理3,说明施入芽孢杆菌提高了土壤真菌多样性,降低了土壤细菌多样性。
2.4 生防菌对烤烟根际土壤细菌和真菌群落结构的影响
由图2可知,各处理烤烟根际土壤细菌丰富度前10的门包括变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、厚壁菌门(Firmicutes)、不明细菌(unidentified_Bacteria)、拟杆菌门(Bacteroidota)、酸杆菌门(Acidobacteriota)、绿弯菌门(Chloroflexi)、蓝藻门(Cyanobacteria)、疣微门(Verrucomicrobiota)和粘球菌门(Myxococcota)。细菌相对丰度大于 10%的门主要有变形菌门、放线菌门、厚壁菌门、不明细菌和拟杆菌门,其中变形菌门的丰度最高,占各样本总有效序列30%以上。处理2和处理1的变形菌门和拟杆菌门相对丰度比处理3的高,放线菌门比处理3的低。厚壁菌门相对丰度处理2﹥处理3﹥处理1。说明施入芽孢杆菌改变了烤烟根际土壤细菌群落优势种群的比例。

图2 生防菌在门水平上对样本细菌(a)和真菌(b)物种组成的影响
各处理烤烟根际土壤真菌丰富度前10的菌门包括子囊菌门(Ascomycota)、壶菌门(Chytridiomycota)、被孢霉菌门(Mortierellomycota)、罗兹菌门(Rozellomycota)、担子菌门(Basidiomycota)、球囊菌门(Glomeromycota)、油壶菌门(Olpidiomycota)、捕虫霉门(Zoopagomycota)、Aphelidiomycota门和芽枝霉门(Blastocladiomycota)。真菌相对丰度大于 10%的门主要有子囊菌门、壶菌门和被孢霉菌门,其中子囊菌门的丰度最高,占各样本总有效序列60%以上。处理2和处理1的子囊菌门、罗兹菌门和担子菌门相对丰度高于处理3的相对丰度,壶菌门和被孢霉菌门的相对丰度低于处理3的相对丰度。说明施入芽孢杆菌能提高烤烟根际土壤真菌群落优势种群子囊菌门、罗兹菌门和担子菌门的比例,而降低壶菌门和被孢霉菌门的比例。
3 讨 论
目前已报道的烟草黑胫病生防菌主要是通过高温加热法筛选获得的芽孢杆菌,还有少量的荧光假单胞菌,生防资源范围较为狭窄。土壤是生防菌的重要来源,但土壤中难培养微生物几乎占到99%,其培养技术的核心是抓住细菌自身特性、模拟天然生存条件、使用寡营养培养基、适当延长培养时间[20]。本研究团队前期发明了“一种土壤微生物诱集的方法”[18],该方法打破了常规分离法,突破性地模拟了土壤细菌的天然生存环境,获得了包括“难培养、繁殖速度慢”的土壤细菌,拓展了细菌的分离深度,提高微生物活性,更加高效的筛选出有用的生防菌,烟草黑胫病防治方面有着更大研究潜力。
芽孢杆菌是目前研究最多、也是最重要一类的生防细菌,它们能产生耐热抗逆芽孢,有易繁殖、生长速度快、适应性强和防治效果好等特点,有利于生防农药的生产和拮抗菌在环境中存活和定殖[21],与真菌和放线菌生防菌剂相比,更受人们的关注。Torres等[22]研究发现贝莱斯芽孢杆菌(B.velezensis)对番茄,花椒,南瓜和黄瓜等一些蔬菜的地上鲜重有促进作用,而且具有一定的抑制真菌生长的能力;易磊[23]研究发现贝莱斯芽孢杆菌CR-502(B.velezensisCR-502)具有抑制黑曲霉菌和多种植物病原菌的正常生长;李超峰[24]研究发现苏云金芽孢杆菌(B.thuringiensis)用于配制生物杀虫剂。本研究采用“土壤细菌诱集法”分离出了120份土壤细菌,最终获得了2 株芽孢杆菌79-14和05-1506,丰富了同领域的研究内容,为同类研究提供重要参考和补充,为烟草黑胫病的生物防治提供了新的资源。
值得注意的是,本研究在实验室平板对峙中芽孢杆菌79-14的抑菌率比05-1506的大,但在盆栽试验中79-14的防治效果比05-1506的低12%,通过分析,一方面可能是79-14的拮抗性能和定殖能力比05-1506的弱。曾衡等[25]研究发现,生防菌的防治效果与该菌在土壤和植株上的定殖能力有关。实验室平板对峙和温室盆栽土壤在温度、养分、水分等方面都有着很大的差距。因此,生防菌对烟草黑胫病菌的拮抗能力并不等同于防治能力,生防菌在使用过程中,环境对其影响较大,所以,在进行生物防治时,应高度重视生防菌的环境适应性。另一方面可能是土壤根际微生物组的作用使得平板上抑制效果好的菌株在土壤条件中生长不理想,导致试验结果存在差异。因此,本研究进一步研究了芽孢杆菌79-14和05-1506对根际土壤微生物群落的作用。
生防菌对土壤中的细菌、真菌和病原菌都具有调控作用。樊祖清等[26]研究表明,在烟田施用解淀粉芽孢杆菌菌剂后,改善了土壤微生物结构,增加了有益菌的含量并提高了烤烟的产量。连玲丽等[27]研究发现,生防芽孢杆菌EN5处理改善了根际土壤中细菌群体的多样性。本研究也发现,施入芽孢杆菌79-14和05-1506后,烟草根际土壤中烟草疫霉菌的孢子数降低了2个数量级,改变了烟草根际土壤细菌和真菌的优势种群比例,提高了烟草根际土壤真菌群落物种多样性和丰富度,但烟草根际土壤细菌多样性和丰富度有小幅度降低,猜测原因可能是采样不充分,本研究只采集了施入生防菌后30 d的土样。有研究表明,多粘类芽孢杆菌在施药后一段时间内对细菌微生物群落影响较小,但随时间的增加,多粘类芽孢杆菌对细菌微生物群落开始产生影响,物种的丰富度及多样性开始增加;多粘类芽孢杆菌药剂对真菌群落的影响较为迅速,但持效期较短[28]。为了更好地研究生防菌对根际土壤细菌群落的影响,应该大量采集施入生防菌后不同时期的土样。
4 结 论
分离出120份土壤细菌,筛选到抗烟草黑胫病效果较好的芽孢杆菌79-14 和05-1506,且防治效果分别为 64%和76%。它们有效降低了土壤中烟草疫霉菌的数量,均比对照约降低了2个数量级,且改变了烟草根际土壤细菌和真菌的优势种群比例,提高了烟草根际土壤真菌的多样性和丰富度,但烟草根际土壤细菌多样性和丰富度有小幅度降低,它们对烟草黑胫病的防控具有重要的应用价值。

