糖脂代谢、ca199、ca242及ca50与2型糖尿病患者骨代谢异常的相关性研究
郭丽娟,葛双雷,许 慧*,朱 筠
(1.应急总医院 检验科,北京100028;2.首都医科大学附属北京潞河医院 骨科,北京101100)
2型糖尿病近些年来发病率较高,由遗传及环境因素共同作用而诱发的一种疾病,其不仅会影响患者的糖脂代谢水平,还会对骨代谢产生一定程度的影响,致使糖尿病患者合并骨质疏松,进一步影响患者的生活质量[1-3]。臧莉等[4]研究发现2型糖尿病患者中,胰腺癌、肝癌、直肠癌等消化道恶性肿瘤发病率较高,认为2型糖尿病发生与消化道恶性肿瘤密切相关。孟佳丽等[5]研究报道,2型糖尿病患者糖脂代谢紊乱可促进血清消化道肿瘤标记物如ca199、ca50水平升高。因此,本研究推测2型糖尿病患者消化道肿瘤标记物水平升高与患者合并骨质疏松是否也存在关联,然而现阶段关于此类研究报道较少。鉴于此,为了进一步明确糖尿病合并骨质疏松有关致病原因,本研究对糖尿病合并骨质疏松与ca199、ca242、ca50相关性进行探究。现报道如下。
1 资料与方法
1.1 一般资料
选择2017年6月-2020年3月至应急总医院就诊的176例2型糖尿病患者作为研究对象,根据双能X线吸收法(DEXA)测定的骨密度检查结果将全部患者分为A组(骨量正常:骨密度(T值)结果低于同龄人峰均值的1个标准差以内,n=61)、B组(骨量减少:T值低于同龄人峰均值的1-2.5个标准差,n=53)、C组(骨质疏松:T值低于同龄人峰均值的2.5个标准差,n=62)。其中A组男42例,女19例;年龄43-76岁,平均年龄(52.68±8.13)岁;病程2-10年,平均(6.31±1.78)年;BMI 22-26 kg/m2,平均(24.26±3.75) kg/m2。B组男35例,女18例;年龄47-72岁,平均年龄(52.77±9.26)岁;病程1-12年,平均(6.45±1.62)年;BMI 23-25 kg/m2,平均(24.39±3.31)kg/m2。C组男39例,女23例;年龄45-78岁,平均年龄(53.12±8.65)岁;病程2-9年,平均(6.14±1.96)年;BMI 22-26 kg/m2,平均(24.70±3.68)kg/m2。各组患者性别、年龄、病程及BMI等资料比较无统计学意义(P>0.05)。
1.2 纳入标准及排除标准
纳入标准:符合2型糖尿病诊断标准[6];骨量分组符合《中国骨质疏松性骨折诊疗指南》标准[7];临床资料齐全。排除标准:其它型糖尿病;严重心肝肾等脏器病变者;不愿意配合者;感染、炎症性疾病;恶性肿瘤者;既往有骨折病史、手术或除了糖尿病以外影响骨代谢的各种因素(甲状腺异常及服用糖皮质激素)。
1.3 观察指标
采集患者来院当日空腹静脉血,离心取上清,空腹血糖(FBG)、2 h餐后血糖(2 h PBG)水平检测方法为己糖激酶法(试剂盒购自美国西门子医学诊断股份有限公司),糖化血红蛋白(HbA1c)检测方法为高压液相色谱法(试剂购自东曹生物科技有限公司)、糖类抗原199(ca199)、糖类抗原(ca242)、糖类抗原(ca50)水平检测方法为化学发光免疫分析法(仪器购自深圳迈瑞生物医疗电子股份有限公司);总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)检测方法为酶法(试剂盒购自美国西门子医学诊断股份有限公司)。并对患者骨密度与上述指标进行相关性分析。
1.4 统计学方法

2 结果
2.1 各组糖脂代谢水平的比较
3组中糖脂代谢因子水平比较,差异均存在统计学意义(P<0.05)。与A组相比,B组及C组FBG、2hPBG、HbA1c、TC、TG、LDL-C水平显著增加(P<0.05);与B组相比,C组FBG、2hPBG、HbA1c、TC、TG、LDL-C水平显著增加(P<0.05),如表1所示。
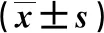
表1 各组糖脂代谢水平的比较
2.2 各组肿瘤标记物水平的比较
3组中肿瘤标记物水平比较,差异均存在统计学意义(P<0.05)。与A组相比,B组及C组ca199、ca242、ca50水平显著增加(P<0.05);与B组相比,C组ca199、ca242、ca50水平显著增加(P<0.05),如表2所示。
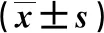
表2 各组肿瘤标记物水平的比较
2.3 相关性分析
在2型糖尿病患者中,骨密度与FBG(r值=- 0.152)、2hPBG(r值=-0.237)、TC(r值=-0.372)、LDL-C(r值=-0.436)、ca199(r值=-0.214)、ca50(r值=-0.185)水平均呈负相关(P<0.05),如表3所示。

表3 骨密度与糖脂代谢因子及肿瘤标记物的相关性分析
3 讨论
研究表明糖尿病与骨质疏松发病密切相关,糖尿病通过多种病理机制影响骨代谢,造成骨质疏松,增加骨折风险,但其机制较为复杂[8]。其中糖尿病性合并骨质疏松可作为糖尿病骨骼系统并发症之一,主要由糖尿病患者代谢紊乱而引发钙磷、铁等多种元素代谢障碍,致使骨量减少,造成骨组织结构改变,从而严重危及患者的生活质量及生命安全[9-11]。因此探究该病的相关指标变化情况对患者防治及预后具有积极作用。
刘帼静[12]等研究报道2型糖尿病患者由胰岛素抵抗所致胰岛素水平增加,进而增加尿液中钙含量,致使体内钙流失过多,对骨质疏松的引发具有促进作用。林珊珊等[13]对50例2型糖尿病患者并发骨质疏松相关危险因素进行探讨,发现2型糖尿病患者骨质疏松的发生与血脂代谢密切相关。本研究糖脂代谢结果显示,FBG、2hPBG、HbA1c、TC、TG、LDL-C水平从低到高依次为A组、B组及C组,两两对比,差异也均存在统计学意义。提示2型糖尿病患者骨质疏松的发生可能与血糖、血脂水平控制不佳相关。为了进一步探究2型糖尿病患者糖脂代谢指标与骨密度的相关性。本研究发现,在2型糖尿病患者中,骨密度与FBG、2hPBG、TC、LDL-C水平均呈负相关。此结果证实患者糖脂代谢紊乱对其骨代谢产生了极为不利的影响。分析原因1)高血糖对患者骨代谢的影响,可能是因为长期高血糖可使晚期糖基化终末产物积累增加,激活氧化应激-蛋白激酶C途径,促进骨细胞凋亡,并抑制骨细胞增殖分化,进而促进骨质疏松的形成[14]。2)血脂异常对骨代谢的影响,可能是因为血液中血脂有一定沉积作用,当脂质代谢紊乱时,脂质可沉积于骨髓中,影响骨折流式,加之骨髓成骨与成脂密切相关,当骨髓中成脂细胞分化异常时,成骨细胞分化也会受到影响,进而影响骨代谢[15]。
研究发现[16-17]2型糖尿病患者易并发消化道恶性肿瘤,目前其病变机制尚不清楚,推测可能与胰岛素抵抗、肥胖、免疫炎症等因素相关。黄燕红等[18]研究报道2型糖尿病并发消化道恶性肿瘤的原因可能与胰岛素抵抗有关。同时孟佳丽等[5]研究发现在排除恶性肿瘤前提下,2型糖尿病患者血清消化道肿瘤标记物如ca199和ca50水平,也呈升高状态,可能与血糖血脂控制不佳有关。而本研究上述结果说明,骨代谢异常也与糖脂代谢异常有关,因此本研究推测患者骨代谢异常是否与消化道肿瘤标记因子也具有一定关联。然而现阶段关于此类研究报道较少。ca199、ca242、ca50是临床上常用于评估恶性消化道肿瘤发生的肿瘤标记物,其水平的升高常预示胰腺、肝胆、胃、结直肠等消化系统肿瘤的发生[19-21]。本研究结果显示,ca199、ca242、ca50水平从低到高依次为A组、B组及C组,两两对比,差异有统计学意义,且相关性分析发现骨密度与ca199、ca50水平均呈负相关。说明1)对于2型糖尿病患者ca199、ca50水平的升高,在排除恶性肿瘤可能外,还应考虑患者是否发生骨质疏松,因此该类指标可成为预测2型糖尿病合并骨质疏松的潜在预测指标。2)推测ca199、ca50可能参与患者骨质疏松疾病进展,但其具体作用机制有待进一步探究。3)ca199、ca50水平的增加可能与长期高糖状态损害胰腺正常组织细胞有关,致使胞内糖蛋白(ca199、ca50)释放入血[22]。
综上所述,随着2型糖尿病患者骨代谢异常程度的增加,其糖脂代谢、ca199、ca242、ca50异常表达更为明显,并与骨密度存在一定相关性。

