2021年ADA/EASD《糖尿病缓解专家共识》与《2022年ADA糖尿病指南:2型糖尿病的预防和治疗中肥胖与体重管理》解读
——糖尿病缓解的定义与治疗策略
刘烨 王海宁
我国糖尿病患病率逐年增加,并呈现年轻化趋势,18~49岁的青壮年人群糖尿病患病率从2010年的3.2%[1],到2018年已达8.8%[2]。目前认为,导致糖尿病疾病负担快速增长的重要原因之一是生活方式快速改变,超重/肥胖的患病率快速增长。我国成人肥胖的患病率从2004年的3.1%上升到2018年的8.1%[3],而在上述2018年糖尿病患病率调查队列中,成人肥胖的患病率已达到16.5%(年龄中位数51.8岁)[2]。同期美国成人肥胖的患病率达42.4%[4]。肥胖及其相关的糖尿病等代谢性疾病已成为严重的世界公共卫生问题。
既往认为2型糖尿病(T2DM)是一种慢性进展性代谢性疾病,需要长期的生活方式和药物干预。从糖代谢正常、糖尿病前期到确诊糖尿病乃至出现糖尿病慢性并发症的过程中,血糖水平逐渐升高。与高血糖相关的病理生理变化,如胰岛素抵抗和胰岛素分泌能力受损也是一个连续、不可逆的过程。然而,随着对糖尿病发病机制的研究深入,新的治疗靶点和治疗方法不断涌现,给糖尿病治疗带来更多选择。初次诊断糖尿病患者接受短期胰岛素强化治疗、解除糖毒性后可使部分患者糖尿病“逆转”,即停用胰岛素可维持正常血糖[5];严格的生活方式干预可有效控制体重并逆转糖尿病的代谢紊乱[6-7];尤其是减重手术的长期随访显示,代谢手术不仅可持久、有效减重,还能够改善代谢紊乱,包括获得“糖尿病缓解”[8-9]。
“糖尿病缓解”这一概念在2009年被首次提出[10],此后经过不断完善,2021年美国糖尿病学会(ADA)和欧洲糖尿病学会(EASD)联合发布《糖尿病缓解专家共识》[11]。同时,2022年新版ADA糖尿病指南《2型糖尿病的预防和治疗中肥胖与体重管理》,也汇总了生活方式、药物及代谢手术的证据,显示随着体重降低幅度的增加,糖尿病缓解的比例也相应增加,指出诱导糖尿病缓解是T2DM治疗的新策略,应成为常规临床实践[12]。本文结合2022年ADA糖尿病指南(以下简称ADA指南)的肥胖与体重管理部分对糖尿病缓解的定义及其策略进行解读。
一、糖尿病缓解的定义与诊断切点
《糖尿病缓解专家共识》建议将停用降糖药物至少3个月后,糖化血红蛋白(HbA1c)<6.5%作为T2DM缓解的诊断标准。既往曾使用的“逆转”、“治愈”等均无法正确描述这一现象,而“缓解”是更为恰当的术语,一方面表示目前的代谢改善已达到非糖尿病的状态,同时也提示这个代谢改善的状态并非永久存在。
“糖尿病缓解”包含几重含义:首先,必须是停用所有降糖药物,血糖水平持续维持正常。对于使用药物干预或代谢手术获得缓解的患者,评价的时间应当是在手术后3个月,且中止降糖药物的时间也必须足够3个月;单纯以强化生活方式干预,因其疗效较药物或手术缓慢,且HbA1c反映的是近3个月血糖的平均水平,建议干预6个月再评估为佳;其次,正常血糖的定义是HbA1c<6.5%。这里强调HbA1c的检测方法需要经过HbA1c标准化项目(NGSP)认证,若存在异常血红蛋白及疾病影响红细胞生存时间、HbA1c检测方法不规范等,HbA1c不能反映真实血糖水平,可用空腹血糖(FPG)<7.0 mmol/L或通过动态葡萄糖监测计算估计的HbA1c(eA1c)<6.5%作为诊断T2DM缓解的替代标准。最后,《糖尿病缓解专家共识》指出糖尿病缓解状态并非永久,处于糖尿病缓解状态的患者仍需每年随访,确定糖尿病缓解状态的存续。迄今为止,没有T2DM被治愈的证据。T2DM缓解后,即使诱导缓解的措施仍被保持,但仍有部分患者的血糖水平可再次升高至需使用降糖药物控制的水平。因此,T2DM缓解的患者仍需定期随访,最好每3个月、最长不超过1年检测1次HbA1c。
既往曾经使用“部分缓解”表示非糖尿病状态持续不超过1年;“完全缓解”表示糖尿病缓解状态持续达1年;“延长缓解”表示糖尿病缓解状态持续超过5年。也有专家提出,根据HbA1c<6.5%、FPG为5.6~6.9 mmol/L,即糖尿病前期状态,定义为部分缓解;而将HbA1c正常(<6.0%)、FPG<5.6 mmol/L称为完全缓解。由于证据有限,关于上述糖尿病缓解的不同诊断切点对糖尿病缓解持续的时长及心血管获益等方面的预测价值尚缺少相关证据。为避免模糊概念,《糖尿病缓解专家共识》不推荐使用“部分缓解”、“完全缓解”此类术语。
二、糖尿病缓解的病理生理机制
目前认为,T2DM缓解与纠正肥胖或显著降低体重和体脂含量、改善胰岛素抵抗和高胰岛素血症、纠正高糖毒性和胰岛β细胞去分化及转分化相关。
T2DM患者糖代谢异常早期,在胰岛素抵抗的背景下,机体为了维持血糖正常,β细胞代偿性分泌更多的胰岛素,但长时间“高负荷”后β细胞功能下降、胰岛素分泌相对不足,血糖不再能够维持从而发生糖尿病[13]。此外,随着病程的进展,β细胞功能进一步衰退乃至耗竭,T2DM不再能够逆转[14]。现已明确,降低体重和体脂含量可显著改善胰岛素抵抗。同时,减重纠正胰岛素抵抗又可改善胰岛β细胞功能障碍或延缓其恶化[6]。此外,超重/肥胖的T2DM患者内脏脂肪增多,脂肪肝和胰腺脂肪沉积(脂肪胰)亦可直接导致胰岛β细胞功能异常[15]。伴随着减重,骨骼肌和胰腺等器官中脂肪沉积减少,β细胞的胰岛素分泌功能也伴有明显改善。因此减重是超重/肥胖T2DM患者达到临床缓解的核心目标和手段,体重减少的程度也是与T2DM缓解率相关性最强的指标[6]。
胰岛β细胞功能障碍的另一重要机制是高糖毒性。高糖状态可导致β细胞去分化及转分化,胰岛素分泌功能失调甚至失活,胰岛素分泌减少70%或以上。其他导致胰岛β细胞去分化的相关因素还包括糖尿病病程、肥胖、脂毒性、胰岛素抵抗等[16]。除糖尿病病程无法改变外,纠正上述因素有利于使去分化的β细胞再分化为成熟β细胞,重获胰岛素分泌能力[17]。
基于上述病理生理机制,糖尿病缓解的概念仅适用于T2DM患者,我国学者提出了预测糖尿病缓解机会的ABCD原则:A代表胰岛相关抗体,不存在破坏胰岛β细胞的相关抗体;B代表BMI,BMI≥25 kg/m2易出现缓解;C代表C肽和并发症,空腹C肽≥1.1 μg/L、餐后2h C肽≥2.5 μg/L时,表示尚有一定的胰岛β细胞功能逆转的基础;D代表糖尿病病程,有临床证据显示,病程≤5年的T2DM患者,在干预后发生缓解的机会较高[18]。
三、诱导T2DM缓解的方法
由上述糖尿病缓解的病理生理机制角度可见,能够改善胰岛素抵抗程度、减少糖毒性的治疗策略都有不同程度地缓解糖尿病潜能。
1.强化生活方式干预
在合并肥胖的T2DM患者中,可通过减少每日热量摄入、增加运动,制造能量缺口,从而获得持续稳定的减重效果以实现糖尿病缓解。控制热量摄入方面无论采取限能量饮食(CRD)配合运动、低碳水化合物饮食(LCDs)、极低能量饮食(VLCD)、间歇性断食、生酮饮食均能促进早期T2DM的缓解。促进糖尿病缓解的运动推荐有氧运动结合阻抗运动。
糖尿病缓解临床试验研究采用短期VLCD的干预措施结合运动干预,结果显示病程6年内的肥胖T2DM患者在强化生活方式干预后,糖尿病缓解率为46%,且减重越多,糖尿病缓解率越高,当体重减轻≥15 kg时,T2DM的缓解率可达86%[6]。
Look AHEAD研究中,超重/肥胖的T2DM患者给予强化生活方式干预,包括干预组接受能量摄入1 200~1 800 kcal/d的营养代餐,且每周至少进行175 分钟中等强度的体力活动,对照组为常规教育和治疗。其中关于4 503例BMI≥25 kg/m2患者的4年研究结果显示,强化生活方式干预组第1年和第4年时实现糖尿病缓解的比例均高于常规糖尿病教育治疗组(分别为11.5%比2.0%和7.3%比2.0%)。亚组分析显示,体重减轻10%以上的患者心血管事件亦明显下降[7]。
前瞻性队列研究试验结果显示,诊断T2DM后的第1年中,即使无密集的生活方式干预或极端的能量限制,减重≥10%的患者获得T2DM缓解机会较体重不变的患者增加约1倍,若在诊断的最初5年中仍能保持该减重程度,T2DM缓解的几率将更高,再次证实控制体重的重要性[19]。
因此ADA指南推荐,超重/肥胖的T2DM患者应通过生活方式干预减重≥5%,更多的减重可获得更好的代谢控制,提高糖尿病缓解的机会[12]。
2.药物干预
(1)减重药物:ADA指南中肥胖管理相关章节明确指出,减重干预3个月无法获得5%的体重减少疗效者,需要调整干预措施,生活方式干预失败,则应考虑药物与手术治疗。ADA指南中推荐的减重药物包括芬特明、奥利司他及托吡酯等,其中除奥利司他外,我国均未获批上市。美国食品药品监督管理局(FDA)批准胰高糖素样肽-1受体激动剂(GLP-1RA)类药物利拉鲁肽和司美格鲁肽的减重适应症,尽管两者目前在我国未批准减重适应症,但已获批降糖适应症而广泛应用。本文仅介绍我国获批药物的证据,其中GLP-1RA证据在降糖药物中介绍。
奥利司他于2007年被我国药品监督管理局批准为减重非处方药,建议用于BMI≥27 kg/m2的T2DM患者。XENDOS试验中纳入肥胖的糖尿病前期患者随访1.5年,与安慰剂组相比,接受奥利司他治疗组糖尿病发生风险降低37%,提示奥利司他有预防糖尿病的作用[20]。在Look AHEAD研究中,奥利司他被推荐为与强化生活方式干预联合促进体重改善/维持的减重药物,减重效果肯定[7]。奥利司他的主要不良反应为脂肪泻及脂溶性维生素的缺乏,使用时应注意补充相应维生素。
(2)非胰岛素类降糖药物:ADA指南指出,超重/肥胖的T2DM患者选择治疗药物时应考虑药物对体重的影响。GLP-1RA和钠-葡萄糖协同转运蛋白2抑制剂(SGLT2i)是有一定减重效应的降糖药物,联合使用二甲双胍、GLP-1RA和SGLT2i的方案,较其它联合治疗方案的减重效果更佳。
已有研究证实GLP-1RA及其联合方案可有效降低体重。基于安慰剂对照的Meta分析显示,艾塞那肽、利拉鲁肽、利司那肽、司美格鲁肽周制剂均能使肥胖T2DM患者实现不同程度的体重下降[21]。Sustain China研究显示,在超重/肥胖的中国T2DM患者中应用司美格鲁肽1.0 mg/周可使HbA1c降低1.8%,体重下降4.2 kg,因此可作为改善体重的辅助方法[22]。GLP-1RA联合二甲双胍和SGLT2i相较其他降糖药物的联合治疗,体重减轻最多,低血糖发生数次最少,心脑血管疾病和全因死亡发生率最低,有利于糖尿病缓解,显示出较好的应用前景[23]。
(3)短期胰岛素:翁建平教授研究显示,对于严重高糖状态的新诊断糖尿病患者(HbA1c≥10%,FPG≥11.1 mmol/L),短期(2周)胰岛素强化治疗有助于T2DM实现缓解[5]。此后多项相关研究发表,对7项类似研究进行Meta分析显示,短期胰岛素强化治疗可改善新诊断T2DM患者的胰岛β细胞功能和胰岛素抵抗,66.2%的患者糖尿病缓解。目前尚未见在超重/肥胖的T2DM患者中应用强化生活方式干预与短期胰岛素强化治疗以缓解T2DM疗效的比较研究,但有研究显示缓解的糖尿病患者基线BMI较未缓解患者高[24]。因此,对于超重/肥胖T2DM患者,如在诊断初期存在严重高血糖,即HbA1c≥10%、FPG≥11.1 mmol/L,并伴有明显高血糖症状或出现酮症酸中毒,推荐短期给予胰岛素治疗。
3.代谢手术
ADA指南推荐,对于BMI≥35 kg/m2的T2DM患者(亚裔≥32.5 kg/m2),如非手术治疗措施不能显著改善体重和代谢紊乱,可考虑采用代谢手术以缓解T2DM。
代谢手术方法包括多种,目前最常用的包括袖状胃切除(LSG)及腔镜Rouxen-Y胃旁路术(LRYGB)。相比生活方式干预,联合药物治疗减重不理想的T2DM合并肥胖患者,手术干预结合药物治疗的患者能够在3年内实现HbA1c≤6%。其中行LRYGB的患者HbA1c缓解率可达38%,行LSG的患者缓解率可达24%,而单纯药物疗法缓解率仅为5%[9]。对代谢手术的长期影响进行观察,发现手术后T2DM的缓解率为72.3%,15年后仍有30.4%,而对照组缓解率为16.4%和6.5%,这提示代谢手术与常规治疗相比,糖尿病缓解率更高[25]。长期随访发现,减重手术对糖尿病并发症和患者的心脑血管疾病也有一定的预防作用。瑞典肥胖受试者研究(SOS)经过平均19年的随访,发现通过代谢手术带来的体重减轻可使糖尿病微血管并发症发生风险明显下降[26]。
基于此,ADA指南给出最为积极的基于BMI分层的超重/肥胖T2DM患者的减重推荐为:非亚裔人群BMI≥30.0 kg/m2或亚裔人群BMI≥27.5 kg/m2,如其他治疗无法达到减重5%的目标,则可考虑采用减重手术治疗。推荐减重手术治疗最佳年龄为16~65岁、BMI≥37 kg/m2的患者。由于肥胖患者手术并发症风险高,推荐术前采用生活方式干预与药物联合治疗达到10%的减重目标后再手术治疗,以提高手术安全性。见表1。
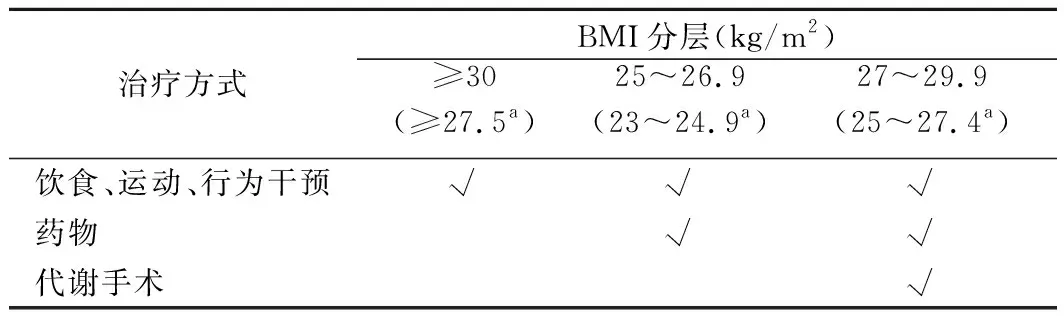
表1 超重/肥胖T2DM患者减重治疗方式的选择
四、结语
联合使用生活方式干预、药物及手术等多种治疗策略,可使相当一部分病程短的T2DM患者获得缓解,一段时间内无需使用降糖药物。该策略不仅能提升患者健康生活方式的依从性,更能有效减轻患者心理负担、提升生活质量。糖尿病缓解状态的持续维持可延缓疾病进展,降低慢性并发症发生风险,终生获益。当然,《糖尿病缓解专家共识》仍有诸多亟待解决的问题:(1)以不同HbA1c切点(6.5%和6.0%)定义糖尿病缓解,对于T2DM复发风险和远期心脑血管疾病发生风险的预测价值;(2)不同治疗策略获得的糖尿病缓解持续的时间是否存在差异;(3)糖尿病缓解期除糖代谢外,脂肪、肝脏等其他组织器官代谢的变化特点仍需研究;(4)促进糖尿病缓解状态长期维持的精细化管理策略尚待探索。

