指纹图谱结合化学模式识别及TOPSIS分析的凉粉草质量控制研究
谢平,陈秋桦,许鑫鑫,沈金海,郝春莉,林丽丽,陈良华
1.厦门华厦学院环境与公共健康学院,福建 厦门 361024;2.生化制药福建省高校工程研究中心,福建 厦门 361024;3.厦门市食品药品安全重点实验室,福建 厦门 361024;4.福建省亚热带植物研究所,福建 厦门 361006
凉粉草为唇形科凉粉草属多年生草本植物凉粉草Benth.的干燥全草。药理研究表明,凉粉草具有抗心脑血管疾病、抗衰老、抗氧化、降血糖、降血压及保肝等多种功效。凉粉草已收载于《广东省中药材标准(第三册)》、《广西壮族自治区壮药质量标准 第二卷(2011年版)》及《上海市中药饮片炮制规范》等,尚缺乏完善的质量控制标准,随着研究不断深入及药材需求量不断提高,建立全面的药材质量分析和控制方法尤为重要。
单一成分无法全面评价中药材的整体质量,而指纹图谱可以全面反映中药材成分的数量及种类;化学模式识别可以对指纹图谱进行数据降维、识别和分类,强调其差异性,用于筛选质量差异标志物;TOPSIS(逼近理想解排序法)对评价对象与最优项的接近程度进行综合排序,可用于药材的质量综合评价。本研究建立15批不同来源凉粉草的指纹图谱,结合聚类分析、主成分分析和正交偏最小二乘判别分析(OPLS-DA)等化学模式识别方法,评价不同来源凉粉草的稳定性和一致性,筛选质量差异标志物,对其进行含量测定,构建TOPSIS模型,进行综合评价分析,实现对凉粉草药材的质量控制。
1 仪器与试药
LC-20A高效液相色谱仪、SPD-M20A PDA检测器、LCsolution色谱工作站,日本岛津公司;XS205十万分之一电子天平,梅特勒-托利多仪器上海有限公司;CT15RT型台式高速冷冻离心机,上海安亭科学仪器厂;BSA224S万分之一电子天平,赛多利斯上海有限公司;HH-2型恒温水浴锅,江苏常州华普达有限公司;KQ-500E型超声波清洗器,昆山市超声仪器有限公司;FW-80型中草药粉碎机,天津泰斯特仪器有限公司。
异槲皮苷对照品(批号RP200202,纯度≥98%)、迷迭香酸对照品(批号RP180607,纯度≥98%),成都麦德生科技有限公司;紫云英苷对照品(批号D20021105,纯度≥98%)、咖啡酸对照品(批号D18121724,纯度≥98%)、紫草酸对照品(批号D19041017,纯度≥98%)、丹酚酸B对照品(批号D19110407,纯度≥98%),南京狄尔格医药科技有限公司;甲醇、乙腈均为色谱纯,水为超纯水,其余试剂均为分析纯。15批凉粉草样品,经厦门华厦学院环境与公共健康学院赖源发副教授鉴定为唇形科植物凉粉草Benth.的干燥全草,来源信息见表1。
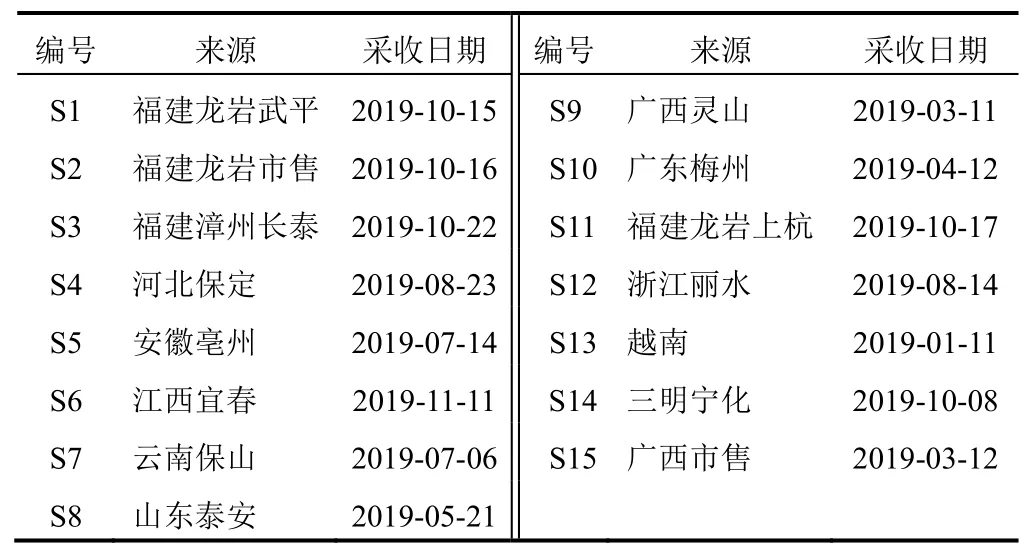
表1 15批凉粉草样品来源信息
2 方法与结果
2.1 混合对照品溶液制备
精密称定对照品适量,加入甲醇制成浓度分别为咖啡酸0.086 mg/mL、异槲皮苷0.115 mg/mL、紫云英苷0.167 mg/mL、迷迭香酸0.187 mg/mL、紫草酸0.089 mg/mL、丹酚酸B 0.093 mg/mL的混合对照品溶液,置4 ℃冰箱冷藏备用。
2.2 供试品溶液制备
精密称取凉粉草样品粉末(过3号筛)约1.0 g,置索氏提取器中,加石油醚(60~90 ℃)100 mL,加热回流至近无色,弃去石油醚,挥干,加入60%乙醇30 mL回流提取2 h,浓缩至浸膏,20%乙腈复溶,定量转移至25 mL量瓶中,稀释至刻度,摇匀,用0.45 μm滤膜过滤,取续滤液,即得。
2.3 色谱条件
采用中谱红RD-C18色谱柱(4.6 mm×250 mm,5 μm),流动相为乙腈(A)-0.1%甲酸水溶液(B),梯度洗脱(0~9.5 min,18%A;9.5~18.5 min,18%→19%A;18.5~20 min,19%→20%A;20~25 min,20%→22%A;25~35 min,22%→24%A;35~42 min,24%→30%A;42~50 min,30%→18%A),流速1.0 mL/min,检测波长320 nm,柱温25 ℃,进样量10 μL。
2.4 方法学考察
2.4.1 精密度试验
取凉粉草样品(S1),按“2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件连续进样6次,以7号峰的保留时间和峰面积为参照,计算共有色谱峰的相对保留时间(RRT)和峰面积比值(PAR),结果各共有峰RRT的RSD均小于0.5%,PAR的RSD均小于3.0%,表明仪器精密度良好。
2.4.2 重复性试验
取凉粉草样品(S1)6份,按“2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件进样测定,计算各共有峰RRT的RSD均小于0.5%,PAR的RSD均小于3.0%,表明该方法重复性良好。
2.4.3 稳定性试验
取同一批(S1)凉粉草样品,按“2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件,于0、2、4、6、8、12 h进样测定,记录色谱峰,结果各共有峰RRT的RSD均小于1.5%,PAR的RSD均小于3.0%,表明供试品溶液在12 h内稳定性良好。
2.4.4 指纹图谱建立及相似度评价
取15批凉粉草样品适量,按“2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件进样测定,记录色谱图,导入国家药典委员会《中药色谱指纹图谱相似度评价软件》(2012版),设置时间窗宽度为0.1 min,采用中位数法生成指纹图谱共有模式,选取S1作为参照,进行多点校正,建立凉粉草药材指纹图谱。15批样品共确定14个共有峰,指认出其中6种成分,分别为咖啡酸(2号峰)、异槲皮苷(5号峰)、紫云英苷(7号峰)、迷迭香酸(9号峰)、紫草酸(10号峰)、丹酚酸B(12号峰),见图1。经前期试验确认,凉粉草药材中迷迭香酸含量较高,分离度较好,出峰时间稳定,故以其作为参照峰,计算其他峰的RRT和PAR。15批不同来源凉粉草的相似度为0.718~0.998,除S8样品外,其他凉粉草样品的相似度均大于0.900,表明样品整体差异较小。见表2。
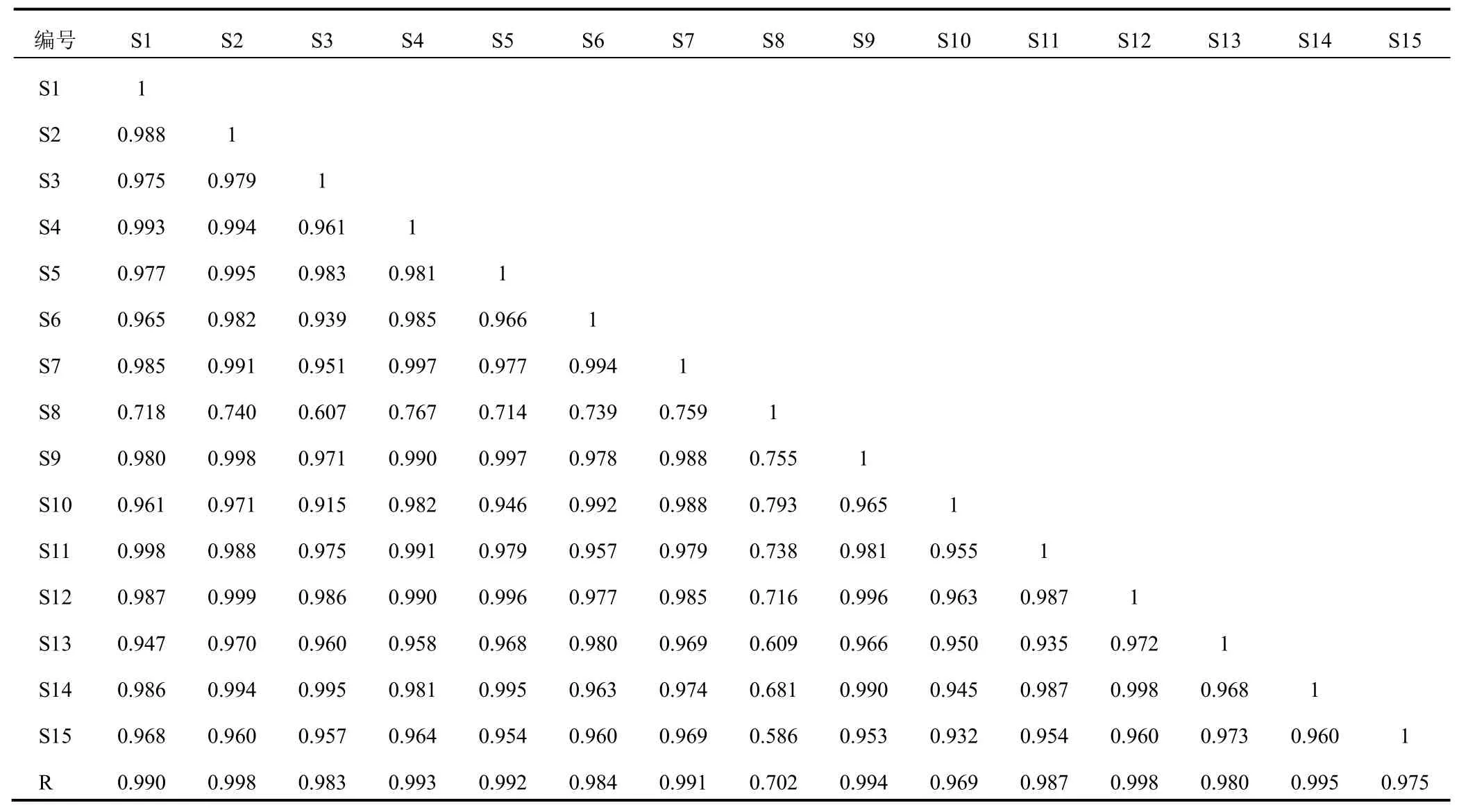
表2 15批凉粉草指纹图谱相似度评价结果

图1 15批凉粉草HPLC指纹图谱及色谱峰指认
2.5 聚类分析
采用SPSS22.0软件将14个共有峰峰面积标准化后进行聚类分析(组间联接法结合平方欧式距离),结果见图2。当分类距离为10时,可分为3类:S3、S15样品各为一类,其他样品为一类;当分类距离为5时,15批样品可聚为5类。
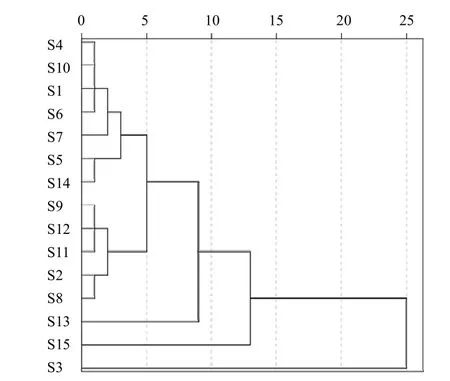
图2 15批凉粉草样品聚类分析树状图
2.6 主成分分析
以14个共有峰的峰面积为变量,采用SPSS22.0软件进行主成分分析。4个主成分特征值>1,坡度较陡,累计方差贡献率为83.165%,可反映指纹图谱的主要信息。主成分1贡献率为29.981%,色谱峰3、8、9、10、11、13具有较高载荷值;主成分2贡献率为22.538%,色谱峰2、5、6具有较高载荷值;主成分3贡献率为17.385%,色谱峰1、7、12、14具有较高载荷值;主成分4贡献率为13.261%,色谱峰7、11具有较高载荷值。表明多种成分共同引起凉粉草的质量差异。见表3、表4、图3。
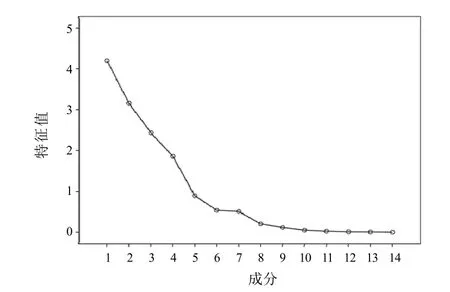
图3 凉粉草样品主成分分析碎石图
根据表3、表4计算得到4个主成分的特征向量,综合评分模型F=0.299 81F+0.225 38F+0.173 85F+0.132 61F,其中,系数为各主成分的方差贡献率,F、F、F、F为4个主成分的得分(见表5)。
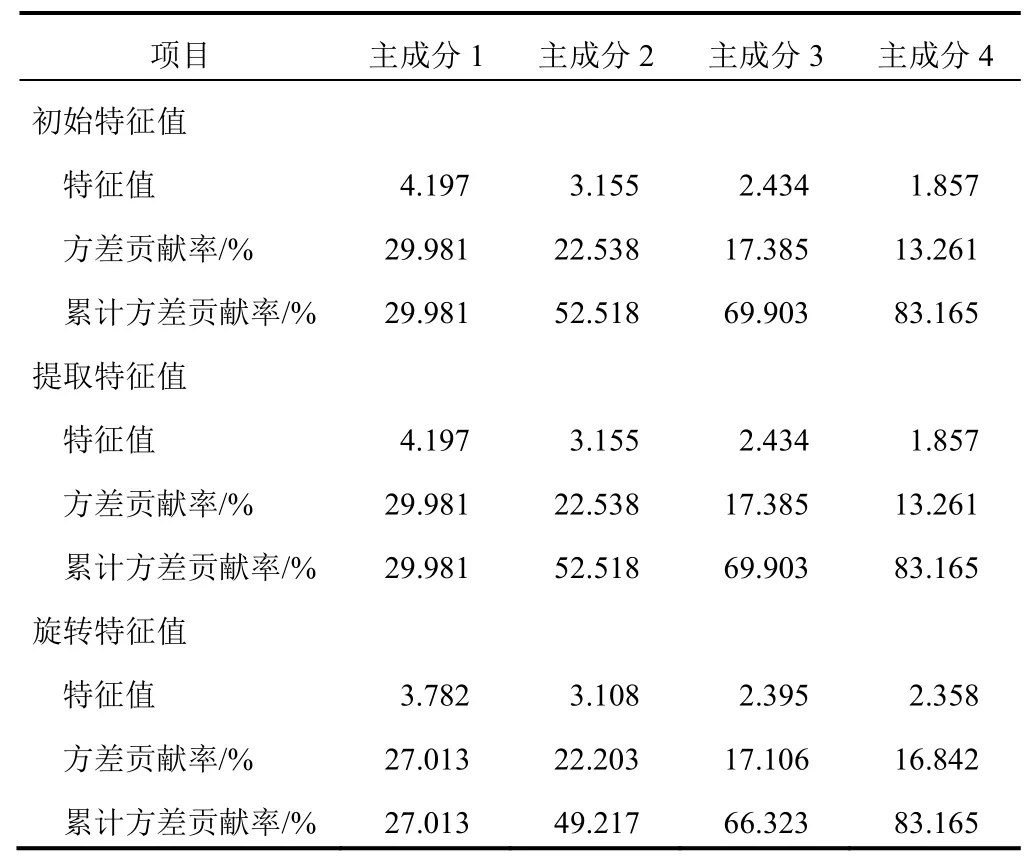
表3 凉粉草样品主成分特征值及方差贡献率
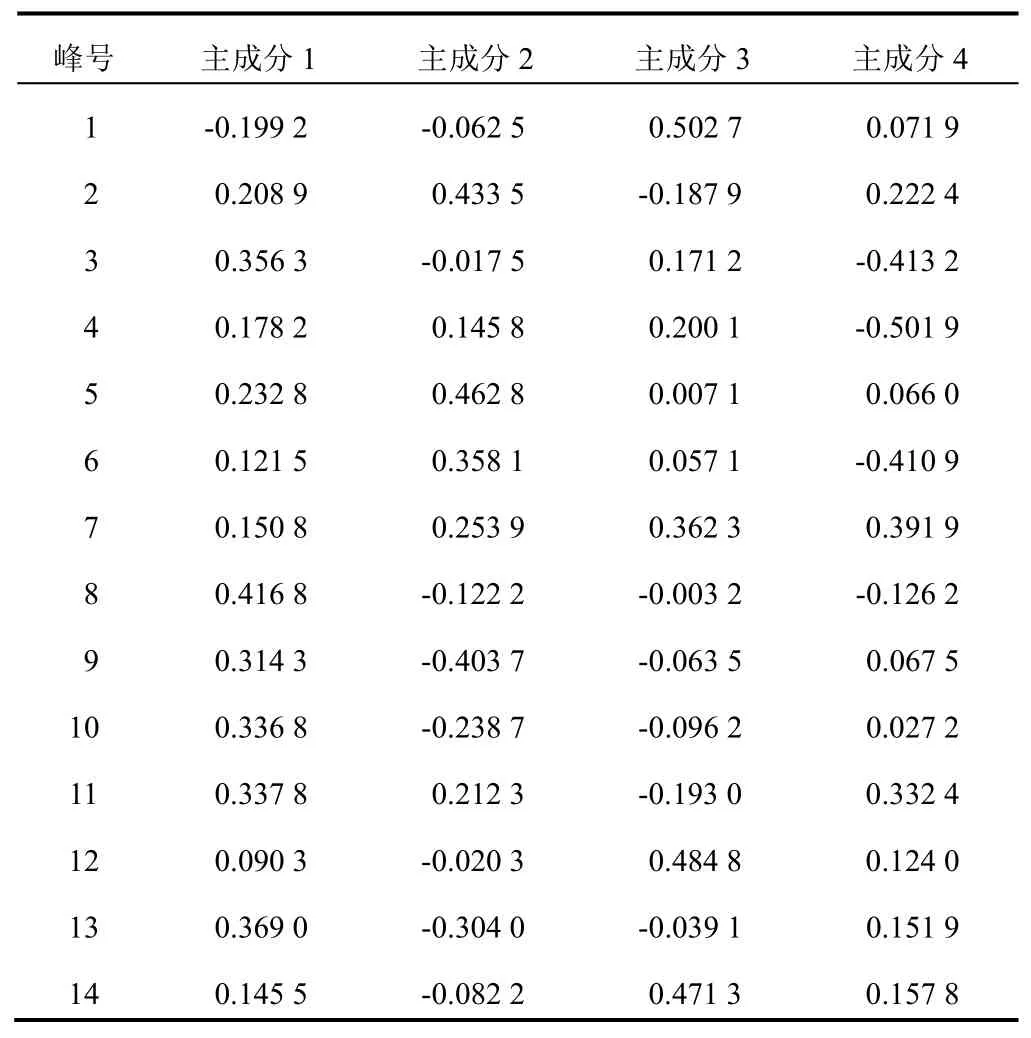
表4 凉粉草样品特征图谱共有峰旋转后因子载荷矩阵
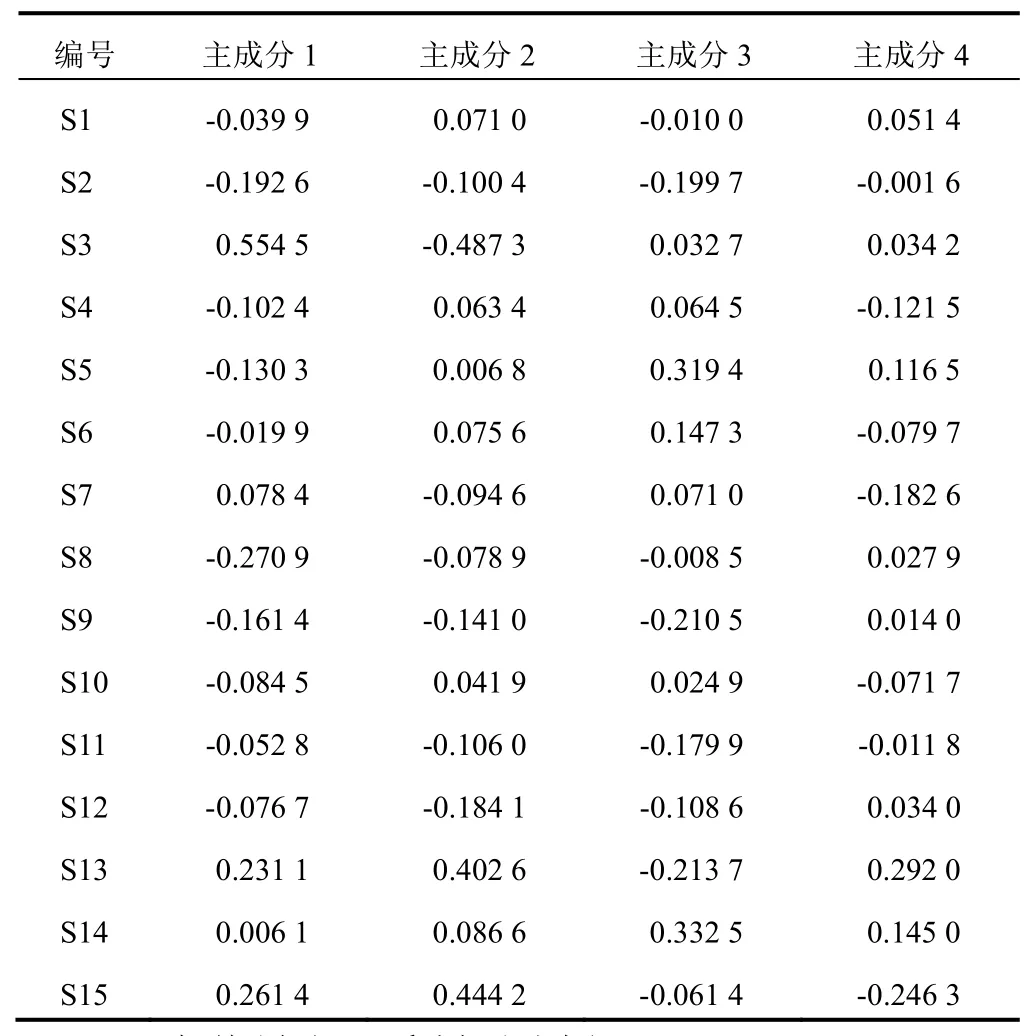
表5 15批凉粉草样品主成分得分
2.7 正交偏最小二乘判别分析
以15批凉粉草样品为研究对象,以指纹图谱14个共有峰的相对峰面积作为变量,导入SIMCA14.1软件,OPLS-DA得分图见图4。可以看出,S4、S10、S1、S6、S7、S5、S14为第1类,S9、S12、S11、S2、S8为第2类,其余为第3类,与聚类分析结果一致。以变量重要性投影(VIP)>1为标准,筛选引起质量差异的标志性成分,共有峰VIP见图5。结果表明,VIP值由大到小依次为色谱峰11、5、1、2、12、7、3,其中5、2、12、7号峰分别为异槲皮苷、咖啡酸、丹酚酸B、紫云英苷,其他成分有待鉴别。
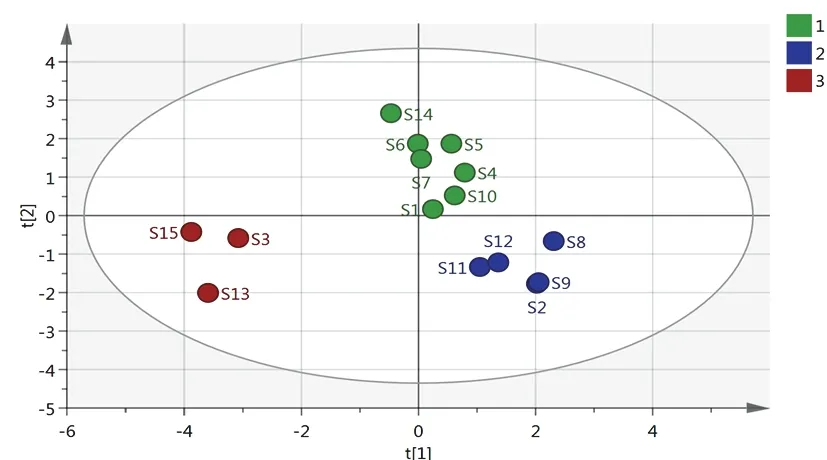
图4 15批凉粉草样品OPLS-DA得分
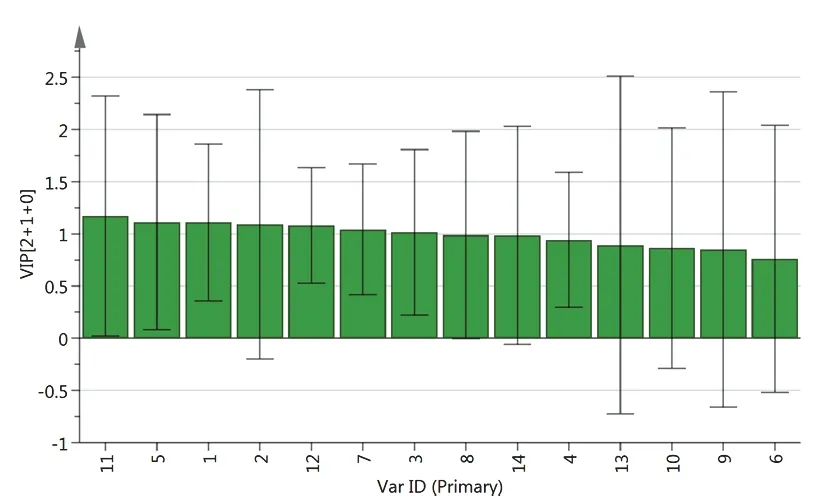
图5 凉粉草样品指纹图谱共有峰VIP
2.8 咖啡酸、异槲皮苷、紫云英苷、丹酚酸B含量测定
2.8.1 系统适用性试验
按“2.3”项下色谱条件,精密吸取混合对照品溶液、供试品溶液各10 μL进样,结果表明,各色谱峰分离度良好,样品测定无干扰。
2.8.2 线性关系考察
精密吸取“2.1”项下混合对照品溶液0.5、1.0、2.0、3.0、4.0、5.0、10.0 mL,置10 mL量瓶中,稀释至刻度,摇匀,分别精密吸取10 μL,进样测定,以对照品浓度(μg/mL)为横坐标,峰面积为纵坐标,进行线性回归,绘制标准曲线,见表6。

表6 凉粉草中4种成分线性关系考察结果
2.8.3 精密度试验
取混合对照品溶液,按“2.3”项下色谱条件连续进样测定6次,记录峰面积,计算RSD,结果咖啡酸、异槲皮苷、紫云英苷、丹酚酸B峰面积的RSD分别为1.82%、0.10%、0.92%、1.28%,表明仪器精密度良好。
2.8.4 重复性试验
分别称取同一批(S1)凉粉草样品,按“2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件测定,结果咖啡酸、异槲皮苷、紫云英苷、丹酚酸B的平均含量分别为0.151 3、0.514 1、0.566 8、0.742 1 mg/g,RSD分别为0.72%、1.15%、1.06%、0.74%,表明该方法重复性良好。
2.8.5 稳定性试验
取供试品溶液,室温放置0、2、4、6、8、12 h,按“2.3”项下色谱条件测定,记录峰面积,结果咖啡酸、异槲皮苷、紫云英苷、丹酚酸B峰面积的RSD分别为0.86%、2.03%、0.39%、2.42%,表明供试品溶液在12 h内稳定性良好。
2.8.6 加样回收率试验
精密称取已知含量的凉粉草样品粉末(过3号筛)0.5 g,平行6份,分别加入约与样品中待测成分含量相等的对照品,按“2.2”项下方法制备,按“2.3”项下色谱条件测定,计算咖啡酸、异槲皮苷、紫云英苷、丹酚酸B的加样回收率及RSD,结果表明该方法准确性良好,见表7。
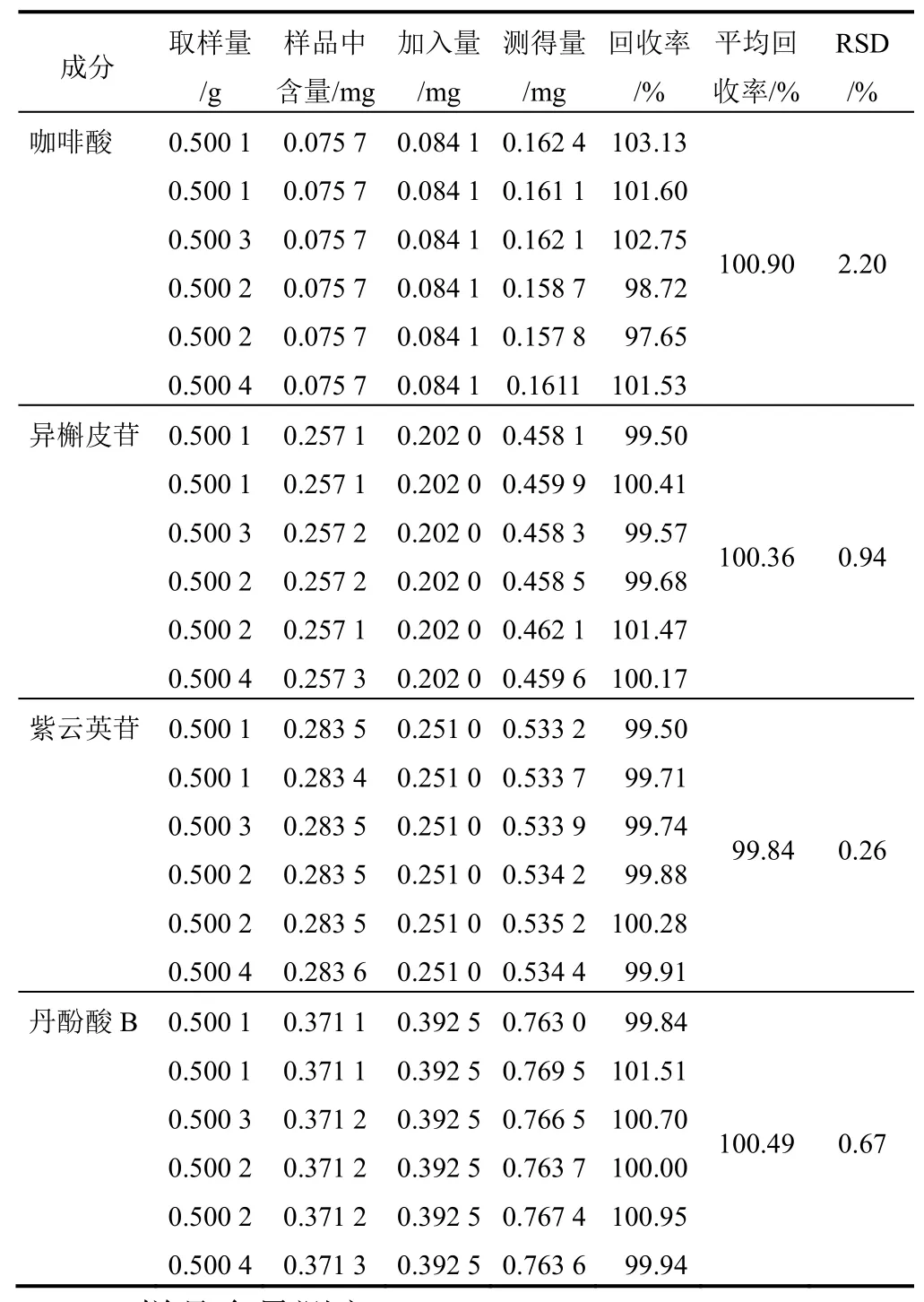
表7 凉粉草中4种成分加样回收率试验结果
2.8.7 样品含量测定
取15批凉粉草样品粉末(过3号筛),按“2.2”项下方法制备,按“2.3”项下色谱条件测定,每批重复测定3次,取平均值,结果见表8。15批凉粉草样品的咖啡酸、异槲皮苷、紫云英苷、丹酚酸B含量分别为0.085 2~0.298 5 mg/g、0.061 6~1.424 5 mg/g、0.079 3~1.507 2 mg/g、0.074 4~0.897 5 mg/g。
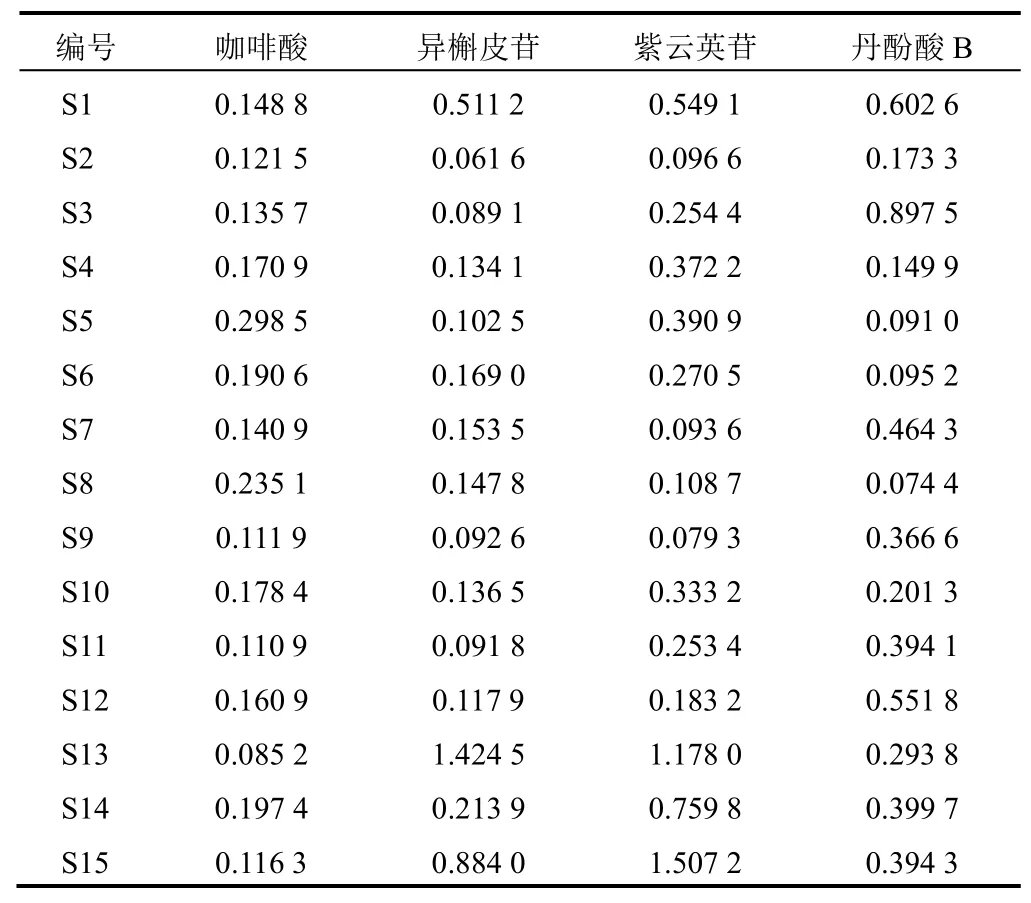
表8 15批凉粉草药材含量测定结果(mg/g,n=3)
2.9 TOPSIS分析
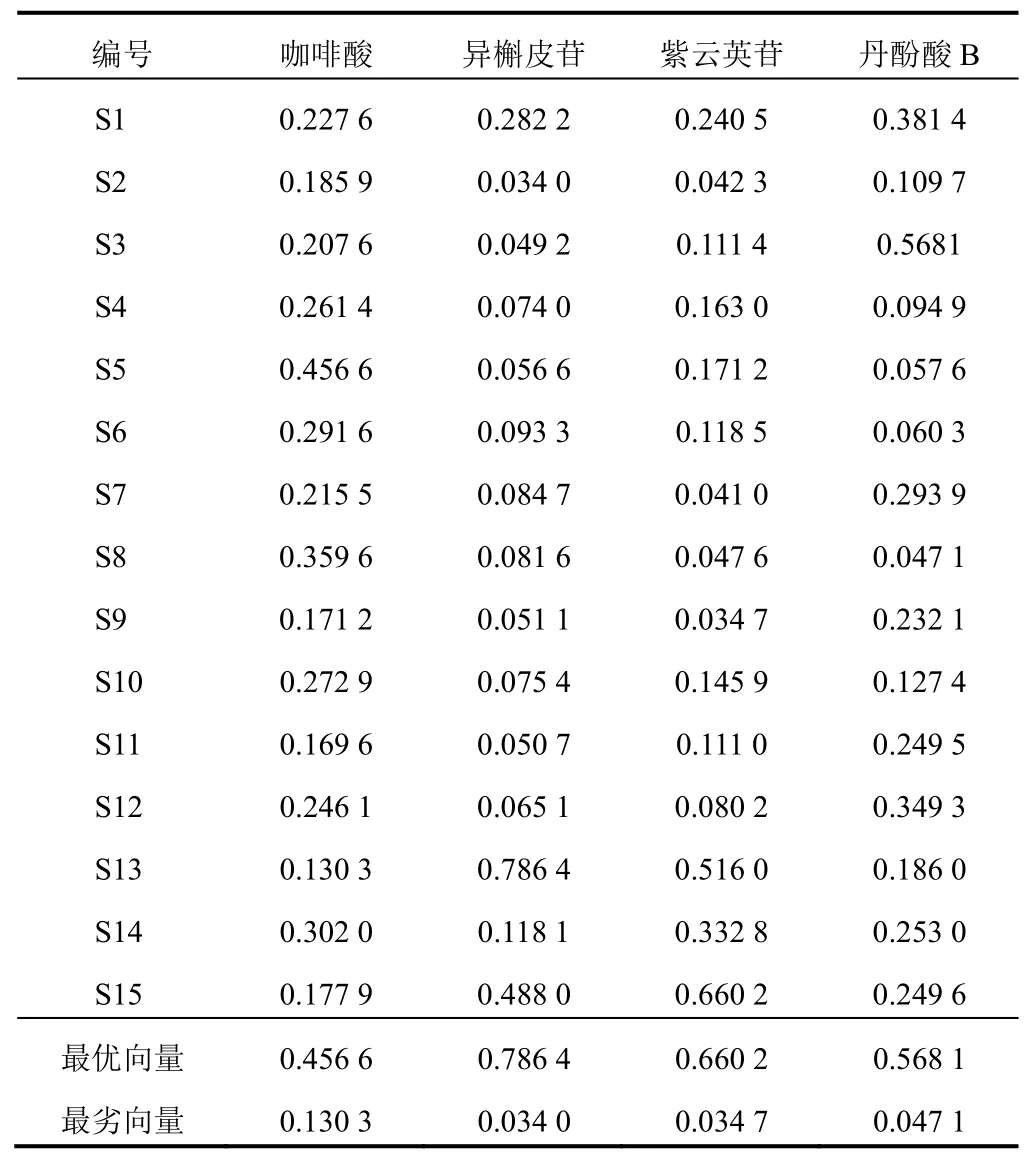
表9 15批凉粉草TOPSIS归一化处理后矩阵
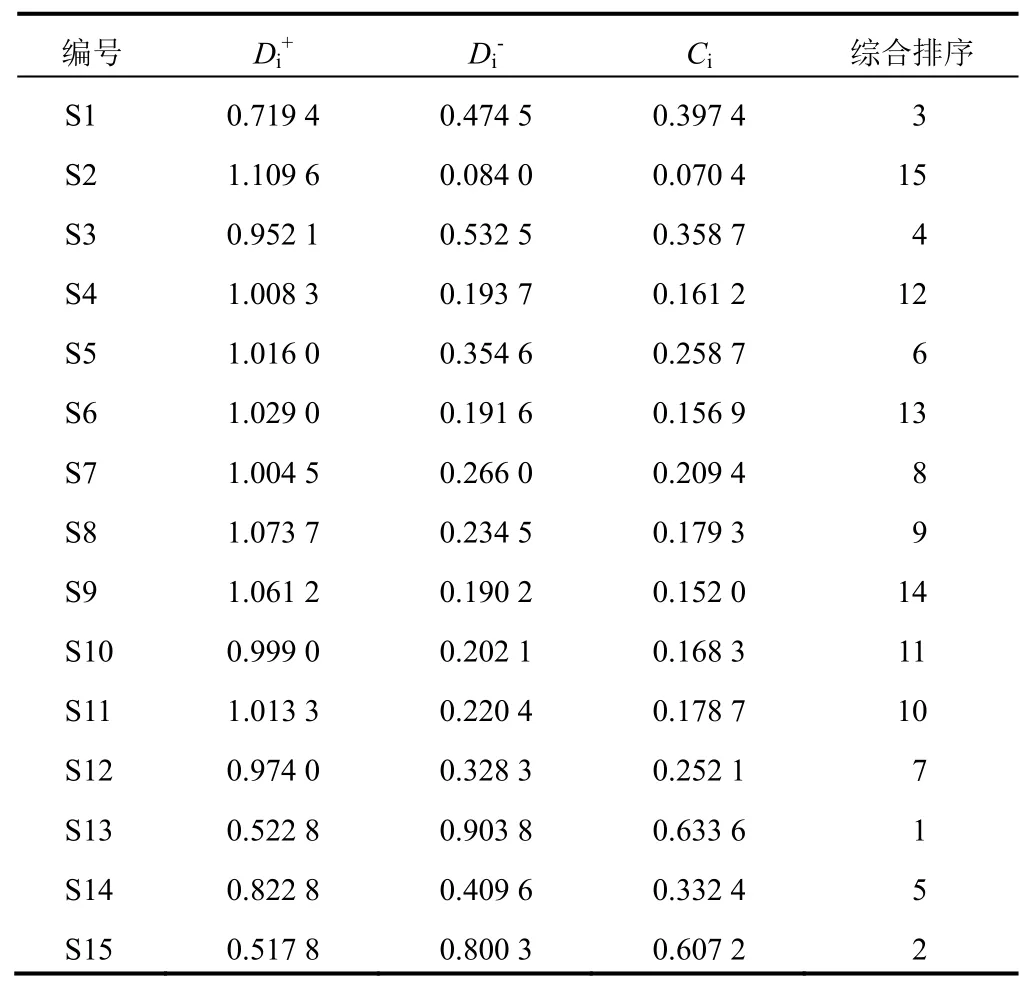
表10 15批凉粉草样品TOPSIS分析结果
3 讨论
本试验分别考察甲醇、乙腈与0.1%磷酸水、0.1%甲酸水、0.2%甲酸水组成的流动相系统。其中乙腈洗脱能力优于甲醇,分析时间较短;0.1%甲酸水溶液作为水相可有效改善峰形,系统能达到较好的分离,且基线平稳。因此,选择乙腈-0.1%甲酸水溶液作为流动相系统。比较检测波长为280、320、330、360 nm时各色谱峰的出峰情况,在波长320 nm处所得共有峰多,各峰分离度较好、响应较强且基线较平稳。
15批凉粉草药材指纹图谱共确定了14个共有峰,并指认出6种成分。不同提取方式对药材成分的溶出有一定影响,经比较水提、醇提的指纹图谱峰,水提成分较少、含量较低、分离度较差,故采用乙醇回流方法提取。15批凉粉草样品的相似度为0.718~0.998,原因可能为种植模式、气候条件、地理环境及市售混合等对次生代谢成分的积累不同。
凉粉草主要生长在福建、广东,野生资源相对较多,导致其品质存在一定差异,进而可能影响药效及使用。本研究采用HPLC建立凉粉草药材的指纹图谱,并进行聚类分析、主成分分析、OPLS-DA。确定了14个共有峰,共有峰的相对保留时间差异较小,但相对峰面积差异较大,表明化学成分相同但其含量差异较大;由聚类分析结果可知,除S3、S15外均聚为一类,S3、S15样品为市售,可能与其系多个产地的混合样品有关;气候环境、提取工艺同样对药材及其制剂的内在品质产生影响。主成分分析共提取出4个主成分,可反映15批样品83.17%的信息。结合OPLS-DA,异槲皮苷、咖啡酸、丹酚酸B、紫云英苷为凉粉草药材质量差异的主要标志性成分。15批不同来源凉粉草药材含量测定结果显示,S13(越南)样品中除咖啡酸外,其他成分含量均较高,可能与其生长地理位置、土壤、水源、光照等因素有关,有待进一步研究。异槲皮苷具有保护心脑血管、降压、降脂、抗抑郁等生物活性,咖啡酸是抗炎抑菌、调节代谢等生物活性的物质基础,丹酚酸B为治疗冠心病、心绞痛的主要药效物质,紫云英苷能保护心脏、神经系统、抗溃疡、抗纤维化,可作为质量控制的指标成分。本研究通过建立HPLC指纹图谱和含量测定方法,结合化学模式识别及TOPSIS分析,可为评价凉粉草药材质量提供依据。

