食管癌移植瘤小鼠模型建立
耿园园 贾祥磊 刘玉珍 齐博 秦秀广 刘尚国 赵宝生
(新乡医学院 1食管癌研究所,河南 卫辉 453100;2第一附属医院胸外科;3生命科学研究中心)
目前食管癌(EC)研究模型主要集中于细胞系构建的裸鼠模型,但该动物实验模型缺乏肿瘤异质性,不能较为真实地反映不同病人的情况〔1,2〕。而近几十年发展起来的患者来源的移植瘤(PDX)模型可有效地解决这一弊端,构建较为理想的动物实验模型〔3,4〕,为新药研发和临床个性化治疗提供了一种新的治疗策略。但是目前PDX模型多选用超重度免疫缺陷(NOG)小鼠〔5,6〕,该类小鼠易感染病菌死亡,另外价格较高。本研究旨在将PDX模型负载小鼠由NOG小鼠转移到免疫缺陷程度较低的BALB/c Nude裸鼠上,降低PDX模型成本。
1 材料与方法
1.1病人和组织样本 本研究已经获得新乡医学院第一附属医院医学伦理委员会的批准,依据赫尔辛基宣言,在手术前,与患者协商一致,患者或家属签署了知情同意书。所有组织样本由医院病理科确诊为EC。
1.2方法
1.2.1样本的收集与处理 收集13例EC患者手术切除的EC组织。提前在手术室等候,当医生手术切下EC组织后,迅速用适量的营养液(80% RPMI1640培养基+10%双抗+10 μg/ml两性霉素B)储存,置于冰盒中,迅速带到实验室中。在无菌操作台中,再用冷洗液〔90%磷酸盐缓冲液(PBS)+10%双抗+10 μg/ml两性霉素B〕清洗组织3次,并把肿瘤组织切成大小为1 mm×1 mm×1 mm的小块。以上所有操作在冰上进行。
1.2.2PDX小鼠模型的建立 异氟烷麻醉NOG小鼠,待小鼠麻醉后,将上述切成小块的EC组织用无菌镊子和剪刀接种至小鼠背后皮下。再用无菌的缝合针和缝合线缝合小鼠创口,用碘伏消毒缝合好的创口。用游标卡尺测量肿瘤大小,计算肿瘤体积(体积=1/2×长径×短径2),每周测2次。当肿瘤体积达到750 mm3或以上时,处死小鼠。将肿瘤组织分为3份,1份用4%的中性甲醛固定,1份用于下一代PDX模型小鼠皮下接种,另1份液氮冻存。
1.2.3苏木素-伊红(HE)染色 组织样本均用4%中性甲醛固定24 h以上,常规石蜡包埋,3 μm连续切片;脱蜡处理:二甲苯(Ⅰ)10 min,二甲苯(Ⅱ)10 min;复水:100%乙醇3 min,95%乙醇3 min,80%乙醇3 min,60%乙醇3 min,自来水浸泡5 min;HE染色:苏木素染色2 min,伊红10 s。HE染色片子由两位独立的病理科医生判断标本。
1.2.4PDX样本库建立 将解剖下来的小鼠肿瘤组织用无菌冷洗液(90% PBS+10%双抗+10 μg/ml两性霉素B)清洗组织3次,去除坏死部分。再把组织剪成体积5 mm×2 mm×2 mm的小块,放入含有1.5 ml冻存液〔60% RPMI1640培养基+30%胎牛血清(FBS)+10%二甲基亚砜(DMSO)〕的冻存管中。置于-80℃冰箱中,利用冻存盒进行梯度降温,24~48 h后,转入液氮中长期保存待用。
1.3统计学方法 采用SPSS15.0软件进行t检验、LSD-t检验。
2 结 果
2.1PDX模型的建立及患者临床特点 P1代NOG小鼠成瘤5例(38.5%),未成瘤8例(61.5%),P1代成瘤的5例继续接种至P2代,P2代NOG小鼠成瘤4例(80.0%),未成瘤1例(20.0%),P3代以后成瘤率为100.0%。在接种P3代NOG小鼠时,同时接种在裸鼠皮下。P3代以后裸鼠全部成瘤,PDX成功率为100.0%。
表1为成瘤小鼠所对应的病人病理信息,可以看出食管鳞状细胞癌病人的分化程度越高,PDX模型小鼠越容易成瘤。

表1 PDX成瘤模型病人相关信息
2.2PDX小鼠模型和EC病人肿瘤组织HE比较 图1食管鳞状细胞癌(EC5、EC8和EC9)和小细胞EC(EC7)的P1和P2代,与相对应的病人组织P0代相比,切片HE染色组织结构类似。

图1 EC患者肿瘤组织 HE 染色(×400)
2.3各代成瘤时间比较 P1和P2成瘤时间(61.00 d vs 51.75 d,P=0.675)、P2和P3成瘤时间(41.67 d,P=0.416)、P3和P4成瘤时间(46.67 d,P=0.770)比较不具有统计学差异,各组间成瘤时间并未随着代数增加而缩短。
2.4NOG小鼠和裸鼠荷瘤情况比较 图2左侧为NOG小鼠和裸鼠在体荷瘤情况,发现NOG小鼠较裸鼠荷瘤更规则、紧实。图2右侧自左至右依次是EC5、EC7、EC8和EC9小鼠处死后剥离的肿瘤,其中EC5、EC8和EC9小鼠是食管鳞状细胞癌患者来源,EC7为小细胞EC来源。通过比较发现小细胞EC来源的EC7肿瘤较食管鳞状细胞癌血供更丰富。这可能是小细胞EC病人发病迅速,术后生存期短的重要原因。
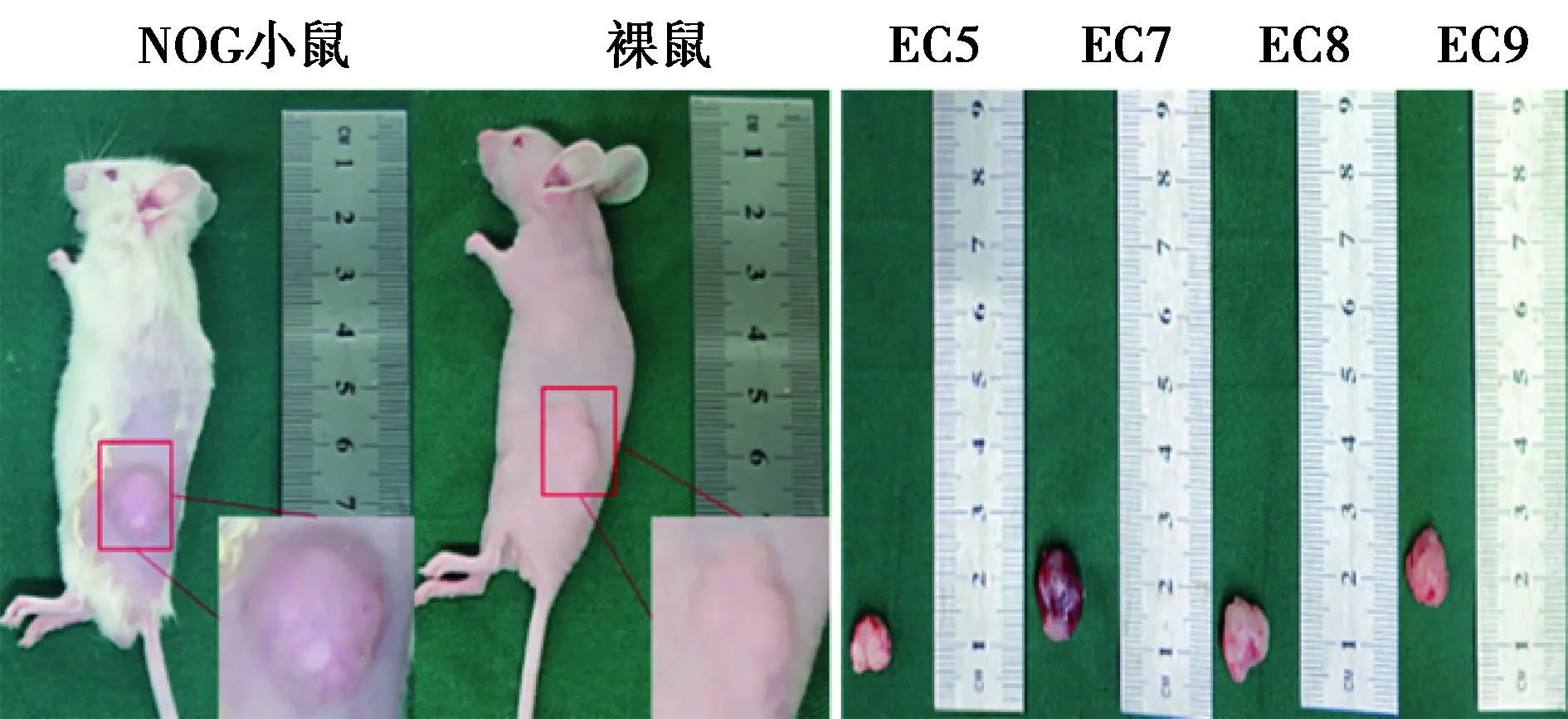
图2 PDX小鼠模型荷瘤情况
3 讨 论
肿瘤组织是由肿瘤细胞、成纤维细胞、间质细胞等组成〔7〕。而肿瘤细胞系成瘤缺乏异质性,难以反映出肿瘤病人的真实情况〔8,9〕。而PDX模型来源于临床病人肿瘤组织,该组织含有病人的原始的肿瘤细胞和间质细胞等。因而,PDX模型可以更真实地反映肿瘤病人情况〔10〕。
目前PDX模型小鼠一般都接种到NOG小鼠上〔11〕,但是NOG小鼠成本较高,另外也对饲养环境要求较高,易发生意外死亡现象(荷瘤小鼠饲养周期较长)。因此,本研究在P3代将P2代小鼠的肿瘤组织移植到裸鼠上,结果提示PDX模型可以先接种在NOG小鼠上,在P3代时,可以成批量接种到成本较低的裸鼠上。
与相关文献相比〔2〕,本实验里同一病人组织来源的各代荷瘤小鼠肿瘤,达到取瘤标准(肿瘤体积≥750 mm3)的时间并不具有随着接种代数增加而逐渐缩短的趋势。这可能是由于各代小鼠接种相同大小和数量的肿瘤组织,而分割的成小块肿瘤组织含有不同比例的结缔组织等非肿瘤组织。因此,这就可能使各代小鼠随机接种的肿瘤组织量不一样,从而导致成瘤时间不随着代数增加而缩短。
在荷瘤小鼠培养过程中,出现4只小鼠意外死亡,尤其是EC6在肿瘤体积(V=680 mm3)即将达到标准成瘤体积前意外死亡,导致成瘤率偏低。由于NOG小鼠缺少B细胞免疫、T细胞免疫和天然免疫〔9〕,在较长期得饲养过程中,容易滋生病菌,造成小鼠感染死亡。因此,对于NOG小鼠的饲养环境要特别注意消毒灭菌,避免因小鼠意外死亡而影响实验结果。
目前EC的治疗方式主要是手术、放化疗〔12〕。但是患者化疗极易出现耐药情况〔13〕,临床上为追求对EC病人更好的治疗效果,经常会结合物理放疗治疗,我们后续也会化疗联合放疗,对其与病人治疗效果进行一致性研究。
本文成功将PDX模型负载小鼠由NOG转移到裸鼠上,降低了PDX模型造模过程中NOG小鼠意外死亡,并降低了PDX模型实验成本。

