血浆脂蛋白相关磷脂酶A2水平与颈动脉超声斑块稳定性的相关性
李晴晴,杨 斌
0 引 言
脂蛋白相关磷脂酶A2(lipoprotein-associated phospholipase A2, Lp-PLA2)又称血小板活化因子乙酞水解酶(platelet-activating factor acetylhydrolase, PAF-AH),是磷脂酶A2超家族中的一员。其由炎性细胞分泌,能催化脂蛋白和细胞膜上甘油磷脂二位酰基脂键,使其水解成非酯化脂肪酸和溶血磷脂。有研究表明,Lp-PLA2水平的升高是动脉粥样硬化(atherosclerosis, AS)的危险因素[1-2]。Lp-PLA2可水解低密度脂蛋白(low-density lipoprotein, LDL)表面的氧化磷脂,产生多种细胞因子、黏附因子,从而促进动脉粥样硬化斑块的形成[3]。并且,Lp-PLA2可能通过AS病变内的炎症活动导致斑块的不稳定性[4]。当斑块位于颈动脉时,这种不稳定性可以进一步导致缺血性脑卒中的发生。超声作为临床上评估颈动脉粥样斑块的主要方法,常规超声、超声造影、超微血流显像和弹性成像技术等多种技术均可评估斑块的易损性[5]。本研究目的在于探讨颈动脉斑块超声稳定性与血浆Lp-PLA2水平及缺血性脑卒中发生之间的相关性。
1 资料与方法
1.1 研究对象回顾性分析2020年6月至2021年3月东部战区总医院进行颈动脉超声检查并存在颈动脉斑块的70例患者临床资料。其中,男44例、女26例,年龄37~94岁,平均(74.0±12.4)岁。排除标准:①降血脂类药物服用史;②颈部肿块等器质性病变;③严重心脑血管疾病;④患有房颤等心律失常性疾病。根据颈动脉超声的表现将患者按照颈动脉斑块的稳定性分为稳定组(n=24)和不稳定组(n=46)。
1.2研究方法
1.2.1 临床资料收集所有纳入研究的患者信息,包括患者年龄、性别、高血压、高血脂、糖尿病病史以及吸烟史,同时收集相关实验室检验及影像检查结果。
1.2.2颈动脉超声检查采用Philips EPIQ5超声诊断仪,L12-3线阵探头,频率为3~12 MHz。被检查者采取仰卧位,充分暴露并垫高颈部,使得头部后仰,检查一侧颈动脉时头部偏向检查对侧。按照中国医师协会超声分会推荐的《血管和浅表器官超声检查指南》检查方法对所有患者进行双侧颈总动脉、颈内动脉、颈外动脉、锁骨下动脉及椎动脉扫查[6]。观察并测量颈动脉内-中膜厚度(intima-media thickness, IMT),IMT值>1.0 mm为内-中膜增厚,IMT值>1.5 mm为颈动脉斑块[7]。
斑块破裂或溃疡型斑块、斑块内有大的脂质核心或斑块内出血(呈低回声或低至无回声或无回声)以及超声造影或超微血管成像显示斑块内存在新生血管。以上类型斑块为易损斑块[8]。记录斑块的超声回声、厚度、长度、纤维帽的厚薄、核心区有无坏死等特性。结合先前研究把均质性低回声斑块或以低回声为主的混合回声斑块且斑块厚度>3 mm、长度>15 mm定为不稳定性斑块[9];其他如均质性高回声斑块或者以高回声为主的混合回声斑块为稳定性斑块;此外,如斑块表面有溃疡、活动性血栓、斑块的纤维帽破裂或斑块内出现极低回声区(juxtaluminal black hypoechoic area, JBA)以及斑块内存在新生血管的均为不稳定性斑块,即易损斑块[9-10]。
1.2.3Lp-PLA2检测于颈动脉超声检查当天清晨抽取空腹血液3 mL放入促凝管内,以3000 r/min的速度离心10 min后分离上层血清液。Lp-PLA2的检测采用南京诺尔曼生物技术有限公司的NORMAN系列全自动化学发光仪及Lp-PLA2测定试剂盒进行。
2 结 果
2.1 组间一般资料比较两组研究对象的年龄、性别、高血压、高血糖发病率、吸烟史差异无统计学意义(P>0.05)。不稳定组患者的Lp-PLA2水平明显大于稳定板块组的(P<0.05);且不稳定组患者高血脂及缺血性脑卒中的发生率高于稳定组(P<0.05)。见表1。

表 1 入组患者一般临床资料比较
2.2Logistic回归分析以颈动脉斑块稳定性与否为因变量,以研究对象Lp-PLA2水平、高血脂及脑梗死发生率等因素为自变量进行二元Logistic回归分析。对这些因素进行校正后,Lp-PLA2的水平可显著影响颈动脉斑块的稳定性(P<0.01);且Lp-PLA2的水平每增加一个单位,斑块不稳定性提升3%。见表2。
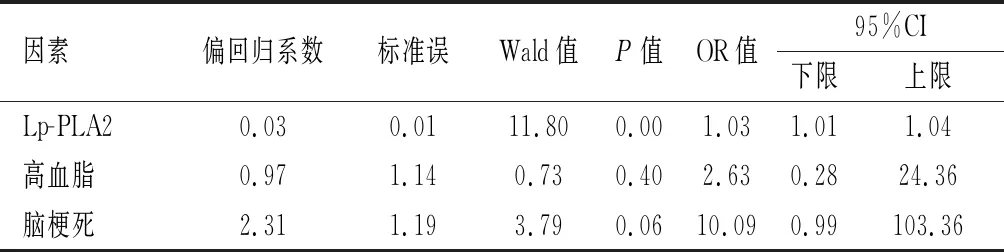
表 2 影响斑块稳定性的二元Logistic回归分析结果
2.3Lp-PLA2判断颈动脉斑块不稳定性的效能采用ROC曲线评估预测模型效果AUC为0.93(95%CI:0.85~1.00)。AUC值大于0.85,说明使用Lp-PLA2评估颈动脉斑块稳定性模型效果很好,见图1。血浆Lp-PLA2水平判断颈动脉斑块不稳定的最佳截断值为202.97 μg/mL,灵敏度为97.8%、特异度为87.5%。
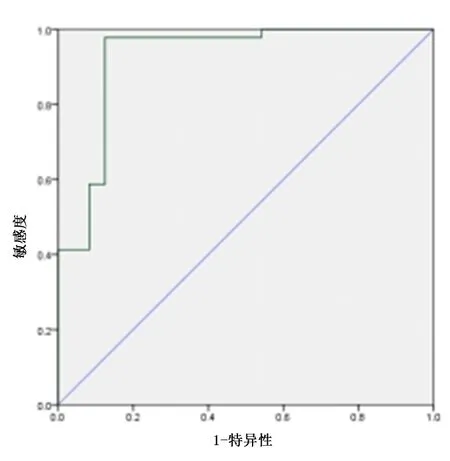
图 1 Logistic回归模型的ROC曲线图
3 讨 论
2019年全球疾病负担研究显示,我国总体卒中终生发病风险为39.9%,位居全球首位;且在过去30年中,我国卒中发病率总体呈现不断上升的趋势[11]。颈动脉粥样硬化斑块的形成及斑块的不稳定性是缺血性脑卒中发生的常见原因及危险因素[12-13]。因此,早期诊断及准确评估颈动脉粥样斑块的稳定性对预防缺血性脑卒中具有重要价值。
易损斑块是指在动脉粥样硬化的基础上,具有破裂倾向、易发生血栓形成和(或)可能迅速发展为责任病变的斑块。超声检查可以评估斑块的易损性,根据斑块内成分不同,斑块所显示出来的回声也不尽相同。Schulte-Altedorneburg等[14]将颈动脉斑块按照其在常规二维超声中的回声表现不同进行分组,并对不同组进行相关的组织学成分分析,低回声斑块内部的主要成分为脂质坏死物质、新鲜出血、血栓及胆固醇,高回声斑块内部的主要成分为纤维组织、钙化及胆固醇,混合回声斑块则包括上述两者中的成分。病理上对斑块的不稳定性评估也有其标准,包括斑块内炎细胞浸润、大片脂质坏死物覆以薄的纤维帽、血小板黏附、血管内皮侵蚀、血管内皮功能障碍、血管正性重构、裂隙样斑块、黄色斑块、斑块内出血、斑块表面钙化结节等[15]。金鑫等[16]的研究也发现常规超声中低回声及混合回声斑块较强回声斑块更加不稳定,而且超声检查结果与病理结果对照呈正相关。这也是本研究得以进行的病理基础。
而Lp-PLA2作为动脉粥样硬化斑块发生的重要的炎症因子,主要由动脉粥样硬化相关的巨噬细胞、平滑细胞及内皮细胞分泌[17]。本研究结果表明不稳定斑块组的Lp-PLA2水平明显高于稳定斑块组。既往研究发现,相关炎症细胞分泌的Lp-PLA2一部分会释放入血并与血浆中的LDL结合释放出氧化型游离脂肪酸和溶血卵磷脂等致炎物质。该致炎物质又可通过氧化应激反应进一步损伤血管内皮细胞,并促进巨噬细胞形成。随后吞噬氧化型低密度脂蛋白形成泡沫细胞,最终参与动脉粥样硬化斑块的形成[18]。本研究结果也进一步证实了Lp-PLA2与动脉粥样硬化形成的相关性。二元Logistic回归分析结果表明,校正后的Lp-PLA2仍然是AS的独立危险因素,这与先前研究结果相似[19]。目前,有学者推荐Lp-PLA2<200 μg/L为低心血管疾病风险,200~235 μg/L为临界高心血管疾病风险,>235 μg/L为高心血管疾病风险[20]。这与本研究结果不谋而合。本研究通过ROC曲线分得出斑块稳定性最佳截断值为202.97 μg/mL。另外还有研究提示急性缺血性脑卒中患者血清Lp-PLA2水平越高,患者的病情越严重,且Lp-PLA2是急性缺血性脑卒中患者预后的危险因素[21]。另外,血清Lp-PLA2水平的升高还可作为缺血性脑卒中再发的预测因子,这也为缺血性脑卒中的预防和治疗提供了一个新的方向[22]。
本研究结果还发现不稳定斑块组患者罹患高血脂及发生缺血性脑卒中的概率也高于稳定斑块组的患者。缺血性脑卒中的基本病因就是动脉粥样硬化,尤其是不稳定性动脉粥样斑块,这与先前研究相似[23-25]。而两组患者的年龄、高血压、高血糖病史、吸烟史则未见明显差异,这与李振洲等[23]的研究不同,推测原因在于纳入研究的对象均为老年病医院的患者,研究对象年龄普遍偏大,加上患者高血压、高血糖等病史差异较小,故代表性较差,这也是本研究的局限性。
综上所述,随着Lp-PLA2的升高,斑块的不稳定性随之提高,发生缺血性脑卒中的风险增大。以血浆Lp-PLA2等于202.97 μg/mL为截断值来评估斑块稳定性具有很好的灵敏度和特异度。因此,在超声发现颈总动脉或颈内动脉斑块时,可通过检测患者血浆Lp-PLA2水平来预测斑块的稳定性,为不稳定斑块的早期发现及缺血性脑卒中的早期预防提供了参考价值。

