GNA15对重型哮喘患儿预后的预测价值
李丹 范宇杭 李耕旭 陈新春 孙国华 李世峰
1唐山市人民医院儿科(河北 唐山 063001);华北理工大学 2公共卫生学院,3临床医学院(河北 唐山 063210)
哮喘是一种以气道阻塞为特征的慢性呼吸道疾病,在世界范围内影响大约20%的儿童,低剂量吸入糖皮质激素通常能良好的控制哮喘症状。但是约5%的哮喘儿童需要大剂量吸入皮质类固醇或口服皮质类固醇以控制症状,或症状的发生持续和恶化,此类哮喘即为难治性哮喘(therapyresistant asthma)或重型哮喘(severe asthma,SA)[1]。重型哮喘患儿可能导致不良预后,极大影响患儿的身体和心理发育,甚至危及患儿生命[2]。然而,重型哮喘通常是由处方用药剂量和症状的控制状态来定义的,目前仍没有较好的重型哮喘诊断标准,且不同重型哮喘患者的临床表现和对药物的反应存在较大的差异[3],因此积极探索重型哮喘的发病机制和诊疗靶点具有重要的意义。
研究者们认为,哮喘的急性发作与过度炎症活动有关,其中CD4+的Th2 细胞及其标志性效应细胞因子白介素(interleukin,IL)-4、IL-13 水平升高,以及中性粒细胞活化释放IL-17a 上调,在成人和儿童哮喘中较早被报道具有明确的致病作用,并导致气道重塑[4-6]。然而,针对细胞因子阻断的新药物疗法在临床反应上存在不一致性。可见,哮喘可能代表一系列不同的病理生理亚表型[7]。针对哮喘的生物信息学研究也发现,轻度哮喘(mild asthma,MA)和重型哮喘患者的转录组基因集存在较大的差异。为筛选更适于临床诊断和预后判定的标志物,本研究中笔者从GEO 数据库下载了外周血单个核细胞转录组测序数据,通过多重生物信息学方法,将与重型哮喘有关的基因集进行系统的评价,筛选出GNA15 基因可能与重型哮喘关系最为密切。GNA15 基因编码的Gα15 蛋白最早被报道为造血组织和肺组织特异性表达[8],GNA15 通过与G 蛋白偶联受体(G Protein-Coupled Receptors,GPCRs)相互作用,调节细胞对微环境变化的响应和信号传导,对免疫细胞功能的调控至关重要[9]。然而GNA15 在哮喘中的临床价值尚不清楚。本研究旨在分析GNA15 在重型哮喘中的表达和对重型哮喘预后的预测效能,为重型哮喘的临床诊治提供理论依据。
1 资料与方法
1.1 数据集获取和生信分析截止至2019年8月20日,在GEO 数据库[10]里下载哮喘儿童外周血单个核细胞基因芯片数据集GSE27011,数据集为54例儿童样本,分为对照组、轻度哮喘组和重型哮喘组。下载Affymetrix 公司GPL6244 平台的芯片注释文件。采用R 软件对基因表达矩阵进行多组间差异分析、表达聚类分析、基因共表达网络分析、临床信息相关性分析。将重型哮喘组显著升高的基因群与重型哮喘组相关性最高的基因模块取交集,获得关键基因GNA15。
1.2 病例资料选取2019年9月至2020年12月在唐山市人民医院儿科确诊为哮喘的儿童为研究对象,其中重型哮喘患儿48 例、轻度哮喘患儿34例,患者均符合《儿童支气管哮喘诊断与防治指南(2016年版)》[3]诊断标准。排除标准:(1)急性感染性疾病;(2)先天性的心肺疾病、脏器功能不全;(3)其他过敏性疾病;(4)研究期内放弃治疗;(5)临床资料不完整;(6)随访失访。选取同时期体检的健康儿童为对照组30 例。本研究获得儿童家属的知情同意,经院内伦理委员会审核通过。
1.3 治疗方法所有患儿入院时均采用吸人糖皮质激素(inhaled conicostemid,ICS)结合短效β2 受体激动剂治疗,控制哮喘症状[3]。
1.4 肺功能指标检测入院患儿次日清晨测定肺功能,测定前12 h 停止吸人β2 受体激动剂,记录第1 秒用力呼气容积占预计值百分比(FEV1%)和最大呼气峰流速占预计值百分比(PEF%)。
1.5 血清炎症介质检测收集儿童晨起空腹血液样本4 mL,其中2 mL 置于非抗凝管,4 ℃放置2 h,1 000 r/min 离心15 min,获得血清。采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒检测儿童血清中IL-4 和L-17A(南京建成生物工程研究所)操作步骤参照试剂盒说明书。
1.6 RT-PCR 检测儿童外周血GNA15 的表达另外2 mL 血液样本置于乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid,EDTA)抗凝管,密度梯度离心法分离单个核细胞。采用RT-PCR 检测儿童外周血单个核细胞GNA15 的表达,总RNA 提取参照TRIzol®(美国Invitrogen 公司)说明书。用第一链cDNA 合成试剂盒逆转录合成cDNA(北京宝日医TaKaRa 生物技术有限公司)。PCR 体系参照实时荧光定量PCR 检测试剂盒(美国赛默飞公司)说明书。GNA15-正向引物:5'-CTA CCA GAA CAT CTT CGT GTC CAT-3';GNA15-反向引物:5'-GCT GAA TCG AGC AGG TGG AA-3'。反应条件如下:94 ℃反应15 s、55~65 ℃反应30 s、72 ℃反应30 s。进行40 个循环,根据ΔΔCt 法计算GAPDH 与GNA15的相对表达。
1.7 重症哮喘组患儿随访所有住院儿童采用复查或电话咨询的方式每个月随访1 次,共均随访1年,填哮喘控制测试ATC 评分表。将出现过1 次及以上ATC 评分<20 的患者,记录为预后较差,反之为预后良好。
1.8 统计学方法采用SPSS 22.0 软件对数据进行统计学分析,计量资料采用均数± 标准差表示,组间比较采用单因素方差分析,用Levene 法行方差齐性检验;计数资料采用例数表示,组间采用χ2检验;采用多因素二元logistic 回归分析重型哮喘患儿预后相关因素;采用受试者工作特征曲线(ROC)评估血液中GNA15 水平预测重型哮喘患儿预后的效能。以P<0.05 表示差异有统计学意义。
2 结果
2.1 三组儿童基本资料比较对照组、轻度哮喘组和重型哮喘组儿童的性别、年龄、体质指数差异均无统计学意义(P>0.05)。重型哮喘组母乳喂养水平与对照组和轻度哮喘组儿童均降低,差异有统计学意义(P<0.05)。与对照组相比,轻度哮喘组儿童的肺功能指标显著降低,炎症介质IL-4 和IL-17的含量显著上调(P<0.05);与轻度哮喘组相比,难治哮喘组儿童的FEV1%指标显著降低(P<0.05),而PEF%、炎症介质IL-4 和IL-17 的含量在轻度哮喘组与难治哮喘组之间差异无统计学意义(P>0.05。重度哮喘组有15 例儿童出现预后不良。见表1。
表1 三组儿童基本资料比较Tab.1 General information of subjects in three groups ±s
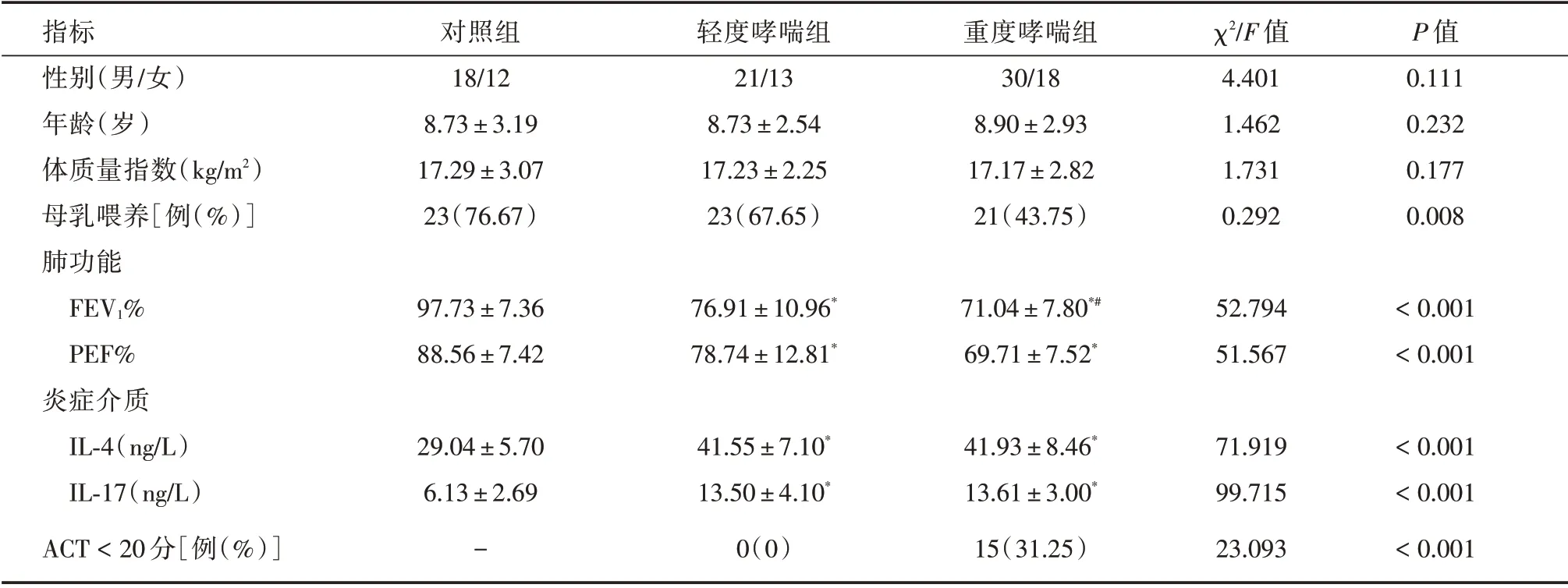
表1 三组儿童基本资料比较Tab.1 General information of subjects in three groups ±s
注:与对照组相比,*P<0.05;与轻度哮喘组相比,#P<0.05
指标性别(男/女)年龄(岁)体质量指数(kg/m2)母乳喂养[例(%)]肺功能FEV1%PEF%炎症介质IL-4(ng/L)IL-17(ng/L)ACT<20 分[例(%)]对照组18/12 8.73±3.19 17.29±3.07 23(76.67)轻度哮喘组21/13 8.73±2.54 17.23±2.25 23(67.65)重度哮喘组30/18 8.90±2.93 17.17±2.82 21(43.75)χ2/F 值4.401 1.462 1.731 0.292 P 值0.111 0.232 0.177 0.008 97.73±7.36 88.56±7.42 76.91±10.96*78.74±12.81*71.04±7.80*#69.71±7.52*52.794 51.567<0.001<0.001<0.001<0.001<0.001 29.04±5.70 6.13±2.69-41.55±7.10*13.50±4.10*0(0)41.93±8.46*13.61±3.00*15(31.25)71.919 99.715 23.093
2.2 三组儿童血清GNA15 水平的比较与对照组相比,轻度和重度哮喘组儿童外周血GNA15 水平显著上调(P<0.05);与轻度哮喘组相比,重度哮喘组儿童外周血GNA15 的含量显著增高(P<0.05),差异均有统计学意义。如图1。
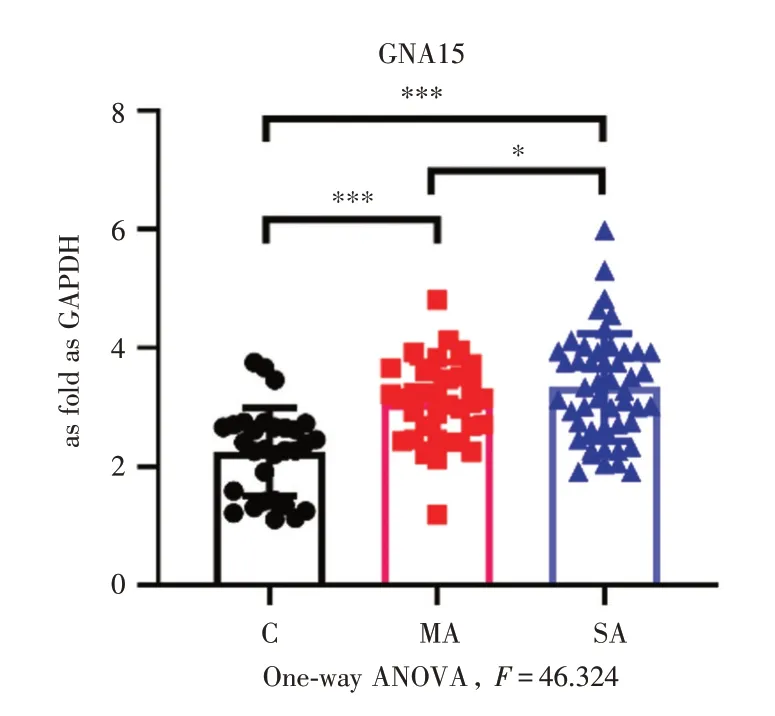
图1 三组儿童GNA15 表达水平的比较Fig.1 Comparison of GNA15 expression levels among three groups of children
2.3 重型哮喘患儿预后的单因素分析与预后良好组相比,预后不良组患儿母乳喂养率较低,且外周血中GNA15的含量显著上调(P<0.05)。其他指标在两组之间差异无统计学意义(P>0.05),见表2。
表2 重型哮喘患儿预后的单因素分析Tab.2 Univariate analysis of prognosis in SA children with different prognosis ±s

表2 重型哮喘患儿预后的单因素分析Tab.2 Univariate analysis of prognosis in SA children with different prognosis ±s
因素性别(男/女)年龄(岁)体质指数(kg/m2)母乳喂养[例(%)]FEV1%PEF%IL-4 IL-17 GNA15预后良好组19/14 9.36±2.96 17.40±3.04 17(51.51)71.30±7.40 70.80±7.16 40.59±8.42 13.27±2.75 3.03±0.70预后不良组11/4 7.87±2.70 16.28±2.28 3(20.00)70.40±8.85 67.30±7.99 44.87±8.07 14.37±3.50 4.03±0.93 t/χ2值1.093 1.670 0.685 4.214 0.381 1.494 1.656 1.179 4.161 P 值0.296 0.102 0.497 0.040 0.705 0.142 30.105 0.245<0.001
2.4 重型哮喘患儿预后相关因素的logistic 回归分析将单因素分析中差异有统计学意义的因素纳入二分类logistic 回归分析,GNA15 是预后不良的危险因素(OR=5.117,P<0.05)。见表3。
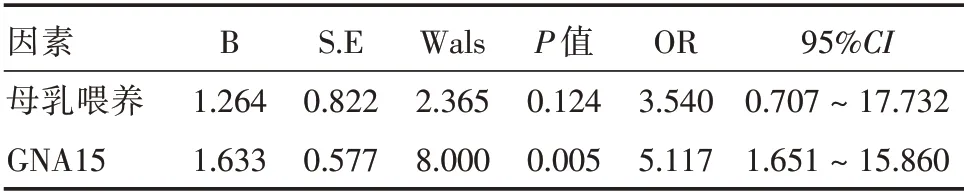
表3 重型哮喘患儿预后相关因素的多因素Logistic 回归分析Tab.3 Multivariate Logistic regression analysis of prognostic factors in SA children
2.5 血液中GNA15 水平预测重型哮喘患儿预后的效能ROC 曲线分析显示,GNA15 预测儿童重型哮喘的曲线下面积(AUC)为0.820,灵敏度为0.733,特异性为0.879(P<0.05),见图2。
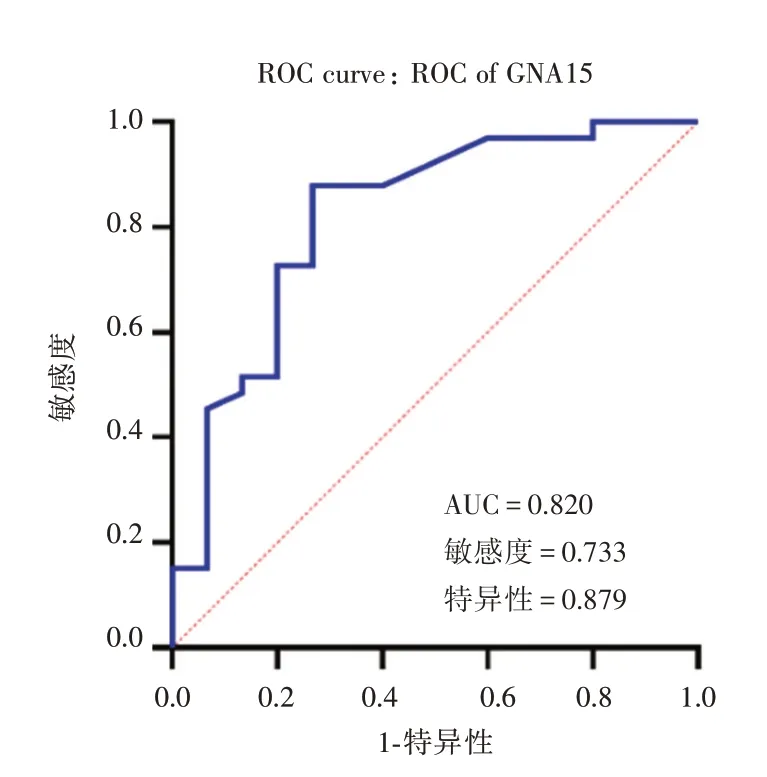
图2 血液GNA15 预测重型哮喘儿童预后的ROC 曲线图Fig.2 ROC curve of blood GNA15 predicting prognosis in children with SA
3 讨论
哮喘是一种气道异质炎症性疾病,GPCRs 在哮喘病理生理学中发挥着重要作用,这一点从临床上GPCRs 靶向药物的广泛应用和临床开发中GPCRs 靶向药物候选药物的数量上得到了证实,如β2-肾上腺素能受体、毒蕈碱乙酰胆碱受体、白三烯和PG 受体、趋化因子受体和腺苷受体激动剂等[11]。虽然目前的哮喘治疗方法对大多数哮喘患者有效,但仍有大量哮喘患者控制不良,可能出现哮喘加重。这与哮喘内源性致病因素多样化和其复杂的生理机制有关。在儿童重型哮喘中,免疫细胞成分存在较大的变异性,有学者认为,重型哮喘患儿不同的炎症谱背后的机制可能是复杂、多样的,并与皮质类固醇敏感性有关[12]。队列研究显示,炎症细胞表型是区分轻度哮喘和重型哮喘的重要标准之一[13],本研究通过对外周血单个核细胞基因表达聚类分析,并通过加权基因共表达网络分析建立了与重型哮喘表型关联最密切的基因模块,最终获得了关键基因GNA15,即该基因符合在重型哮喘患儿中特异性高表达的特点,也与重型哮喘具有相关性。
GNA15 编码的Gα15 蛋白的表达水平受限,主要局限于造血细胞。关于GNA15 的研究国内外文献报道仅30 余篇,近期在多种疾病临床样本的生物信息学分析的关键基因中发现存在GNA15,可见GNA15 对人类健康的重要作用[14-15],然而GNA15 的作用机制和相关的临床验证数据较少。本研究首次在哮喘患儿外周血中验证了GNA15 表达上调,并初步分析证实了GNA15 具有一定的预测重症哮喘患儿预后的效能。有研究[16]显示,GNA15 与免疫调控关系密切,Gα15 的活化可逃逸β-抑制素(β-arrestin)的监控,可以通过竞争性结合GPCRs 激活Ca2+信号,其基因缺失显著降低了巨噬细胞中补体C5a 诱导的Ca2+释放[17]。在肥大细胞中,Ca2+贮存量降低可改变线粒体膜电位,引起细胞脱颗粒,并促进哮喘[18]。急性髓细胞白血病(acute myeloid leukemia,AML)中研究显示,GNA15 在CD34+造血干细胞中上调,随着细胞成熟而降低[19],GNA15 在胰腺导管腺癌[20]、肝癌[21]、和食管鳞状细胞癌[22]以及I 型糖尿病、脓毒病中表达升高,与患者总体生存期较差相关。这与Gα15 调节细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、核因子(nuclear factor,NF)-κB等信号活化,促进细胞增殖并抑制细胞凋亡有关[19]。Gα15 效应物可靶向ras、p53 等基因,调控细胞活性。本研究也发现GNA15 与患儿FEV1%、PEF%负相关,然而,GNA15 是否可调控气道重构,以及GNA15 高表达患儿糖皮质激素敏感性降低的原因仍需要更多的基础和临床研究探索。

