静脉-动脉体外膜氧合辅助心源性休克的危险因素分析:一项连续5年的回顾性分析
刘淼淼 郭锋伟 刘锋锋 张颖 师桃 宋艳 闫炀
西安交通大学第一附属医院1心血管外科,2超声科(西安 710007)
心源性休克(cardiogenic shock,CS)是由于各类心脏疾病引发的全身低灌注综合征,病情危重,院内死亡率高[1]。近年来循环机械辅助尤其是静脉-动脉体外膜氧合(veno-arterial extracorporeal membrane oxygenation,V-A ECMO)及其衍生出的体外心肺复苏技术(extracorporeal cardiopulmonary resuscitation,ECPR)临床应用逐年增多[2-3],成为心源性休克治疗的另一手段,但其有效性及对疾病预后的影响仍存在争议[4-6]。因此,在应用VA-ECMO辅助心源性休克治疗过程中,寻找可能影响治疗效果和预后的危险因素尤为重要[7-8]。本研究回顾了我中心5年来VA-ECMO 辅助心源性休克患者的一般资料和临床数据,发现分析危险因素,探索今后可能影响治疗效果和预后的敏感指标。
1 资料与方法
1.1 病例资料本研究为回顾性研究。选取我中心自2016年1月至2021年1月5年内收治的113例心源性休克患者因病情需要应用VA-ECMO 辅助,排除23 例经皮冠状动脉介入(percutaneous coronary intervention,PCI)及经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)术后即刻撤除ECMO 患者,5 例VA-ECMO 置入即刻死亡患者以及8 例放置后交于其他中心管理的患者,最终纳入77 例患者。根据患者转归分为康复组(A 组)和死亡组(B 组)。见图1。

图1 患者筛选流程图Fig.1 Patient screening flow chart
1.2 诊断标准和纳入及排除标准心源性休克诊断标准[9]:(1)收缩压<90 mmHg 大于等于30 min或在临床支持措施(药物、机械等)下维持收缩压≥90 mmHg;(2)器官灌注不足(尿量<30 mL/h 或四肢冰冷合并心率>60 次/min);(3)血流动力学指标:心指数(cardiac index,CI)≤2.2 L/min·m2,肺毛细血管楔压(pulmonary capillary wedge pressure,PCWP)≥15 mmHg。
纳入标准:年龄≥18岁,符合心源性休克诊断标准,经内科或外科治疗效果不佳需行VA-ECMO 辅助;ECMO 辅助时间>24 h。排除标准:年龄<18 岁或>75 岁,严重的肝脏功能障碍、患终末期恶性肿瘤、严重的凝血功能障碍、不可逆的器官功能衰竭或经过长时间的无效心肺复苏。
1.3 方法及资料收集收集全部患者的基本资料及临床资料,包括性别、年龄、病因以及辅助前左室射血分数(left ventricle ejection fraction,LVEF%)、序贯器官衰竭评分(sepsis-related organ failure assessment score,SOFA 评分)、ECMO 辅助时间、是否使用连续血液净化治疗(continuous renal replacement therapy,CRRT)及主动脉内球囊反搏(intraaortic balloon pump,IABP)、是否实施了经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)、外科手术及ECPR、ICU 住院时间、平均动脉压、血气分析、N-端脑利钠肽前体(N-terminal pro-Brain Natriuretic Peptide,NT-pro BNP)、血常规、肝功能及肾功能等。
我中心由心血管外科医师、心脏重症监护医师、监护护士、体外循环师、超声医师等共同组成专业的ECMO 团队。根据患者情况选择动静脉,穿刺或切开放置合适型号ECMO 插管,动脉端常规放置远端灌注管以保证下肢供血。本研究中所有患者均使用德国迈科唯(Maquet)公司ECMO 机器、膜式氧合器及管道,瑞典百特(Baxter)公司血液净化机及管道,美国美爱诺(Arrow)公司主动脉内球囊反搏机器及管道。动脉血气分析采用丹麦雷度(Radiometer)公司ABL90 FLEX 血气、血氧、电解质和代谢物分析仪。所有化验检查均由西安交通大学第一附属医院检验科完成。SOAF 评分由研究者(刘)独立进行。ECMO 辅助期间管理及撤机标准遵照成人体外膜氧合循环辅助专家共识[10]。康复组均达出院标准。
1.4 统计学方法采用R3.4.4 进行统计学分析。计数资料以例(%)描述,比较采用χ2检验或Fisher确切概率法;符合正态分布的计量资料以(±s)表示,比较采用t检验或者方差分析。不符合正态分布的计量资料采用M(P25,P75)描述,比较采用非参数检验。以VA-ECMO 治疗患者康复或者死亡为因变量,以年龄、SOFA 评分、是否使用CRRT 及IABP、ICU 住院天数、NT-pro BNP、血小板计数、肌酐、尿素、乳酸等为自变量,建立单因素logistic 回归方程,将单因素分析差异有统计学意义的纳入回归模型建立多因素logistic 模型。P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料共收集了77 例VA-ECMO 辅助心源性休克患者,康复组所占比例为45.45%,死亡组所占比例为54.55%。男48 例(62.34%),女29 例(37.66%)。与康复组相比,死亡组年龄更高,辅助前SOFA 评分更高,CRRT 及IABP 运用比例亦更高(P<0.05)。两组间在性别、辅助前LVEF%、ECMO辅助时间、PCI 比例、外科手术比例、ECPR 比例及ICU住院时间差异均无统计学意义(P>0.05)。见表1。
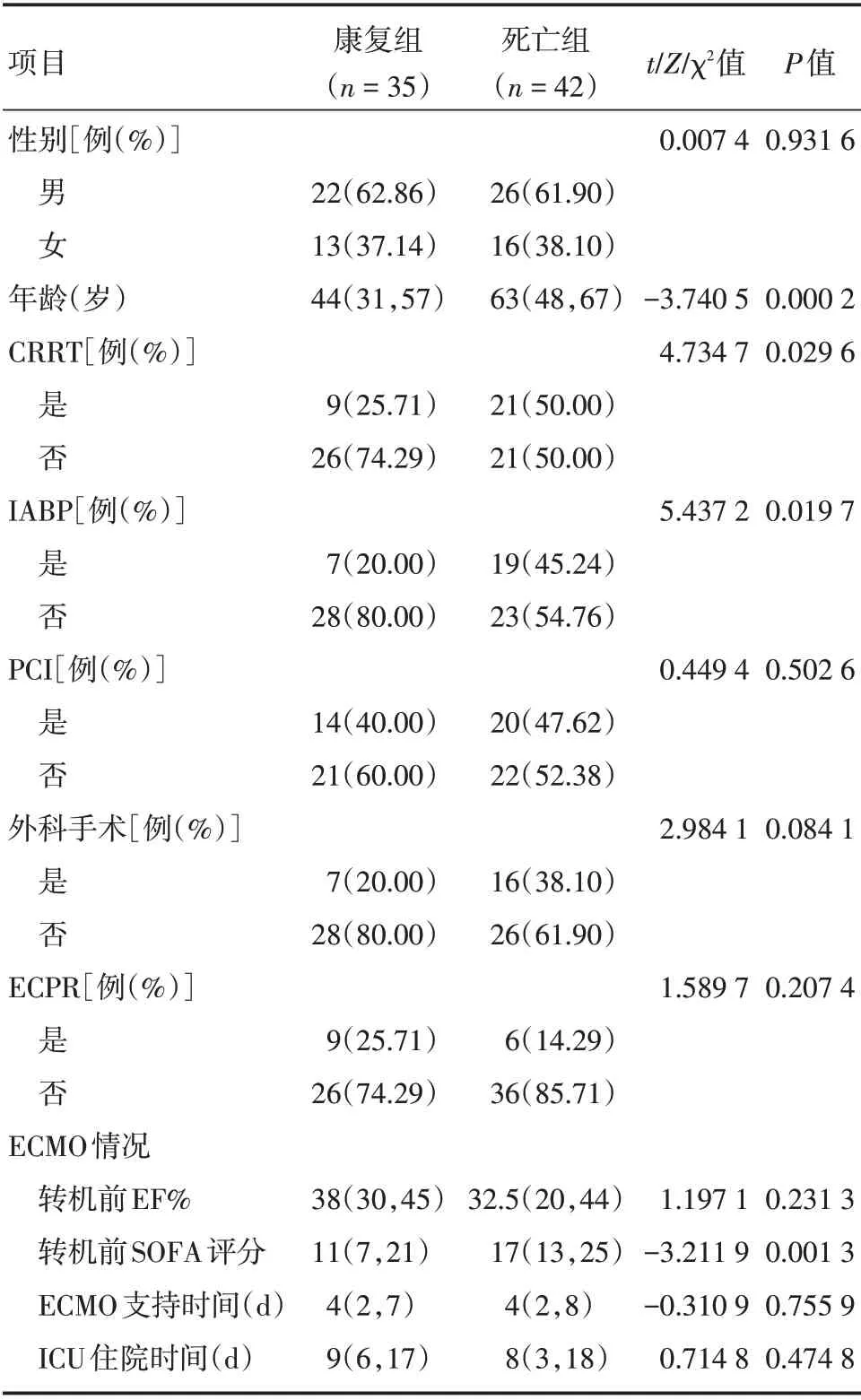
表1 两组行VA-ECMO 治疗患者基本资料比较Tab.1 Comparison of general data between the two groups of patients treated with VA-ECMO M(P25,P75)
2.2 临床资料比较两组患者ECMO 辅助前的临床数据,死亡组患者血小板计数低于康复组(P<0.05),肌酐、尿素及乳酸均显著高于康复组(P<0.05)。NT-pro BNP、降钙素原、血红蛋白、C反应蛋白、白细胞计数、乳酸脱氢酶、总胆红素、白蛋白、血气pH 值、氧合指数及平均压等差异均无统计学意义(P>0.05)。见表2。
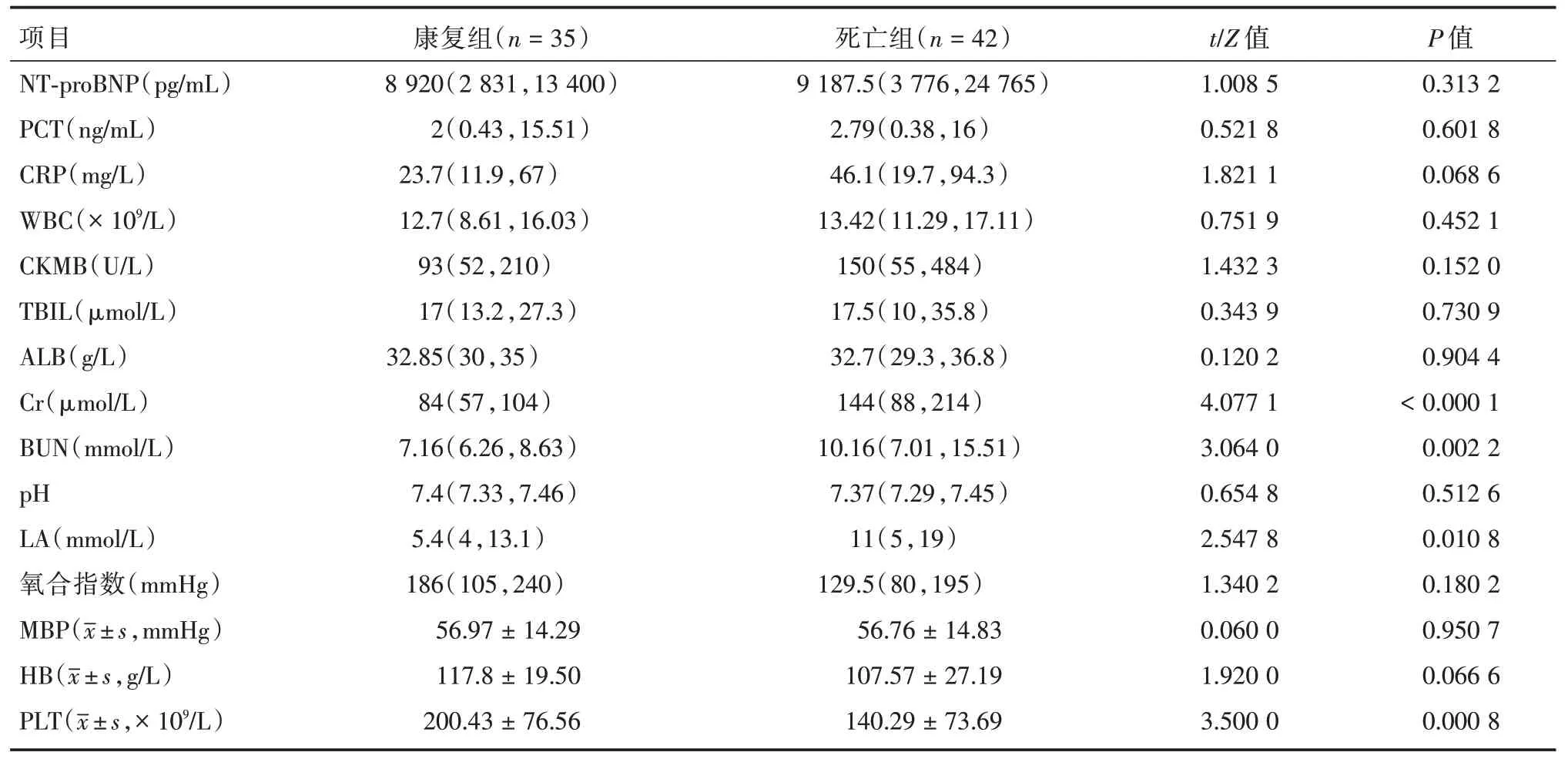
表2 两组VA-ECMO 治疗患者转机前临床数据比较Tab.2 Comparison of clinical data between two groups of patients before VA-ECMO treatment M(P25,P75)
2.3 单因素及多因素logistic 回归分析将单因素logistic 回归方程分析得出影响VA-ECMO 治疗患者康复和死亡的年龄、SOFA 评分、CRRT 及IABP 使用、NT-pro BNP、PLT、Cr、BUN、LA 等因素构建多因素logistic 回归分析方程,结果显示,年龄和辅助前血小板计数是影响心源性休克患者VA-ECMO 辅助治疗康复和死亡的独立危险因素。研究对象的死亡影响因素中,年龄越大患者死亡风险越高(OR=1.068,95%CI:1.027~1.110),辅助前血小板计数越低患者死亡风险越高(OR=0.991,95%CI:0.984~0.998),差异有统计学意义(P<0.05)。见表3。

表3 两组VA-ECMO 治疗患者康复和死亡影响因素的logistic 回归分析Tab.3 Logistic regression analysis of factors affecting recovery and death in ECMO patients
3 讨论
心源性休克是心脏低排血所导致的危及生命的器官低氧低灌注状态[11],其中最常见病因是急性心肌梗死,约占总发病率的70%[12-13]。心源性休克临床治疗通常需要使用大剂量血管活性药物,而药物引起的心肌氧耗增加、血管收缩等不良反应往往起到加重原发病的反作用[14]。现阶段机械辅助治疗兴起,VA-ECMO 通常由股静脉-股动脉插管,股静脉自右心房引出静脉血,通过膜式氧合器进行氧和二氧化碳交换后逆行泵回主动脉,部分替代体循环和呼吸,通常作为心源性休克尤其是难治性心源性休克治疗的最后的抢救性治疗方法为国内外各指南所推荐[10,15]。然而VA-ECMO带来的主动脉逆向血流不同程度增加左心室后负荷、影响左室射血功能,导致左心室舒张末压升高、主动脉瓣和二尖瓣关闭不全、冠状动脉血流量减少甚至肺水肿。体外生命支持组织(Extracorporeal Life Support Organization,ELSO)统计的世界多中心VA-ECMO 辅助CS 患者生存率仅为42%[16]。有研究表明在难治性心源性休克发作之前尽早开始VA-ECMO 辅助可能改善患者的预后[17],但此类研究较少,目前国外实验室五项随机临床试验(NCT01633502、NCT03813134、NCT03637205、NCT-04184635、NCT02301819)仍处于研究过程中。而VAN DIEPEN 等[18]统计了近10年数据,VA-ECMO并没有使心源性休克患者的30 d 院内死亡率得到显著改善(2007-2012年的59.0%vs.2013-2015年的61.4%),甚至有研究提示可能有多达25%~35%的患者无效[19]。因此,VA-ECMO 辅助心源性休克治疗效果存在争议,掌握辅助指征、评测辅助可能达到的治疗效果,寻找可能影响治疗效果和预后的敏感指标尤为重要。
本研究中患者生存率约45.45%,与国际数据基本一致。经过临床数据及logistic 单因素回归分析康复组和死亡组年龄、SOFA 评分、CRRT 及IABP 的使用、NT-pro BNP、PLT、Cr、BUN、LA 等值均存在明显差异,可能影响VA-ECMO 对心源性休克患者的辅助效果。而性别、辅助前左室射血分数(EF%)、ECMO 辅助时间、经皮冠状动脉介入治疗(PCI)比例、外科手术比例、体外心肺复苏(ECPR)比例、ICU住院时间、血红蛋白、C反应蛋白、白细胞计数、乳酸脱氢酶、总胆红素、白蛋白、血气pH 值、氧合指数及平均动脉压等无明显差异。logistic 多因素回归分析得出,年龄以及ECMO 上机前血小板数量可能是影响生存率的独立危险因素,年龄越大、辅助前血小板计数越低,死亡风险越高。
高龄在早期研究中就已证明是VA-ECMO 辅助效果的影响因素。本研究中死亡组平均年龄显著高于康复组,年龄越大辅助效果越差,生存率越低,与以往研究结果一致[20]。VA-ECMO 辅助尤其是心源性休克患者常存在不同程度的凝血功能异常,且在辅助治疗中需使用各类抗凝药物,与预后密切相关[21]。血小板是重要的凝血因子。THIELE等[22]分析从591 项ECMO 相关研究中筛选7 项血小板相关研究,发现与健康个体相比ECMO 治疗前和治疗期间的血小板计数均偏低,且治疗期间持续偏低,同时可能因血小板表面标志物CD62和CD63、血小板黏附受体等减少而导致血小板自身功能异常。本研究中死亡组在VA-ECMO 辅助前血小板计数显著低于康复组,目前此类研究较少,但也有学者得出相同结论[23-24]。因此,辅助前低血小板是VA-ECMO 辅助心源性休克患者的独立危险因素。在今后的治疗中,提高辅助前血小板数量有可能改善心源性休克患者预后。
NT-pro BNP 和乳酸是临床常用的指标,提示心功能较差、组织器官灌注不良,已被多项研究证明与ECMO 辅助治疗效果和预后相关,与本研究一致[25-27]。主动脉内球囊反搏是将球囊放置于降主动脉内,在心脏舒张期快速充盈、收缩期快速排空,从而增加冠状动脉血流灌注、降低心脏后负荷及心肌耗氧量,是临床心源性休克治疗最常用的机械辅助装置[28]。虽然IABP-SHOCK Ⅱ研究后各指南对IABP 推荐逐渐降级[29-31],但在VAECMO 辅助期间IABP 被证实可降低ECMO 所引起的左心室后负荷和肺水肿[32-34]。心源性休克患者与ECMO 辅助患者均易合并急性肾功能,肾功能不全可能是导致死亡的重要危险因素[35-37]。本研究中死亡组肌酐及尿素值均显著高于康复组,肾功能明显异常。临床上常在ECMO基础上联合使用CRRT 改善肾功能,清除炎性及代谢产物,严格液体管理。本研究中死亡组IABP 及CRRT 等机械辅助与VA-ECMO 联用比率高于康复组,可能由于死亡组心源性休克患者心脏原发病更加严重并已存在急性肾功能不全等并发症,ECMO 需联合运用更多的机械辅助设施治疗原发病。综上所述,心源性休克临床死亡率高,VA-ECMO 是心源性休克患者重要的机械辅助方法,高龄、基础心脏病严重、需应用IABP 和(或)CRRT、低血小板、合并肾功能不全的患者提示预后不良,提高ECMO 辅助前血小板数量有可能成为今后改善预后的一个靶点。而VA-ECMO 在国内仍处于发展阶段,辅助治疗心源性休克仍在探索。因此,本研究样本量相对有限,可能存在研究偏倚,我中心将继续此研究方向,补充和收集更多临床数据以供参考。

