基于促代谢因子探讨卡格列净对2型糖尿病胰岛素抵抗的影响*
薛汝月,刘新宇
(1.锦州医科大学研究生学院,辽宁锦州 121001;2.锦州医科大学附属第一医院内分泌科,辽宁锦州 121000)
糖尿病已成为继心脑血管疾病、肿瘤后的又一严重危害大众健康的慢性非传染性疾病,其患病率、发病率及致死率高,并发症多,给社会及家庭带来沉重的经济和生活负担[1]。中国2型糖尿病(type 2 diabetes mellitus,T2DM)患病人数已高居全球首位[2],最新的流行病学调查显示中国18岁及以上成年人糖尿病患病率达12.8%,糖尿病前期患病率达35.2%[1]。胰岛素抵抗(insulin resistance,IR)是引起T2DM主要的病因之一[3],导致机体对胰岛素生理作用反应性及敏感性降低,从而导致血糖水平升高,出现糖尿病、冠心病、肥胖症、代谢综合征等多种代谢紊乱性疾病[4]。IR与促代谢因子关系密切,促代谢因子是一种主要存在肝脏中的新型分泌性糖蛋白,通过促进胰岛β细胞增殖及激活胰岛素信号通路,改善IR[5-6]。IR与血清尿酸(SUA)关系密切,SUA升高会引起机体对葡萄糖的摄取下降、利用率降低,发生IR[7]。钠葡萄糖协同转运蛋白2抑制剂(sodium glucose cotransporter 2 inhibitors,SGLT2i)是最近发现的一种新型降糖药,通过抑制近端肾小管钠葡萄糖协同转运蛋白2(sodium glucose cotransporter 2,SGLT2)减少肾脏对葡萄糖的重吸收,降低肾糖阈,增加尿糖排泄,从而降低血糖[8]。SGLT2i能否改善IR及改善IR的机制尚不明确,所以本研究通过临床治疗,观察应用卡格列净后促代谢因子、SUA、HOMA-IR的变化,明确卡格列净能否改善IR,并初步探讨其改善IR的机制。
1 资料与方法
1.1 一般资料
将锦州医科大学附属第一医院门诊及住院T2DM患者82例作为观察组,分为A组和B组;其中A组40例接受二甲双胍治疗,B组42例接受二甲双胍联合卡格列净治疗,另选取同期在锦州医科大学附属第一医院体检者78例作为对照组。纳入标准:T2DM患者符合2016年美国糖尿病协会(ADA)诊断标准。排除标准:(1)1型糖尿病、继发性糖尿病、妊娠期糖尿病或其他特殊类型糖尿病;(2)合并恶性感染、严重炎症反应,处于酮症、高渗性昏迷、急性心脑血管疾病等应激状态;(3)心、肝、肾各器官严重功能障碍或处于衰竭状态。研究对象均签署知情同意书,并通过医院伦理委员会批准。
1.2 方法
1.2.1治疗方案
A组接受500~2 000 mg/d二甲双胍治疗,B组接受500~2 000 mg/d二甲双胍联合100~300 mg/d卡格列净治疗,两组患者均治疗3个月。
1.2.2检测指标
记录患者性别、年龄、身高、体重、收缩压(SBP)、舒张压(DBP)、甘油三酯(TG)、胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、空腹血糖(FPG)、糖化血红蛋白(HbA1c)、空腹胰岛素(Fins)及血清尿酸(SUA)。按照稳态评估法计算 HOMA-IR,即 HOMA-IR=FPG× Fins/22.5。由同一医务人员测量身高、体重、SBP和DBP,并计算BMI。
1.2.3促代谢因子检测
采用酶联免疫吸附试验测定促代谢因子水平(试剂盒购自上海沪峰生物公司),严格按照试剂盒说明书操作。
1.3 统计学处理
2 结 果
2.1 观察组与对照组临床资料比较
观察组与对照组BMI、SBP、DBP、TG、HbA1C、FPG、Fins、HOMA-IR、Scr、SUA、促代谢因子比较,差异有统计学意义(P<0.05),且观察组均高于对照组高,见表1。

表1 观察组与对照组临床资料比较

续表1 观察组与对照组临床资料比较
2.2 A、B两组的临床资料比较
两组性别构成比、年龄、BMI、SBP、DBP、TG、TC、HDL-C、LDL-C、HbA1C、FPG、Fins、HOMA-IR、Scr、SUA、促代谢因子比较,差异均无统计学意义(P>0.05),见表2。

表2 A、B两组患者临床资料比较
2.3 A、B两组患者治疗前后促代谢因子、HOMA-IR和SUA的比较
两组患者治疗前促代谢因子、HOMA-IR和SUA差异无统计学意义(P>0.05)。两组患者治疗后促代谢因子、HOMA-IR和SUA水平均下降(P<0.05),B组比A组下降更明显(P<0.05),见表3。

表3 两组患者治疗前后促代谢因子及HOMA-IR的变化
2.4 促代谢因子、SUA与各临床指标的相关性分析
Pearson相关分析提示,促代谢因子与BMI、TG、TC、LDL-C、FPG、Fins、HOMA-IR呈正相关(P<0.05)。SUA与BMI、Fins、HOMA-IR呈正相关(P<0.05),见表4。
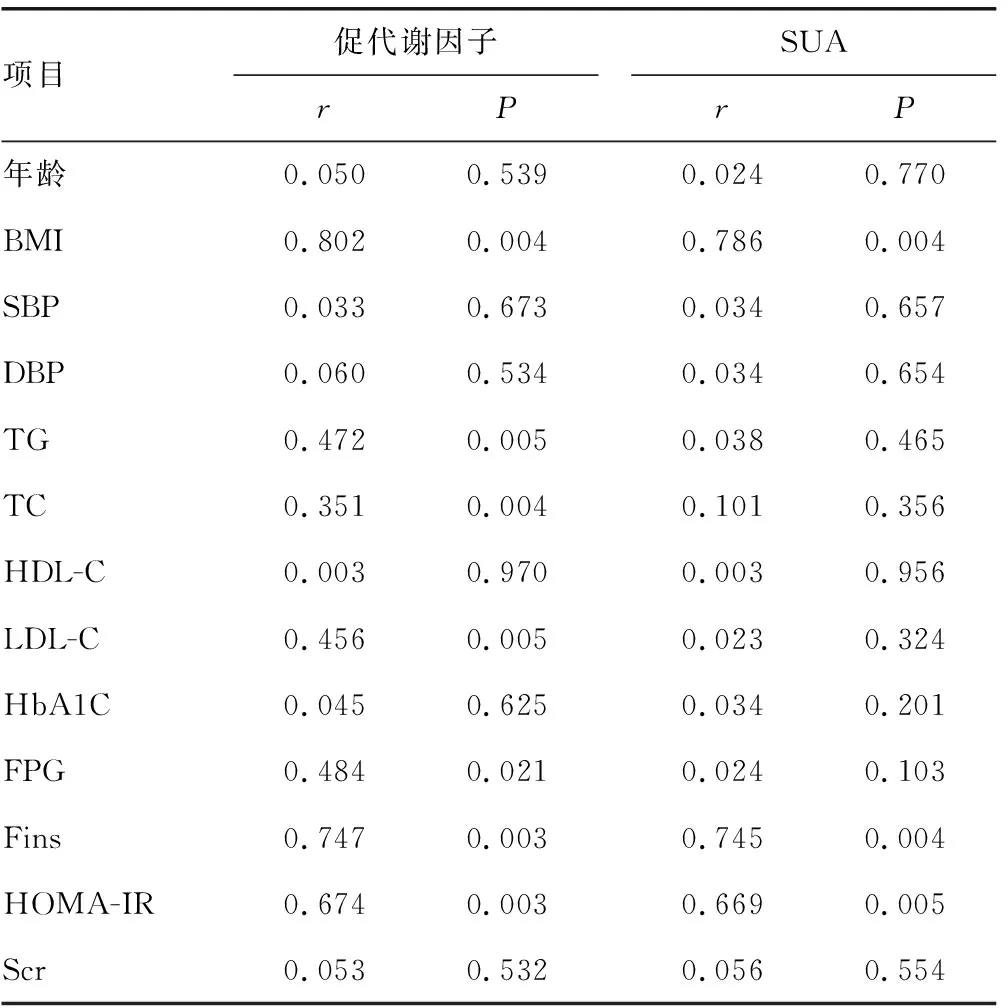
表4 促代谢因子、SUA与临床资料的相关性
2.5 促代谢因子、SUA与HOMA-IR的相关性
促代谢因子与HOMA-IR呈正相关(r=0.674,P=0.000),直线回归方程Y=0.019X-8.942(R2=0.626,P=0.000)。SUA与HOMA-IR呈正相关(r=0.669,P=0.000),直线回归方程Y=0.018X-1.136(R2=0.447,P=0.000),见图1、2。

图1 促代谢因子与HOMA-IR相关性散点图

图2 SUA与HOMA-IR相关性散点图
2.6 促代谢因子与SUA的相关性
促代谢因子与SUA呈正相关(r=0.674,P=0.000),直线回归方程Y=0.82X-242.189(R2=0.454,P=0.000),见图3。

图3 促代谢因子与SUA相关性散点图
3 讨 论
T2DM是一种以慢性高血糖为表现的代谢异常性疾病,其主要发病机制是胰岛素抵抗导致的胰岛素缺乏[9]。近年来T2DM患病人数不断增多,我国已成为患病人数最多的国家[10]。促代谢因子是最近发现的一种蛋白,它与胰岛素抵抗和脂质代谢有关[11]。研究[12]显示,高尿酸血症通过加剧胰岛素抵抗和胰岛β细胞功能缺陷,诱发和加重了糖代谢紊乱。SGLT2i是一种新型降糖药,它不依赖胰岛β细胞降糖,而是通过抑制近端肾小管吸收葡糖糖,增加尿糖排泄,从而降低血糖[13]。胰岛素抵抗在糖尿病的发生及发展过程发挥重要作用,改善胰岛素抵抗是治疗糖尿病的重要方法,SGLT2i能否改善胰岛素抵抗及改善胰岛素抵抗的机制目前尚不清楚,所以研究SGLT2i对胰岛素抵抗的影响及其机制对指导临床用药具有重要作用。
本研究发现促代谢因子与IR密切相关。促代谢因子与BMI、TG、TC、LDL、Fins、FPG、HOMA-IR呈正相关,表明促代谢因子与糖脂代谢密切相关。这与其他学者[6]研究结果一致。同时,本研究发现卡格列净联合二甲双胍组与二甲双胍组相比,前者的促代谢因子、HOMA-IR水平低于后者,说明卡格列净可以更好地降低促代谢因子水平及改善IR。促代谢因子水平的下降可以激活GSK-3β/PGC-1α信号通路,增强胰岛素信号转导通路活性,增加胰岛素敏感性。推测卡格列净通过降低促代谢因子水平,激活GSK-3β/PGC-1α信号通路,改善IR。
本研究发现,SUA与IR密切相关,SUA与BMI、Fins、HOMA-IR呈正相关,这与曹雯等[14]的研究结果一致。近年来,有研究[15]表明,SUA是IR的独立危险因素,动物实验[16]也证实,高尿酸血症可诱导大鼠发生IR。炎症可诱导胰岛素受体底物(IRS)丝氨酸/苏氨酸磷酸化,阻碍IRS酪氨酸磷酸化,导致IRS与胰岛素受体结合能力下降,干扰胰岛素激活的IR/IRS/PI3K/Akt信号通路[17],抑制葡萄糖转运蛋白4(GLUT4)蛋白表达或细胞膜转位,从而减弱胰岛素的生理作用,最终导致IR[18]。徐宛玲等[19]证实SUA可通过诱导炎性反应抑制胰岛素受体底物1(IRS1)/蛋白激酶B(Akt)信号通路和GLUT4蛋白表达参与IR的发生。近期进行的临床及动物实验,证明SGLT2i具有抗炎作用[20-23],同时本研究发现卡格列净联合二甲双胍组与单纯二甲双胍组相比,前者的SUA及HOMA-IR水平低于后者,说明卡格列净可以更好地降低血SUA水平及改善IR。SGLT2i促进肾脏排糖同时,有促尿酸排泄功能,其机制包括:(1)SGLT2i治疗后近端肾小管腔内葡萄糖排泄增强,通过顶端膜上钠葡萄糖转运蛋白9(GLUT9)亚型2促进细胞内尿酸盐的交换,导致尿酸盐分泌增加;同时SGLT2i抑制肾小管重吸收葡萄糖,导致尿中葡萄糖增加,进而抑制集合管中GLUT9亚型2介导的尿酸重吸收。(2)SGLT2i通过降低血清胰岛素水平,减少尿酸盐转运蛋白1(URAT1)对尿酸的重吸收。推测卡格列净通过降低SUA水平,抑制炎性反应,增强IRS-1/Akt信号通路和促进GLUT4蛋白表达,最终改善IR[24]。
HOMA-IR升高是促代谢因子水平升高和SUA水平升高的共同点,其与促代谢因子、SUA均呈正相关。有研究发现即使在年轻、无疾病的受试者中,黄嘌呤氧化还原酶活性与HOMA-IR呈正相关,代谢综合征(包括T2DM)可能会进一步增加黄嘌呤氧化还原酶活性[25]。黄嘌呤氧化还原酶能催化尿酸的形成,推测促代谢因子可能参与黄嘌呤氧化还原酶催化尿酸生成的过程,进而影响胰岛素抵抗。
综上所述,本研究表明卡格列净联合二甲双胍比单独使用二甲双胍治疗IR效果更好,卡格列净改善IR的作用机制可能是:(1)卡格列净通过降低促代谢因子水平,增强GSK-3β/PGC-1α信号通路,改善IR;(2)卡格列净通过降低SUA水平,抑制炎性反应,增强IRS-1/Akt信号通路和促进GLUT4蛋白表达,最终改善IR。

