氯化消毒水源回灌过程地下水化学特征研究
陈学群,刘 丹,张文静,管清花,田婵娟,辛光明
(1.山东省水利科学研究院,济南 250013;2.山东省水资源与水环境重点实验室,济南 250013;3.吉林大学,长春 130021)
0 引 言
威海市属资源型缺水城市,海水入侵问题突出,制约着威海市经济社会的可持续发展。为解决这一问题,威海市利用雨洪资源高效利用及地表地下联合调控技术有效增加了地下水资源量,并防止海水入侵。地下水人工回灌技术是将回灌水源补给地下含水层的过程,在实现增加地下水资源量[1]、控制地面沉降[2,3]和海水入侵[4,5]等环境地质问题的同时,可有效实现地表-地下水资源的科学调配和高效利用[6-8]。19世纪初期,英国修建第一个地下水补给工程将河湖淡水补给至格拉斯哥市[9];此后,德国、瑞典、美国等国家开始大量开展地表水补给地下水的研究和实践[10]。20 世纪60年代,上海市采取人工回灌技术防治地下水位下降引起的地面沉降等环境地质问题[11];随后,我国山东、河北等地区开始大量的人工回灌技术研究。
随着人工回灌技术的广泛应用,回灌水源多种多样,包括雨洪资源[12,13]、地表水[14]、再生水[15,16]及自来水[17]等。由于回灌水源与目标含水层地下水存在水质差异,以及回灌过程中与含水层介质之间存在复杂的水文地球化学过程[8,18,19],对地下水环境质量安全产生影响[20,21]。因此,查明不同水源人工回灌地下过程中地下水化学演化特征尤为重要。国外开展人工回灌过程中地下水水化学组分变化规律研究起步较早,澳大利亚Bolivar 地区利用同位素示踪剂定量评价回灌水源与地下水的混合程度及发生的水文地球化学作用[22];Herczeg 等[23]在澳大利亚某ASR试验场地以雨洪资源为回灌水源开展为期5年ASR试点研究,结果表明雨洪水回补灰岩含水层过程中发生CO2和碳酸盐矿物溶解作用及硫酸盐矿物氧化作用,引起地下水中
Ca2+、Mg2+、HCO-、SO42-浓度变化;同时,大量研究表明人工回灌过程中介质中的F、Pb、Ba、As 等元素出现不同程度的溶出[19,24,25]。我国在人工回灌技术对地下水环境影响方面的研究多集中在室内物理实验和模拟研究,杜新强等[26]采用地球化学模拟方法,在上海市开展自来水人工回灌防治地面沉降中发现,地下水TDS降低,但Fe、Mn有机组分等浓度增大[27]。
目前,国内外开展的人工回灌对地下水环境影响的研究多集中在雨洪资源、河水、湖水等常规水源的人工回灌工程,而再生水等非常规水源具有较大的潜力[28,29]。基于回灌水源的多样性,为了防止回灌水源中潜在微生物等污染物进入地下水环境,回灌到目标含水层前应进行消毒处理[30]。但是,已有研究无法有效评估氯化消毒水源回补地下水化学特征,尤其是场地尺度上针对氯化消毒水体回补地下水对地下水环境的影响研究相对较少,亟需开展进一步研究。本文以氯化消毒的乳山河水作为回灌水源,选择乳山河地下水库为研究区,利用乳山河地下水库人工回灌试验场地开展地下水环境要素、水化学特征动态监测,分析氯化消毒水源回补地下水过程中回灌水源和回灌条件对地下水水化学特征的影响及伴随的水文地球化学作用,为人工回灌工程的开展提供科学参考。
1 材料与方法
1.1 研究区概况
乳山河地下水库位于乳山河干流与司马庄河上,属低山丘陵区,地势由北向南台阶式下降(图1)。地貌上属于鲁东剥蚀构造为主的低山丘陵区。区域内地表出露地层为第四系松散堆积地层,岩性一般以砾石、粗砂、中细砂、壤土为主。在入海口处,岩性主要为淤泥质黏土、中细砂等。第四系孔隙潜水含水层组是本次研究的目标含水层,本地地下水天然流场为由西北向东南,主要接受大气降水补给、侧向径流及河道渗漏补给,主要排泄方式为人工开采。
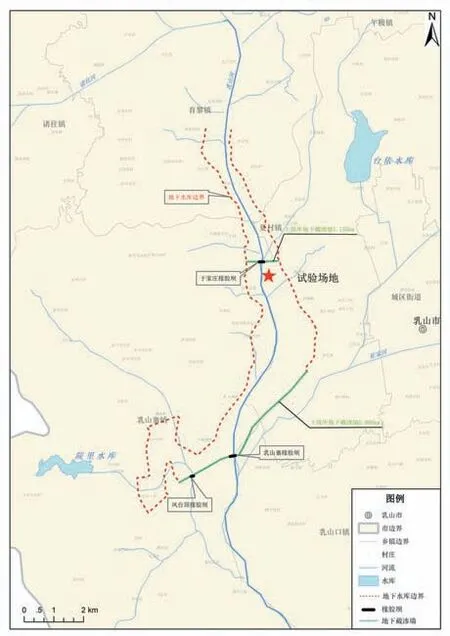
图1 地下水库位置及工程布局图Fig.1 Location and layout of study area
乳山河地下水库工程分为上级库工程与下级库工程,上级库工程包括上级库地下截渗墙、于家庄橡胶坝工程及管理设施工程;下级库工程包括下级库地下截渗墙、乳山寨橡胶坝、凤台顶橡胶坝。
1.2 试验场地概况
试验场地位于位于乳山河地下水库的上级库,于家庄橡胶坝南侧,乳山河东侧30 m。场地内建有试验井16 眼(图2),井深为9.0~11.2 m,揭穿第四系潜水含水层,成井位置的统一有效保证了监测层位的一致性。对目标含水层的含水介质进行粒径级配等主要理化性质测试,结果表明目标含水层主要为细砂和中砂,含水介质的主要理化性质见表1。通过X 射线荧光光谱分析确定主要矿物成分为石英、钠长石、钙长石和钾长石等,此外还有白云石、方解石和高岭石。
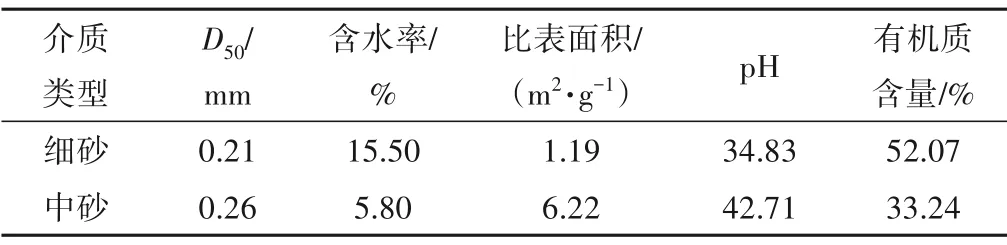
表1 含水介质的主要理化性质Tab.1 The main physical and chemical properties of media
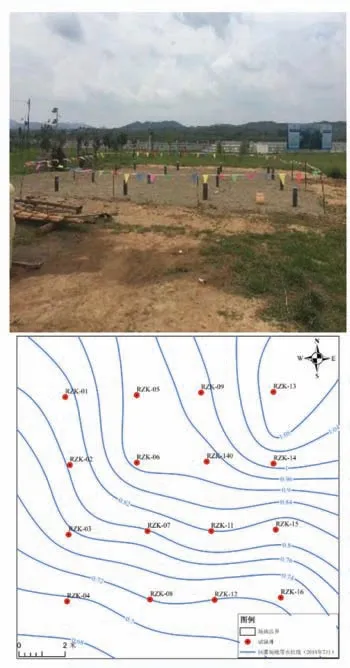
图2 人工回灌试验场地试验井分布图Fig.2 Distribution of test well in recharge site
1.3 回灌水源和原生地下水化学特征
此次回灌水源为氯化消毒的乳山河河水,即加入NaClO 溶液调节有效氯浓度至5 mg/L。河水、回灌水源、原生地下水的水环境要素见表2。河水、原生地下水pH 值分别为7.54、7.79,为弱碱性,电导率和TDS 值相近;地下水受好氧微生物作用影响使DO、Eh值较低,属还原环境。回灌水源中NaClO 的水解作用形成OH-和Na+,使得pH 值增加至8.45,且电导率和TDS值增大,高于地下水;NaClO 的加入使好氧微生物的生长受到抑制,且空气中DO 不断进入回灌水源中使DO 增加至8.5,氧化性增强。
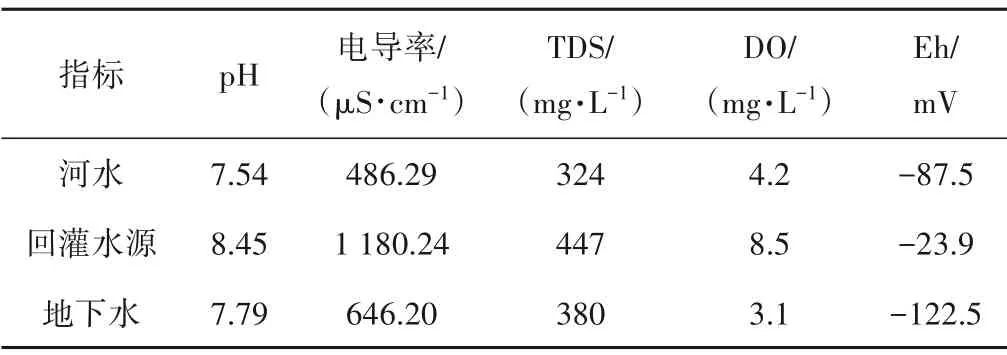
表2 试验场地各水体环境要素特征Tab.2 Characteristics of water environment elements in the test site
试验场地各水体水化学指标如表3 所示;并绘制试验场地各水体水化学性质Piper 图(图3)。河水的水化学类型为Cl·SO4-Na 型水,氯化消毒后的回灌水源为Cl-Na 型水;原生地下水水化学类型为Cl·HCO3-Na型水。
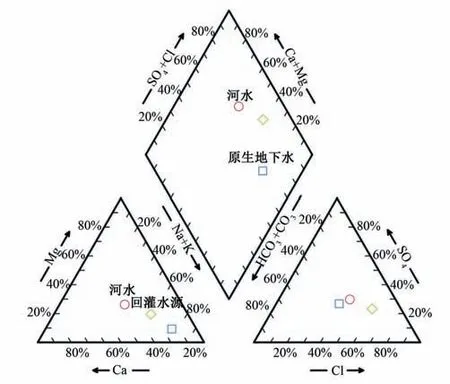
图3 不同水体水化学性质Piper图Fig.3 Piper diagram of hydrochemical properties of different water
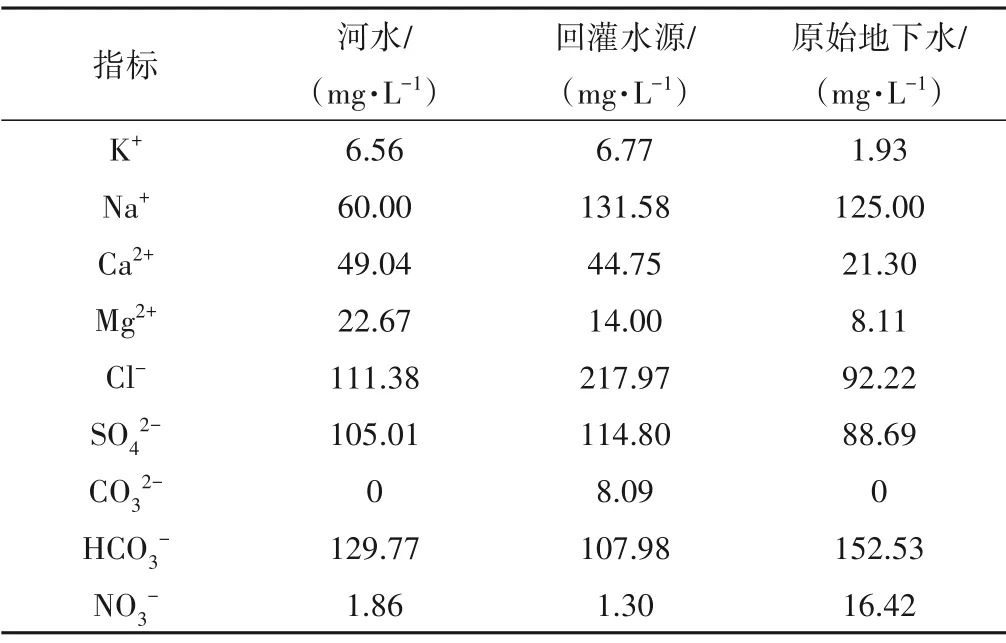
表3 试验场地各水体水化学指标Tab.3 The hydrochemical indexes in the test site
1.4 试验方案
2019年7月4-5日,在乳山河地下水库试验场地开展单井回灌试验。试验以RZK-07 为回灌井,分别在河道方向(RZK 05、RZK 06、RZK08)、垂直河道方向(RZK-03、RZK-11、RZK-15)和地下水流方向(RZK- 04、RZK- 10、RZK-13)设3 个监测剖面共9 个监测井,利用流量为2 m3/h 的潜水泵将配置好的回灌水源经回灌井连续注入到目标含水层,注水历时为170 min,总补水量为5.67 m3。受回灌时长的限制,本次选择水化学特征变化明显的RZK-03、RZK-04、RZK-06 和RZK-08 监测井地下水特征进行重点分析。
为分析氯化消毒水源回灌过程中地下水化学特征,以回灌起始时刻为起点,按照先密后疏原则,现场测定主要监测井中地下水环境要素:pH、电导率、TDS、DO、Eh;此外,在回灌试验的前期(0 min)、中期(170 min)后期(1 980 min)取RZK-04监测井地下水样品至实验室测定主要阴、阳离子(Na+、K+、Ca2+、Mg2+、Cl-、SO42-、NO3-、HCO3-、CO32-)和重金属(总Fe、Fe2+)的质量浓度。
2 结果与分析
2.1 地下水环境要素变化特征
(1)电导率和TDS 变化特征。氯化回灌水源回灌过程中电导率和TDS随时间变化曲线如图4所示。原生地下水的电导率和TDS 值分别为646 μS/cm 和380 mg/L,回灌水源的电导率(1 180 μS/cm)和TDS值(447 mg/L)明显高于原生地下水。随着回灌水源的注入,各监测井中电导率和TDS 值逐渐增大,电导率峰值分别为746 μS/cm(RZK-03)、884 μS/cm(RZK-04)、720 μS/cm(RZK-06)和760 μS/cm(RZK-08),TDS 峰值分别为439 mg/L(RZK-03)、520 mg/L(RZK-04)、423 mg/L(RZK-06)和428 mg/L(RZK-08),随后逐渐减小至稳定值,但RZK-03、RZK-04监测井电导率和TDS 稳定值约为720 μS/cm 和404 mg/L,仍高于原生地下水背景值。
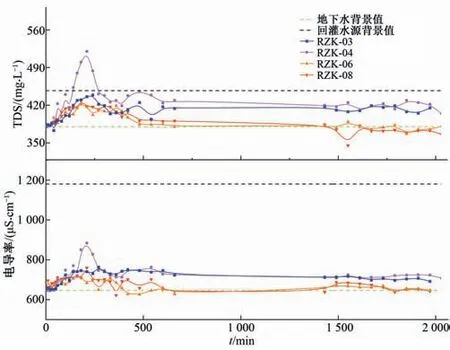
图4 电导率、TDS随时间变化曲线Fig.4 Variation curve of conductivity and TDS with time
这一变化规律主要受混合作用的影响,本次利用RZK-04监测井TDS 的变化特征分析回灌水源与地下水的混合程度随时间的变化。混合比f(t)是指回灌过程中t时刻通过保守离子确定水样中回灌水源所占的比例,其计算公式为:
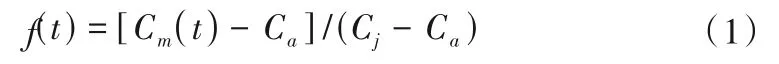
式中:Cm(t)为t时刻地下水中示踪剂浓度,mg/L;Ca为原生地下水中溶质浓度,mg/L;Cj为回灌水源中示踪剂浓度,mg/L。
回灌水源与地下水的混合程度同样呈增大-减小-趋于稳定的趋势(图5),其中地下水主流向的RZK-04监测井的混合程度较高,最大混合比为52.6%,混合作用发生的程度较高,RZK-03 监测井次之(22.2%),RZK-06 和RZK-08 监测井的最大混合比仅为16.2%和18.0%。RZK-03、RZK-04 监测井混合比稳定后分别为13.2%和15.7%,表明除混合作用外,还存在其他水-岩作用影响。
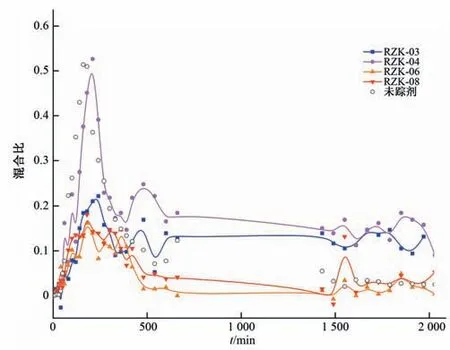
图5 各监测井地下水中回灌水源所占比例随时间变化曲线Fig.5 Variation curve of the proportion of recharge water in the groundwater of each monitoring well with time
(2)氧化还原环境(DO 和Eh)。试验场地地下水处于还原环境,回灌水源中DO 和Eh 值明显高于地下水,因此人工回灌过程中地下水氧化还原环境发生变化(图6)。从DO 随时间变化曲线可以看出,氯化消毒水源注入后地下水DO 逐渐增大,RZK-04监测井在50 min 达到最大值5.9 mg/L,较TDS 达到峰值的时间明显提前,试验进行到80 min 时DO 值开始下降。与电导率和TDS 值变化规律对比发现,如果仅存在混合作用,利用DO 计算混合比为51.8%和62.9%,均低于TDS 计算的最大混合比,表明该过程中存在微生物降解作用消耗水中DO[31]。Eh 值可以反映地下水中溶质表现出的氧化还原性,其变化规律与DO 基本一致,随着氯化消毒水源的注入,各监测井中地下水回灌水源所占比例逐渐增大,Eh 值逐渐上升,50 min 时达到最大值-46.4 mV。因此,该过程中以O2为电子受体的需氧菌和兼性厌氧菌的有氧代谢能力增强,厌氧微生物的生长受到一定程度的抑制。
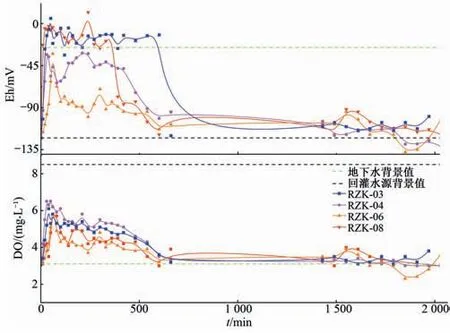
图6 DO、Eh值随时间变化曲线Fig.6 Variation curve of DO and Eh with time
(3)pH 值。从图7 可以看出,地下水pH 值随着氯化消毒水源的注入呈上升趋势,其中RZK-04 监测井pH 值在210 min 达到最大值8.6,RZK-03、RZK-06 和RZK-08 最大值分别为8.4、8.3、8.3,随后呈下降趋势。这是由于氯化消毒回灌水源pH 值高于地下水pH 背景值,混合作用导致pH 增加。其中地下水流方向上的RZK-04监测井pH 值上升趋势最大,主要是由于地下水水流方向上地下水中回灌水源与地下水混合程度最大。此外,试验过程中地下水中pH 最高值高于回灌水源,这是由于回灌水源中NaClO 的水解作用影响地下水中HClO 和ClO-所占比例(式2),HClO 具有强氧化性,与地下水中有机物等反应,NaClO 的水解作用向右进行,使得地下水中pH 值进一步升高。pH 达到峰值的时间出现滞后效应,且试验后期出现pH 值低于原生地下水pH 值的趋势,主要是由于地下水氧化性增强,黄铁矿(FsS2)被氧化形成H+(式2),导致pH值下降[32]。
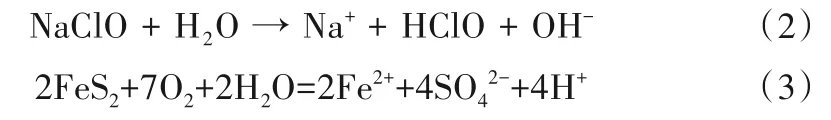
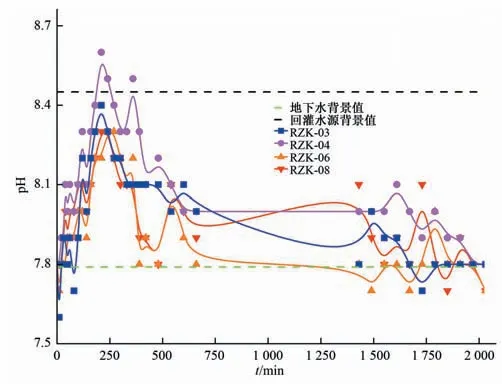
图7 pH值随时间变化曲线Fig.7 Variation curve of pH with time
2.2 回灌水源与地下水的混合作用分析
根据RZK-04监测井地下水和回灌水源样品中各化学组分随时间变化特征绘制半对数Schoeller 图(图8)。从图8 中可以看出,原生地下水(回灌前)化学组分与回灌水源有明显差异,在回灌中期(170 min)时,RZK-04 监测井地下水的大部分组分(除HCO3-外)微小差别外,与回灌水源具有相似的趋势,表明地下水化学变化特征受到了混合作用的影响,向回灌水源和原生地下水体中间移动。回灌过程中HCO3-浓度与地下水相近,回灌后高于地下水中HCO3-浓度,说明回灌水源中余氯发生水解作用形成HCO3-是主要原因,且该过程不是瞬时完成的。此外,回灌水源注入后阳离子浓度增大,其中Na+浓度高于回灌水源,表明该过程还存在着水-岩作用。
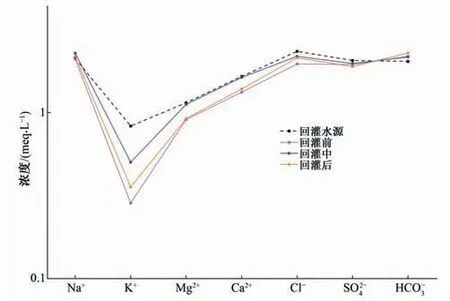
图8 RZK-04监测井地下水Schoeller图Fig.8 Schoeller map of groundwater in RZK-04 monitoring well
2.3 回灌过程中的水-岩作用分析
回灌水源的注入除了与周围地下水发生混合作用外,还受到溶液-含水层矿物相互作用的影响。根据Cl-质量平衡确定地下水与回灌水源的混合程度[33],在此基础上计算其他离子的净增量,分析氯化消毒水源回灌过程中矿物-溶液的相互作用对各离子浓度的影响,计算结果如表4所示。
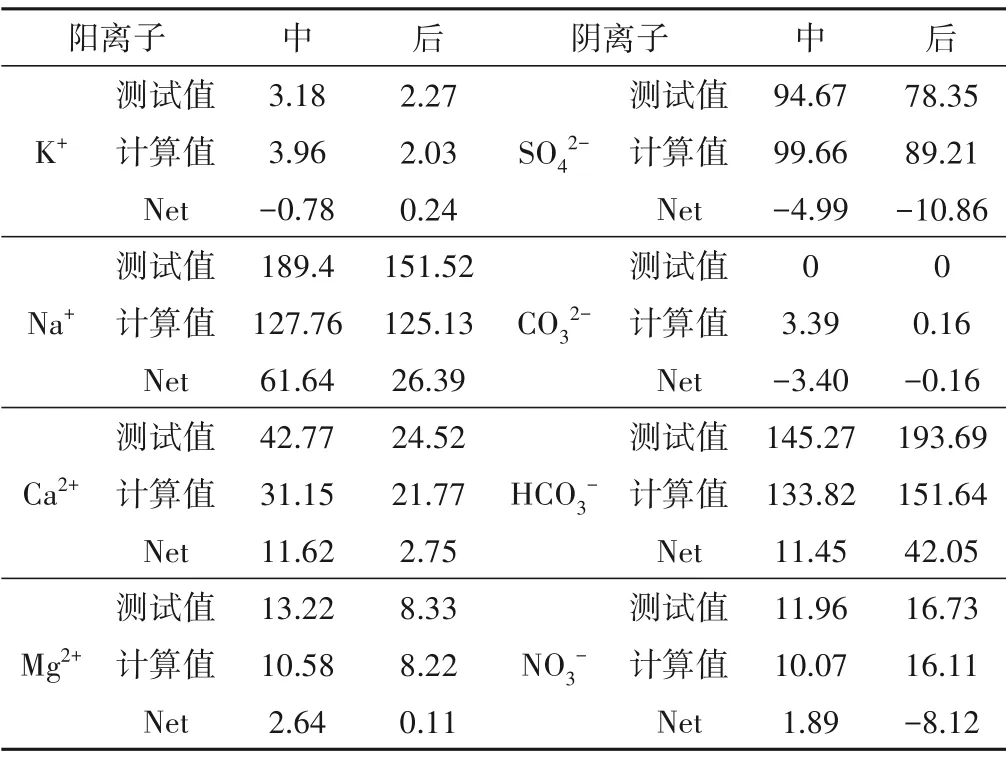
表4 地下水中各离子净增量计算结果 mg/LTab.4 The net increment of each ion in groundwater
在回灌中期(170 min),RZK-04监测井地下水中Na+浓度从60 mg/L 增加至189 mg/L,且地下水中Na+浓度高于回灌水源,Net 为61.6 mg/L。含水层介质中的含Na 矿物主要为钠长石,属硅酸盐矿物,在本次试验的时间尺度内溶解作用较弱,因此除混合作用外,还受回灌水源通过含水层介质时的阳离子交换作用影响。
由于回灌水源与地下水中阳离子浓度差大小顺序为:Ca2+>Na+>Mg2+>K+,Vandenbohede 等人研究表明高浓度差促进Ca2+向吸附方向发生阳离子交换作用[34],但Net 值仅为11.62 mg/L,这是由于含水层介质中的方解石溶解作用,Ca2+浓度的增大伴随着HCO3-浓度的升高,HCO3-的Net 为11.45,且试验结束时浓度高于原生地下水,进一步说明CaCO3溶解作用的存在。
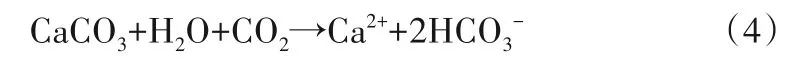
此外,K+浓度降低,Net为-0.62 mg/L 也进一步证明了阳离子交换作用的存在。Ca2+和Mg2+浓度接近回灌水源中的浓度值,Net分别为11.62 和2.64 mg/L,这是由于在回灌过程中,回灌水源通过含水层介质时发生可溶性矿物的溶解作用使得浓度升高。与已有研究结果不同[35],SO42-浓度最终小于原生地下水和回灌水中SO42-浓度,这是由于氯化消毒水源的注入改变了地下水中原有的微生物群落结果,SO42-等作为电子受体参与降解作用[36]。
2.4 典型金属浓度变化特征(Fe、Mn)
由于含水层中Fe、Mn 丰度较高,本次对RZK-04 监测井地下水中总Fe、Fe2+和总Mn 的浓度变化进行分析,浓度变化曲线如图9 所示。回灌水源与原生地下水中总Fe 浓度均为0.03 mg/L,试验中期(170 min)地下水中总Fe浓度增大至0.062 mg/L,同时地下水中Fe2+浓度由0 mg/L增大至0.014 mg/L,这是由于含铁矿物的溶出,根据回灌过程中DO 浓度的增大和pH 值低于原生地下水的变化趋势,进一步说明了该过程中介质中FeS2氧化作用的存在[式(2)],使得总Fe、Fe2+浓度增大,pH值降低。但Fe2+浓度的增加值低于总Fe的降低值,说明回灌水源注入后氧化还原电位升高使得Fe2+转化成Fe3+。地下水中总Mn 浓度为0.011 mg/L,而回灌水源为0.004 mg/L。试验中期(170 min)地下水中总Mn浓度下降至0.004 mg/L,试验后期(1 980 min)出现增大趋势(0.08 mg/L),说明存在硫锰矿(MnS)的溶出作用[式(5)],但总Mn 浓度的增大存在滞后效应,这是由于含锰矿物的溶出需要更多的反应时间[37]。
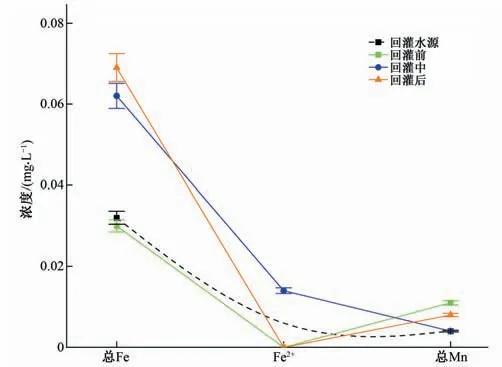
图9 RZK-04监测井重金属浓度变化曲线Fig.9 Heavy metal concentration curve of RZK-04 monitoring well
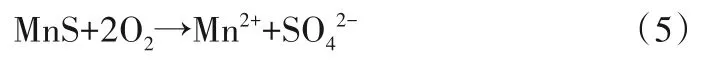
已有研究表明,地下含水层氧化性增强条件下易发生总Fe、总Mn 的溶出[35]。氯化消毒的回灌水源对好氧微生物的影响使其氧化性增强,因此回灌水源进行氯化消毒后地下水中Fe、Mn元素的浓度应重点关注。
3 结 论
试验场地开展的人工回灌试验,通过对氯化消毒水源回灌地下水过程中地下水环境要素(电导率、TDS、DO、Eh和pH)、主要阴、阳离子及重金属(总Fe、总Mn)等指标的测试分析,得出以下主要结论。
(1)回灌水源注入后,与原生地下水发生混合作用,地下水主流方向受回灌作用影响较大,大部分组分与回灌水源具有相似的趋势,最大混合比为52.6%;
(2)存在水-岩相互作用,K+、Ca2+、Mg2+的Net 值分别为-0.78、11.62、2.64 mg/L,即方解石的溶解作用使Ca2+、Mg2+浓度增大;次氯酸钠的加入易于发生阳离子交换作用,使K+浓度降低;
(3)从试验结果来看,氯化消毒水源人工回灌过程中地下环境氧化性增强,促进含Fe、Mn 矿物溶出,同时地下水pH 值降低;
(4)与常规水源相比,氯化消毒水源注入后影响地下水微生物群落结构,使SO42-等离子作为电子受体被消耗,浓度降低。

