磁性金属-有机骨架材料在污水处理中的应用
时欣,王悦,邓鸣,李开昌,汤立红*
(1. 云南大学化学科学与工程学院,云南昆明650091;2. 临翔区博尚镇那招学区,云南临沧677008)
近年来,随着我国科技和工业的飞速发展,水体污染日益严峻并呈现出多样化复杂化的趋势,这已经严重影响了我国实施可持续发展战略和青山绿水建设生态文明社会的步伐。因此,开发高效、节能、绿色、可循环再利用的水处理技术已经迫在眉睫。目前,我国水体污染呈现多样化、复杂化,主要体现在污染物不仅包含重金属,而且还有各种有机污染物。水体中重金属的存在会导致人体器官发生病变,有研究表明长期接触无机砷会导致肺癌、膀胱癌、肾癌和皮肤癌,甚至死亡[1]。各种有机物(如染料、农药、药品和个人护理产品等)也会对水生环境和人类健康造成危害,而且它们大多是有致癌性和毒性的。目前,国际上已经有很多种治理和修复水体的方法,如氧化、沉淀、膜分离、光催化、吸附等[2]。其中吸附法因具有高效低能耗、简便、应用范围广等优点引起了广泛关注[3]。但如果吸附剂要在工业上大规模使用,那么材料的分离和回收再利用是必须考虑的一个重要问题。因此,开发可高效绿色处理污水的新型吸附材料,必将会是未来研究的重要方向和热点课题。
金属-有机骨架(Metal-Organic Frameworks,MOFs)材料是由金属离子或金属簇和有机配体在一定的温度和压力条件下,通过自组装配位形成的多孔晶体材料[4]。与传统的多孔材料相比,MOFs材料具有比表面积大、孔隙率超高、孔径可调、合成后可改性、热稳定性高等优点[5],在气体存储[6]、催化[7]、分离[8]、传感[9]、吸附[10]等方面得到了广泛应用。但MOFs 材料在污水治理的应用中同样存在一些问题,如水稳定性较差、机械强度不高和不易回收再利用等[11],这些问题的出现都可能造成二次污染和资源浪费。近年来兴起的磁性复合金属有机骨架(Magnetic-metalorganic frameworks,MMOFs)吸附剂材料是最有潜力解决以上问题的关键,它是由MOFs 材料和磁性材料组合而成的,磁性材料主要包括Fe3O4、γ-Fe2O3、Fe、NiO、Co3O4及MFe2O4(M=Mn、Co、Ni)等,其中以Fe3O4作为磁性基体的实例最为常见[12]。MMOFs 复合材料既保留了MOFs的结构与性能特征,又为复合材料增添了强磁性能,在污水处理方面得到了广泛的应用[13]。与传统多孔材料相比,MMOFs 吸附剂材料具有更大的比表面积、更高的孔隙率、更加多样的结构功能及可多次重复利用等优点。
首先总结了几种常见的制备MMOFs 材料的方法,随后阐述了MMOFs 材料对污水中几种典型重金属和有机污染物的治理应用,最后对MMOFs 材料的研究热点作了展望。
1 MMOFs 材料的制备方法
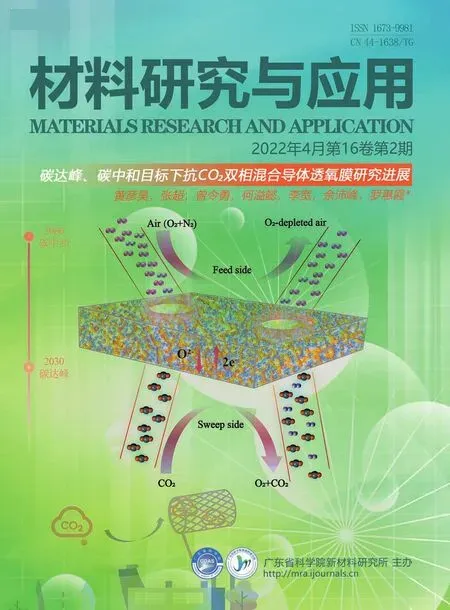
MMOFs 材料是把不同类型的MOFs 材料和各种磁性纳米粒子(合金、铁酸盐、纯金属和金属氧化物等)组装在一起,使MOFs 材料可以生长或附着在这样的功能颗粒或纤维上,以此来提高材料的性能。根据合成过程中磁性粒子和MOFs 材料之间的相互作用,可以确定主要的合成方法有嵌入法、叠层法、封装法和混合法,MMOFs 合成的不同方法如图1所示[14]。
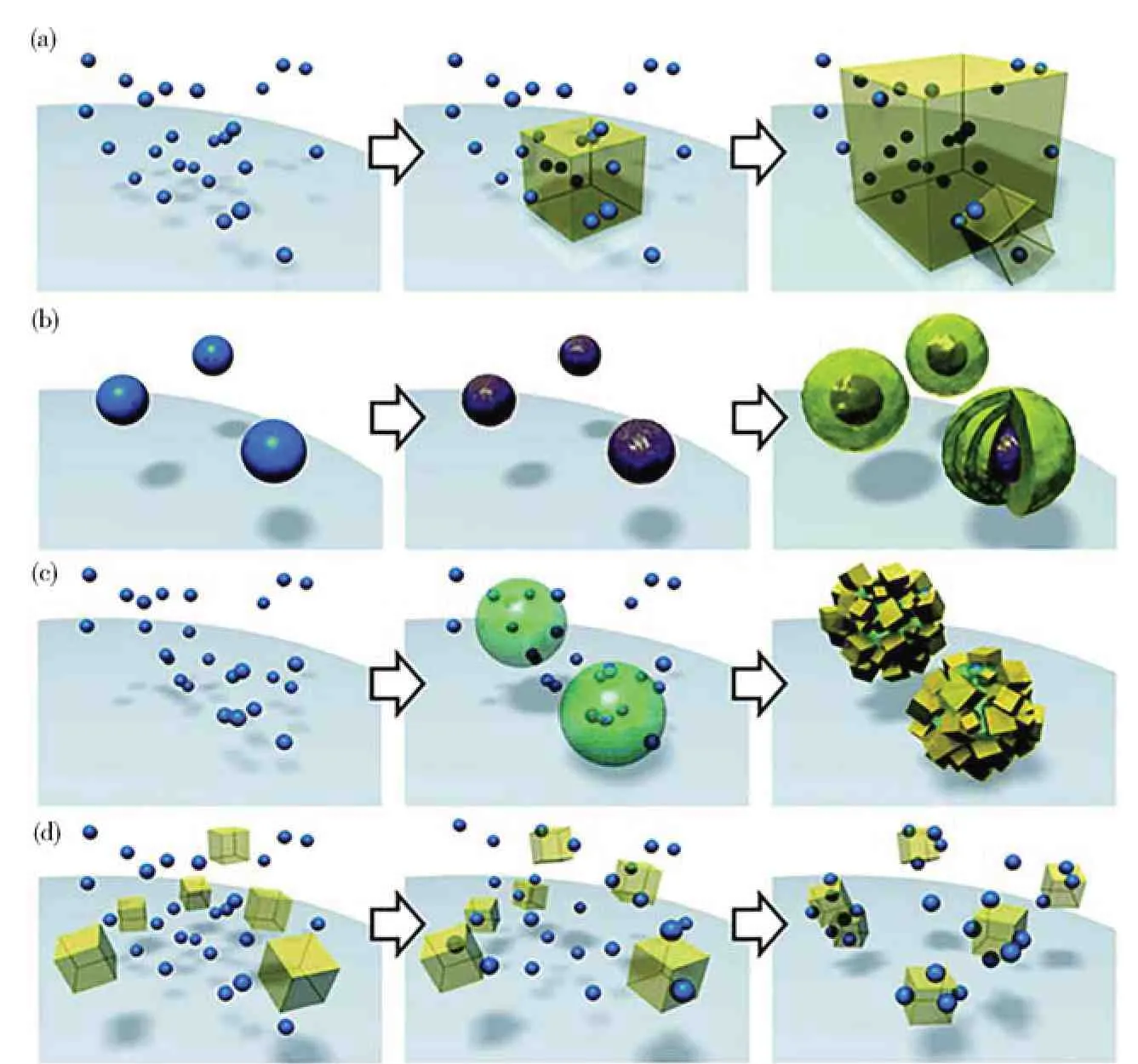
图1 MMOFs 合成的不同方法[14]Fig.1 Different approaches for the design of magnetic framework composites
1.1 嵌入法
嵌入法,顾名思义就是将磁性颗粒材料嵌入到MOFs 材料的表面。通常,当使用嵌入法制备MMOFs 时,需要将磁性颗粒放置在MOFs 的成核和生长混合液中,然后通过超声或水热条件将磁性颗粒嵌入到所形成的MOFs 中。用嵌入法合成的MMOFs 材料的结构与MOFs 基本相似,制备步骤相对简单,适用于大多数MOFs 的磁化。但是,嵌入法也存在一定的局限性,比如MOFs 在溶液中容易直接成核和生长,部分磁性颗粒嵌入到MOFs 的孔隙中,会导致比表面积减小。
Pang 等[15]以纳米Fe3O4为磁核,通过2-甲基咪唑与硝酸锌的室温反应合成了Fe3O4/ZIF-8 纳米粒子。Fe3O4/ZIF-8 纳米粒子的生长可以认为是1 个由带正电的ZIF-8 粒子和带负电的Fe3O4纳米晶之间的静电吸引驱动的磁性纳米晶嵌入到在ZIF-8 纳米粒子的过程,如图2 所示。
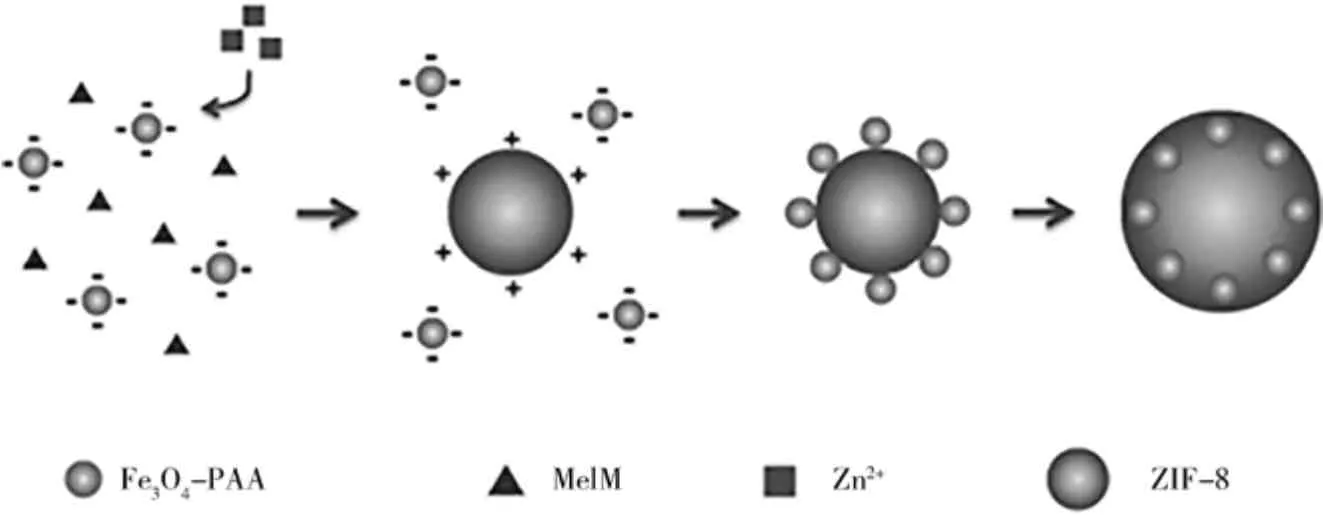
图2 Fe3O4/ZIF-8 颗粒形成机理示意图(PAA=聚丙烯酸)[15]Fig.2 Schematic diagram of the formation mechanism of Fe3O4/ZIF-8 particles(PAA=polyacrylic acid)
1.2 叠层法
叠层法是将MOFs 层覆盖和叠加生长在官能化磁性颗粒表面,MOFs 通过液相外延法在磁性颗粒表面层叠生长,最终形成具有核壳结构的MMOFs材料。在这种纳米复合材料中,MOFs 通过重复的液相外延过程逐层生长,生成的材料可以保持原始磁性颗粒的形状。磁性颗粒表面官能团的修饰有利于控制晶体的生长,提高MMOFs 材料的稳定性,保证核壳结构的形成,重复的次数决定了MOFs 涂层的厚度。这种方法最适合用于合成复杂的MMOFs复合材料,可以精确控制MOFs 外壳的厚度,制备过程简单,在室温下即可进行,美中不足的是,它的制备时间过长,可以满足要求的MOFs 配体种类也很有限。
磁性HKUST-1 最常用的合成方法就是叠层法。Liu 等[16]提出了一条全新的合成路线来制备新的杂化Fe3O4@MOF 材料Fe3O4@HKUST-1/MIL-100(Fe),这种杂化材料的制备方法如图3 所示。首先采用前人报道的方法制备了Fe3O4微粒,然后利用叠层法在Fe3O4微粒上生长了多层MOFs。其中第1 层代表一层MIL-100(Fe)夹着一层HKUST-1,即 HKUST-1/MIL-100(Fe)/HKUST-1/MIL-100(Fe);第2 层代表两个连续的MIL100(Fe)层,中间夹着两个连续的HKUST-1 层,即HKUST-1/HKUST-1/MIL-100(Fe)/MIL-100(Fe),依此类推。该材料对亚甲基蓝的去除效果与Fe3O4@MIL-100(Fe)相当,但层数只有Fe3O4@MIL-100(Fe)的一半。
图3 Fe3O4@HKUST-1/MIL-100(Fe)制备示意图[16]Fig. 3 Schematic illustration of the preparation of Fe3O4@HKUST-1/MIL-100(Fe)
1.3 封装法
封装法是利用MOFs 材料与磁性颗粒之间的缓冲界面,促使MOFs 围绕磁性颗粒在其周围生长从而制备MMOFs 材料(图1(c))。为了改善MMOFs材料的相容性,磁性颗粒需要预先嵌入到聚合物层中,然后添加到MOFs 的成核和生长混合液中。该方法通常用于合成以磁性颗粒为核心的复合材料,合成步骤简单、可调控性强,但MOFs 生长的均匀性很难控制。
Zhang 等[17]提出了一种制备Fe3O4@ZIF-8 磁性核壳微球的简便方法,制备过程如图4 所示。该过程首先用阴离子聚电解质对磁芯进行预处理,改变颗粒的表面电荷,并吸附Zn2+引发成核,然后生长一层薄薄的ZIF-8,形成高活性的磁性核壳微球(Fe3O4@ZIF-8),制备Fe3O4@ZIF-8 核壳微球的关键是在Fe3O4微球表面形成连续均匀的ZIF-8 壳层。作为催化剂的Fe3O4@ZIF-8 微球在外加磁场的作用下可以很容易地装入或卸载进出毛细管微反应器,该微反应器在较短的停留时间内对苯甲醛和氰乙酸乙酯的Knoevenagel 缩合反应表现出良好的催化活性。
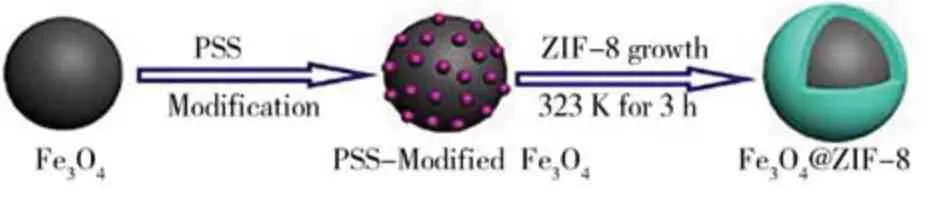
图4 Fe3O4@ZIF-8 核壳微球的制备工艺[17]Fig.4 Preparation procedure of Fe3O4@ZIF-8 coreshell microsphere
1.4 混合法
混合法是将预先制备的磁性颗粒和MOFs 材料混合均匀后,通过超声或高温聚合作用制备MMOFs 材料(图1(d))。由于静电相互作用或化学键的作用,附着在MOFs 的外表面的磁性颗粒可以通过外部磁铁的作用从样品的基质中回收。该方法的关键是控制MOFs 与磁性材料之间的相互作用,以确保持久的粘合性能,其中静电相互作用是混合法制备MMOFs 材料的重要条件。到目前为止,混合法都是制备MMOFs 复合材料最简单的方法之一,几乎可以适用于任何MOFs。但它对MOFs 材料量的需求过大,会增加MMOFs 材料的生产成本。
Hu 等[18]报道了一种通过化学键组装合成新型磁性MOF-5 的简便有效的方法,即用氨基对Fe3O4纳米粒子进行官能化,然后将其化学键合到MOF-5晶体表面,如图5 所示。氨基功能化的Fe3O4纳米粒子与金属有机骨架表面之间建立了共价键,提高了杂化微晶的化学稳定性和结构均匀性。MOF-5 与Fe3O4纳米颗粒的结合,使得多孔材料可以通过磁沉降轻松地提取出来。最后,将这4 种制备方法的优缺点做了对比,比较结果列于表1。

图5 混合磁性MOF-5 的制造工艺示意图[18]Fig. 5 Schematic diagram of the fabrication processes of hybrid magnetic MOF-5

表1 MMOFs 的4 种制备方法优缺点比较Table1 Comparison of advantages and disadvantages of four preparation methods of MMOFs
2 MMOFs 材料在污水处理方面的应用
水体中的污染物主要分为无机污染物和有机污染物两大类,无机污染物主要为有毒的金属离子,有机污染物主要包括染料、农药、药品、个人护理产品、酚类等。这些污染物大都具有持久性,不仅会污染环境,而且还会通过食物链最终进入人体,对人体健康造成伤害。MMOFs 材料属于磁性吸附剂材料,兼具MOFs 和磁分离技术的优点,更有利于去除水体中的污染物。目前,磁性吸附剂材料正逐渐成为解决全球性水体污染和可持续环境应用的一个关键因素。该材料主要通过静电吸引、π-π 键堆积作用、疏水作用和氢键作用等机理吸附去除水体中的污染物[26]。
2.1 MMOFs 材料对污水中重金属的处理
污水中常见的重金属离子主要包括砷、铜、铬、铅、汞、镍、钴等,这些离子大多具有毒性或致癌性,对人类和其他生物构成了很大的威胁。为了改善生存环境,人们开发了化学沉淀法、离子交换法、膜过滤法和吸附法等多种技术来处理污水中的重金属。传统的处理方法是化学沉淀法,其工艺简单,成本低廉。但通常只适用于处理重金属离子浓度较高的污水,浓度较低时化学沉淀法效果较差,并且仅仅是将液相重金属污染转化为固相污染,没有将重金属的污染彻底根治,而且重金属也不能被回收再利用[27]。离子交换技术已广泛应用于污水中重金属的去除,但离子交换树脂用完后必须借助化学试剂进行再生,再生容易造成二次污染且造价昂贵,特别是在处理含大量低浓度的重金属污水时,不能大规模使用[28]。不同类型的膜过滤技术以其高效、易操作、节省空间等优点,在重金属去除方面显示出巨大的前景,但其成本过于昂贵、工艺复杂、膜污染、渗透通量低等问题限制了其在重金属去除中的应用[29]。吸附法是目前公认的一种有效、经济的处理方法,吸附过程在设计和操作上具有灵活性,由于吸附有时是可逆的,吸附剂可以通过适当的解吸过程再生。MMOFs 材料作为众多吸附剂中的一种,由于其良好的性能(如高表面积、良好的吸收性、可再回收或再生、易分离等独特优势)在去除污水中的重金属方面具有广阔的应用前景。
2.1.1 MMOFs 材料对污水中Hg(II)的处理
汞主要以元素汞(Hg0)、离子汞(Hg+和Hg2+)、有机汞等形式存在,它可以通过水、土壤和天然气在全球范围内传播,甚至可以通过食物链进入生物界。因此,有效去除水环境中的汞离子具有重要意义。对于吸附法来说,吸附剂的选择尤为重要,根据软硬酸碱理论,软碱对软酸通常具有很高的亲和力[30]。巯基作为软碱,更容易与软酸Hg(II)相互作用,具有较高的吸附能力、吸附速率和抗干扰性[31]。基于这个理论,Huang 等[19]利用柔性协调合成后修改策略研究了以苯三羧酸和巯基为配体的MMOFs 材料(Fe3O4@SiO2@HKUST-1)。该材料是以Cu(OH)2壳层为铜源、苯三羧酸为有机配体,采用自模板合成法在室温下合成的,并成功地应用于污水中Hg2+的选择性去除上。在此基础上,他们通过相同的方法制备了铋试剂I(bismuthiol I,Bi-I)功能化的磁性HKUST-1 复合材料,并系统地研究了Fe3O4@SiO2、Fe3O4@SiO2@HKUST-1 和Bi-I 功能化MMOFs 复合材料对Hg2+的吸附性能,研究发现Bi-I 功能化MMOFs 复合材料对Hg2+具有良好的吸附选择性,吸附动力学速度快,吸附容量高达264 mg·g−1。
Mon 等[32]报道了一种新型的水稳定性良好的金属有机骨架{CuⅡ4[(S,S)-Methox]2}·5H2O,其中Methox 为双[(S)-蛋氨酸]草酰二胺。该吸附剂具有硫代烷基链修饰的功能通道,能够高效、选择性和快速地从水介质中捕获HgCl2,将Hg2+的浓度从10−5降低到饮用水的可接受限度。仅仅5 min 便可捕获99.7%的HgCl2,10 min 后HgCl2的浓度已降至2×10−9以下,达到饮用水的允许限度。该材料中修饰孔的硫代烷基团占据特殊位置且硫原子对汞具有强烈的亲和力,使得形成的HgCl2S2加合物具有非常稳定的四面体构象,为良好的选择性和高效性提供了保障。
Yang 等[33]制备了硒功能化金属有机骨架MIL-101(Se/MIL-101)。Se/MIL-101 在15 min 内可使废水中Hg2+浓度从50 μg·L−1下降到5.3 μg·L−1,去除率高达89.4%;1 h 后Hg2+浓度降至ICP-MS 检测不到的水平(小于0.0035 μg·L−1),去除率接近100%。王德超等[34]利用后修饰法合成了巯基功能化金属有机骨架Ni-BDP-SH,结果显示该材料对Hg(II)的最大吸附量达301.92 mg·g−1,短时间内即可达到吸附平衡,并且在弱酸性和中性溶液中对Hg(II)的吸附效果更好。
用于去除Hg(II)的MMOFs 复合材料,大多是由MOFs 和金属氧化物或硫化物组合而获得的。Hg2+的去除效果主要取决于引入的官能团,因此官能团的位置就是Hg2+的吸附位点。对于大多数硫化或氨化的MMOFs 材料来说,引入的官能团存在于MMOFs 的孔隙中,吸附位置也就在MMOFs 的孔隙中。研究表明,Hg(II)不仅可以和硫化配体强烈结合,而且还可以和羧基、酰胺基、羟基等强烈结合。因此,未来可以考虑用这些官能团修饰改性MMOFs 材料,使其达到更好的吸附效果。
2.1.2 MMOFs 材料对污水中Pb(II)的处理
铅是一种难生物降解的危险重金属,经常在采矿、电池制造、汽车汽油燃烧和电镀工业等活动中直接或间接地排放到生态系统中,导致饮用水中铅的浓度超过世界卫生组织制定的限值。富马酸的羧酸基配体属于硬碱,可与硬酸Fe(III)结合配位,形成水稳定性良好的MMOF 材料。基于这个原理,Mahmoud 等[35]组装了一种新型MMOF 材料(nFe3O4@MIL-88A(Fe)),在此基础上利用(3-氨丙基)三乙氧基硅烷对该材料进行化学键合改性,成功地合成了nFe3O4@MIL-88A(Fe)/APTMS 纳米复合材料。在其他背景金属离子存在的情况下,该材料对Pb2+表现出较高的去除效率。当pH>4 时,nFe3O4@MIL88A(Fe)/APTMS 可与阳离子物种或阴离子物种通过离子对引力配位成键,最大吸附量达536.22 mg·g−1,经过5 次循环后吸附率仅下降3%。
Wang 等[36]采用共沉淀法合成了磁性纤维素纳米晶(magnetic cellulose nanocrystals,MCNC),并在温和条件下通过Et3N 催化工艺在MCNC 表面涂覆了Zn-BTC,制备了一种磁性的纤维素MOFs 复合材料MCNC@Zn-BTC。这种MMOFs 吸附剂材料使用5 次后,对Pb(II)的去除率仍保持在80%以上。该研究还考察了MCNC@Zn-BTC 投加量、Pb(II)初始浓度、接触时间、pH 和吸附温度对吸附效果的影响。结果显示,吸附达平衡的时间为30 min,在pH 为5.45 及温度为298.2 K 时,达到最大吸附量558.66 mg·g−1。
Mehdinia 等[37]将磁性纳米Fe3O4加入到配体与无机前驱体MIL-96(Al)的混合溶液中,采用嵌入法在水热条件下合成了Fe3O4/MIL-96(Al),并且将其应用于污水中Pb2+的去除。研究表明,经过2 个循环的萃取和再生,Pb2+的萃取效率良好,最大吸附量大于301 mg·g−1。这可能是吸附剂的阴离子与水合Pb2+离子之间的静电相互作用及该材料表面高比例的―OH 基团,促进了吸附剂对水介质中Pb2+的吸附。杨清香等[38]采用室温搅拌法制备了ZIF-67 材料,研究了该材料对水体中Pb2+的吸附性能。结果显示:该材料对Pb2+的平衡吸附量为779.7 mg·g−1,吸附2 h 后Pb2+的吸附量为673.9 mg·g−1,达到平衡吸附量的86.4%;与已有报道的重金属离子吸附材料相比,ZIF-67 材料对Pb2+表现出优良的吸附性能。
由于大多数MMOFs 材料在水环境中具有明确的表面电荷,因此它们具有吸引带相反电荷的Pb(II)的趋势。MMOFs 材料对重金属Pb(II)的处理,实际上是依靠MMOFs 与Pb(II)之间的相互作用(包括静电相互作用、氢键效应、范德华力等)。此外,利用含有氨基或氨基和羧基的高分子螯合剂(如EDTA)修饰MMOFs 材料同样具有显著的吸附效果。
2.1.3 MMOFs 材料对污水中As(III,V)的处理
砷是一种剧毒的类金属元素,主要以无机含氧阴离子形式存在于天然水中,三价氧化态(As(III))的亚砷酸盐比五价氧化态(As(V))的亚砷酸盐毒性更大、更难去除,因其高毒性和流动性而被列为优先重金属[39]。因此,去除地下水中的砷是一项紧迫的任务。2019 年,Huo 等[40]提出了一种巧妙的溶剂热合成法,通过两步自组装法成功地制备了一种具有独特核壳结构的新型磁性Fe3O4@UiO-66,并将其用于除去水中的砷。该方法首先通过溶剂热反应合成了Fe3O4微球,然后将一定量合成的Fe3O4-COOH均匀地分散在含有锆盐和醋酸的二甲基甲酰胺溶液中。依据静电吸引的相互作用和软硬酸碱理论,Zr4+与表面羧基之间会产生很强的配位作用,Zr4+离子可以吸附到磁芯表面,接着在醋酸的存在下H2BDC 配体的羧基进一步与Zr4+结合形成UiO-66,从而在Fe3O4表面上外延生长UiO-66 晶体。该过程类似于先前报道的核壳结构机理,并且核的表面官能团起着至关重要的作用。该方法避免了用二氧化硅中间层涂覆或通过多巴胺和其他有机基团进行表面改性的需要,这些过程被基于Fe3O4上表面羧基的直接外延生长所取代,而且还可以在Fe3O4的形成过程中实现功能化而无需进行复杂的后修饰。合成后的新型核-壳复合材料具有高比表面积(124.8 m3·g−1)和超顺磁性能(磁化饱和度为26.5 emu·g−1),最大吸附容量达73.2 mg·g−1,可与大多数含MOFs 的吸附剂相媲美,而且还具有较强磁性,可以很容易地将吸附物从水溶液中分离出来。
He 等[41]研究了UiO-66 和UiO-66(NH2)去除As(III,V)的性能。实验结果显示,在pH 为9.2 时,UiO-66 对As(III)和As(V)的去除率分别为205 mg·g−1和68 mg·g−1。经过6 次吸附解吸试验,Zr-MOFs 的吸附性能保持稳定。在固定床反应器去除实验中,该材料对As(III)和As(V)的有效处理体积分别达到2270 和1775 床体积,能够修复100 mg·L−1的污染水,达到规定的标准(小于10 mg/L)。FTIR和XPS 研究表明,Zr-MOFs 中的Zr-OH 基团对砷的吸附起关键作用。
Gu 等[42]提出了一种制备双金属Fe/Mg-MIL-88B 的有效策略,结果显示具有两个活性金属中心的双金属Fe/Mg-MIL-88B 比单金属Fe-MIL-88B的吸附性能更好,对砷酸盐的吸附容量高达303 mg·g−1,具有较快的吸附速率、较宽的pH 工作范围、较强的抗干扰性、优异的再生性和结构稳定性以及良好的循环稳定性等优点。Wang 等[43]报道了一种基于MIL-100(Fe)的高效去除人工地下水中As(III)的过滤器,将MIL-100(Fe)植入商业铁网的基质上,作为一个氧化As(III)和吸附As(V)的双功能系统。在氧气和焦耳加热的辅助下,As(III)可在6 h 内完全去除,良好的结构稳定性和循环利用性能促进了该过滤器在地下水砷污染修复中的应用。
MMOFs 材料对重金属As(III,V)的处理,主要归功于MMOFs 的吸附行为,研究人员已经确定末端羟基在砷络合中起决定性作用,使其形成M-OAs(M 为金属)络合物,从而实现去除效果。此外,引入其他官能团(例如氨基和硫醇基)及MMOFs 与砷物种之间的相互作用(包括静电相互作用、氢键效应、范德华力等)也有助于砷的吸附,后续可以考虑利用这些官能团改性MMOFs 材料而进一步提高它的吸附能力。
2.1.4 MMOFs 材料对污水中Co(II)的处理
重金属离子钴在浓度超标时不仅会引起健康问题(如低血压、瘫痪、腹泻和骨缺陷等),而且还会导致活细胞的基因突变,并且放射性钴(如钴60)也是一种核污染物[44]。但钴又是一种重要的战略金属,即使是含钴废料也是重要的二次资源,我国属于钴资源贫乏的国家,对再生钴资源的回收利用是解决我国钴资源供给的有效途径。因此,水体中钴金属的治理和回收再利用是至关重要的。2018 年,Guo等[45]提出了一种基于金属有机骨架的离子印迹聚合物(Co-IIP)的合成方法,其结合了离子印迹技术的选择性和MOFs 材料的多孔结构,以UiO-66-NH2为载体材料和Co(II)为模板剂,合成了一种新型高效吸附剂Co-IIP,并将Co-IIP 用于选择性去除污水中的Co(II)。该聚合物对Co(II)的饱和吸附量达175 mg·g−1,几乎是目前离子印迹吸附剂对Co(II)的最大吸附量。此外,该催化剂在其他重金属离子存在的情况下依然具有良好的选择性。据我们所知,这是首次将离子印迹技术应用于MOFs 材料,这将为MOFs 材料的功能化开辟一条新的途径。
Guo 等[46]基于金属有机骨架的离子印迹聚合物(Co-IIP)对重金属离子的高选择性,以UiO-66-NH2为载体和葡萄糖为配体,通过合成后修饰技术成功制备了一种新型的葡萄糖官能化的磁性Fe3O4@SiO2@UiO-66-Glu 并用于去除水体中的Co(II)。研究结果表明,Fe3O4@SiO2@UiO-66-Glu 在288、298 及308 K 时的最大吸附容量分别为178.6、222.2 和270.3 mg·g−1,远高于大多数磁性材料对Co(II)的吸附量,并且在使用过程中表现出良好的吸附稳定性,表明该吸附过程的发生主要是由于葡萄糖配体中的氧原子和二氧化硅表面的氧原子参与了配位。
Ghaemy 等[47]以氨基硅烷官能化氧化石墨烯(GO-APTS)和2-丙烯酰胺-2-甲基丙磺酸(AMPS)及马来酸酐(MA)共聚物(AMPS-co-MA)为原料,制备了一种新型磁性纳米复合吸附剂材料GOAPTS-Poly(AMPS-co-MA)/Fe3O4,该材料对Co(II)具有良好的吸附能力,最大吸附量可达238.25 mg·g−1。由于吸附剂之间的静电吸引和氢键作用,吸附过程是有利的、自发的。研究结果表明,该材料具有优异的可重复使用性,易于磁场捕集,性价比高,对水中Co(II)去除性能优异等优点,是一种极具潜力的高效吸附剂。
MMOFs 材料适当的官能化或改性,可以有效改善钴离子的吸附。MMOFs 材料对重金属Co(II)的处理,实际上是利用吸附剂与铅之间的静电吸引和氢键作用或是配体中其他原子参与配位,从而形成吸附容量较高的吸附剂。然后利用磁性材料的快速磁响应实现快速高效吸附Co(II),避免了吸附后的繁琐分离。
2.2 MMOFs 材料对污水中有机物的处理
污水中有机污染物的种类比无机污染物更丰富,包括染料、农药、聚芳烃、农药、药物等[48-49],他们大都是剧毒物质,易导致严重疾病。在有机污染物的处理中,多孔材料吸附和高级氧化工艺降解是目前成本较低且有效的方法。最近的研究显示,具有永久孔隙率和组成可调性的MMOFs 材料是污水中去除有机污染物的吸附剂或催化剂的良好选择[50]。
2.2.1 MMOFs 材料对污水中染料的处理
染料是污水中最常见的有机污染物,主要来自纺织厂、造纸厂和染料制造业,具有化学需氧量高、生物需氧量高、难降解物质多等特点,是国内外难处理的废水之一。据统计[51],每年约有数千吨的有机染料被排放到水中,这些排放的染料不仅会加深水体的色度,影响水体的感官,还会阻碍阳光的透射,消耗水体中的溶解氧,影响水生生物的生长,破坏整个水体的生态系统。目前,许多功能化的MMOFs材料已经被用于降解污水中的染料。
Mahmoodi 等[52]制备了可回收的磁性NH2-CNT/Fe2O3/ZIF-8 纳米复合材料,并将其用于选择性去除阳离子染料(孔雀石绿和罗丹明B),研究表明:NH2-CNT/Fe2O3/ZIF-8 的比表面积(1659 m2·g−1),高于ZIF-8(1485 m2·g−1)的比表面积;吸附过程服从Freundlich 等温线和准二级动力学模型,响应面模型预测的最佳吸附条件为pH=6、染料浓度为25 mg·L−1、用量为0.004 g、吸附时间为145 min。机理研究显示[53],该材料具有较高的吸附能力,主要是由于阳离子染料分子之间的强静电吸引力和ZIF-8的负表面电荷及染料分子的苯环与ZIF-8 的有机配体之间的π—π 堆积作用。
同年,Mahmoodi 等[54]采用一种简便、高效、绿色的超声辅助方法,合成了磁性生物纳米复合材料(ZIF-67@Fe3O4@ESM),并用于吸附去除Cu2+和染料( 碱性红 18) 。 研究结果表明 ,ZIF-67@Fe3O4@ESM 复合材料对上述两种污染物的吸附速率和去除率均高于ZIF-67,对Cu2+及碱性红18 的最大吸附量分别为344.82 和250.81 mg·g−1。合成的ZIF-67@Fe3O4@ESM 复合材料具有同时吸附重金属和染料及吸附剂用量少、吸附速度快等优点,同时复合吸附剂的磁性使其可以很容易地从液体介质中分离出来。Afsoon等[55]将Wells-Dawson 型K6P2W18O62多金属氧酸盐包裹在磁性Fe3O4/MIL-101(Cr)金属-有机骨架中,作为一种新型的磁性可回收三元吸附剂用于去除水溶液中的有机染料。结果表明:该磁性杂化材料具有934.89 m2·g−1的高比表面积,能够快速、选择性地吸附混合染料溶液中的阳离子染料;与MIL-101(Cr)、P2W18O62和Fe3O4/MIL-101(Cr)相比,P2W18O62@Fe3O4/MIL-101(Cr)的吸附速率及吸附容量都有所提高;吸附反应完成后,该材料可以在不改变结构的情况下分离和重复使用。
杨晓涵等[56]利用多巴胺(DA)中的儿茶酚基团能与金属有机骨架晶体中金属离子螯合的原理,制备了磁性Fe3O4@ZIF-67D 新型材料,该材料具有亲水性的表面、纳米级的孔径和良好的磁响应。在最优的萃取和色谱分析条件下,对亚甲基蓝及结晶紫的检出限分别为0.04 和0.008 μg·L−1,线性范围分别为0.5~200 μg·L−1和0.01~50 μg·L−1,重复使用10 次后其萃取性能未见变化。欧红香等[57]采用溶剂热法制备了金属有机骨架材料UiO-66,用于吸附溶液中的亚甲基蓝(MB)。当UiO-66 的用量为0.5 g·L−1及MB 初始质量浓度为160 mg·L−1时,常温下吸附12 h 的吸附量可达191.1 mg·g−1,经过5 次吸附再生后UiO-66 的吸附量约损失16.77%,表明有较好的循环再生性能。
2.2.2 MMOFs 材料对污水中有机农药的处理
有机农药(例如除草剂、杀虫剂、杀真菌剂等)的残留积累会引起许多严重的环境问题,也会给人体带来健康风险。到目前为止,关于使用磁性MOFs处理污水中的有机农药水的研究还相对较少。Wang 等[58]通过简单的溶剂热反应合成了Fe3O4@NH2-MIL-101 的八面体磁性金属有机骨架,用于环境水样中六种苯环农药的磁性固相萃取(MSPE)。结果表明,Fe3O4@NH2-MIL-101 具有超高的比表面积(1012.7 m2·g−1)、大的孔容(0.64 cm3·g−1)和高的磁响应率(30.0 emu·g−1),可作为快速分离和富集目标分析物的理想吸附剂。此外,该团队还建立了以Fe3O4@NH2-MIL-101 为基质的MSPE 与高效液相色谱(HPLC)联用和紫外检测的灵敏方法,线性范围可扩展到1000 μg·L−1,检测下限(S/N=3)为0.13~0.86 μg·L−1,重现性好(18%~31%)。
Guo 等[59]采用简单的溶剂热方法,在三维低弯曲木腔中原位生长了UiO-66,得到了UiO-66/Wood复合膜,用于高效去除水中的有机污染物。这种独特的结构特征改善了有机污染物的传质,增加了水流经UiO-66 时有机污染物与UiO-66 的接触几率,从而提高了去除效率。此外,他们还设计了一种一体式过滤器,将三片UiO-66/木质膜组装在一起,可以有效地去除水中的罗丹明6G、普萘洛尔和双酚A等有机污染物。在通量为1.0×103L·m·h−1的条件下,UiO-66/木质膜对所有有机污染物的去除率均在96.0%以上,在实际水处理中显示出广阔的应用前景。
Ma 等[60]采用一锅溶剂热法将UiO-66 固定在Fe3O4@SiO2颗粒上,制备了一种新型的锆基磁性金属有机骨架Fe3O4@SiO2-UiO-66 ,将其用于吸附去除水环境中的三氯生(TCS)和三氯卡班(TCC)杀菌剂。研究显示,该MMOFs 材料具有吸附平衡时间短(仅25 min)和优异的饱和吸附容量(对TCS及TCC 分别为476.27 和602.40 mg·g−1)等显著优势,明显优于已报道的大多数吸附剂的吸附平衡时间及饱和吸附量。通过吸附解吸过程,该材料在重复使用11 次后去除率仍保持在80% 以上,表明Fe3O4@SiO2-UiO-66 对水中TCS 和TCC 的吸附主要是化学吸附,大部分是由于氢键、疏水基和配位键的共同作用的结果。
2.2.3 磁性MOFs 材料对污水中药品和个人护理产品的处理
个人护理产品(Personal Care Products,PPCPs)是一种新兴的有机污染物,包括药物、化妆品、食品补充剂和牙科保健产品中的成分,在地表水和地下水中已经检测到PPCPs 的存在[61]。由于其高度持久的特性,PPCP 的累积已经对公共健康和生态构成了威胁[62]。
强力霉素是一种药物污染物,进入环境后会造成污染。Naeimi 等[63]合成了MIL-53(Fe)及其磁性杂化分子筛MIL-53(Fe)/Fe3O4,并将其用于去除水体中的强力霉素。当pH 在5~6 之间时,MIL-53(Fe)/Fe3O4的最大吸附容量为322 mg·g−1,吸附过程速度快,30 min 内即达到平衡。合成的吸附剂具有超顺磁性,可通过外加磁场进行有效分离。使用过的吸附剂进行了6 次再生循环后,吸附容量无明显变化。
Hernández 等[64]合成了三氮唑锌层柱金属有机骨架(CIM-81),并首次将其用作分散微固相萃取法中的吸附剂。CIM-81 通过D-μSPE 方法在复杂废水中对9 种个人护理产品进行了测试,显示出比其他MOF(如HKUST-1、MIL-53(Al)和UiO-66)更好的分析性能特征。优化后的微萃取方法具有环境友好的特点,如MOF 用量低(10 mg),进样量少(10 mL),样品制备时间短(萃取解吸8 min,溶剂交换10 min),最大限度减少有机溶剂消耗(D-μSPE 中甲醇用量1.2 mL,色谱过程中乙腈用量约4 mL)等。该方法灵敏度高,检出限为1.5 ng·mL−1,在处理废水等复杂样品时,具有较好的相对回收率、富集倍数和中等精密度。
3 结语与展望
从我国近百年的污水处理技术发展历程来看,污水处理技术正朝着越来越密集化和工业化发展。污水处理不再是简单地去除污染物,而是更加注重环境友好和资源回收。MMOFs 材料作为一种高效的吸附剂,具有独特的结构和良好的吸附性能及易于分离,已成为污水处理中广泛使用的高效吸附剂,得到了研究者的广泛关注。但现阶段的MMOFs 吸附材料仍处于发展和理论时期,由于其合成成本太高,在实际应用中还未得到大规模应用。在今后MMOFs 材料的制备研究中,应从以下几个方面考虑:(1)准确控制MOFs 晶体在磁性粒子上的生长,探索更简单、更高效、更环保、成本更低的制备方法;(2)提高MMOFs 材料的吸附容量,可以通过静电吸附、螯合、π—π 堆积等作用来提高MMOFs 材料对水体污染物的去除效果;(3)提高MMOFs 吸附材料对水体的酸碱性和温度的耐受性以及水稳定性,使其可以抵抗住外界环境的干扰。
MMOFs 材料作为水处理的新型吸附剂材料在去除污染物方面已经展现出了优异的性能,但作为一种新型吸附剂材料,对其应用研究还不够深入,仍存在着许多亟待解决的问题。未来的研究将会集中在:(1)针对典型污水治理,精准设计出相对应的MMOFs 吸附剂材料,从而实现选择性吸附,达到资源再利用的目标;(2)开发出应对复杂性、多样性污染水体的MMOFs 材料,显著提高普适性污水的处理能力;(3)MMOFs 吸附剂材料,在磁选技术的大规模工业化推广应用上。总之,MMOFs 吸附剂材料在合成技术研究上已经极具发展空间,要实现水体环境吸附与分离应用,还有待于人们不断发掘和研究。