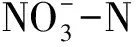耐盐高效好氧反硝化菌Halomonas sp.HRL-11的分离鉴定及反硝化性能
马洪婧,刘鹰,慕欣廷,苏鑫,宋婧,吴英海,韩蕊*
(1.设施渔业教育部重点实验室(大连海洋大学),辽宁 大连 116023;2.大连海洋大学 海洋科技与环境学院,辽宁 大连 116023;3.浙江大学 生物系统工程与食品科学学院,浙江 杭州 310058;4.大连海洋大学 海洋与土木工程学院,辽宁 大连 116023)
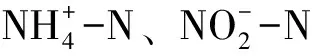
传统理论认为,反硝化作用是在缺氧条件下将硝酸盐氮转化为含氮气体的过程,这与循环水养殖系统需维持高溶氧状态以保证高密度养殖过程相矛盾。好氧反硝化过程的发现打破了这一屏障,好氧反硝化细菌Thiospherapantotropha的分离纯化,开启了好氧反硝化研究的新领域[4]。近年来,越来越多具有好氧反硝化能力的菌株被报道,如好氧反硝化菌PseudomonaspoaeNL-4[5]、Zobellellasp.XH5[6]和异养硝化好氧反硝化菌AcinetobacterindicusZJB20129[7]等。目前,已报道的好氧反硝化细菌主要分离自土壤、淡水湖泊及污水处理系统中,这些菌株在高盐度(>10)环境下好氧反硝化能力会受较大限制[8]。因为高盐度会导致细胞渗透压急剧增加,细胞代谢受到抑制,菌体细胞的酶活性降低,使得该类细菌在处理含盐废水或海水养殖废水时,脱氮效率低下[9]。RAS需要维持较高的溶解氧(DO)浓度,与BAF相比,RAS组合了厌氧反应器、曝气装置的工艺将占用更多的空间并浪费能耗。目前,对于高盐度(约30)、寡营养盐(COD<25 mg/L)条件下的好氧反硝化研究仍较少。因此,筛选具有耐盐及高效脱氮能力的菌株,提高BAF反硝化性能,对于海水RAS尤为重要。
本研究中,从RAS曝气生物滤池中分离得到一株具有高效好氧反硝化性能的菌株HRL-11,在高盐度(31)条件下,研究了溶解氧、C/N和温度等重要因素对该菌株好氧反硝化性能的影响及氮平衡分析,其结果对解决海水氮素污染,尤其是硝酸盐氮积累问题具有良好的实用潜力,并可为高盐度废水好氧条件下硝酸盐生物去除提供技术支持。
1 材料与方法
1.1 材料
菌株分离用生物滤片取自设施渔业教育部重点实验室(大连海洋大学)循环海水养殖系统曝气生物滤池。
1.2 方法
1.2.1 菌株筛选 将取自BAF中的生物滤片通过无菌水清洗后,利用灭菌刀片刮取生物膜,并用灭菌生理盐水梯度稀释10-1~10-7,然后均匀涂布于LB固体培养基上,于30 ℃下培养24 h。挑取单克隆菌落接种于反硝化培养基(DM)中培养48 h,然后将菌液在溴百里酚蓝(BTB)固体培养基上划线,在30 ℃条件下培养48 h。挑选BTB培养基变蓝色的单克隆菌株,在BTB培养基上多次划线纯化,直至获得纯化的单克隆菌株,周围无杂菌和伴生菌。将纯化的单克隆菌株,利用体积分数为20%的甘油保存于-80 ℃超低温冰箱中备用。经过分离纯化得到的菌株记为HRL-11。
1.2.2 培养基的配制
DM培养基:包含Na2HPO47.9 g/L、KH2PO44.5 g/L、MgSO40.1 g/L、K2HPO44.78 g/L、NaCl 30 g/L、KNO30.722 g/L、乙酸钠 3.418 g/L和微量元素3 mL/L(pH 7.1±0.2),其中,微量元素包含ZnSO4·7H2O 3 g/L、H3BO31.12 g/L、CaCl20.6 g/L、FeSO4·H2O 0.3 g/L、CuSO4·5H2O 1.57 g/L、MgSO4·7H2O 3 g/L和EDTA 25 g/L,DM固体培养基添加20 g/L琼脂[10]。
BTB培养基:在DM培养基基础上添加0.2%百里溴酚蓝(体积分数为1%,溶于乙醇),BTB固体培养基添加20 g/L琼脂。
LB培养基:包含蛋白胨10 g/L、酵母浸粉5 g/L和NaCl 30 g/L,LB固体培养基添加20 g/L琼脂。
1.2.3 菌株的形态观察及16S rDNA鉴定
1)扫描电镜(SEM)观察。取菌液2 mL,以10 000 r/min离心10 min。使用体积分数为3%的戊二醛溶液固定24 h,然后在扫描电镜下观察并拍摄菌株细胞形态。
2)16S rDNA鉴定。将纯化菌株接种于DM培养基中培养48 h,使用TIA amp细菌DNA试剂盒(中国天根)提取细菌基因组DNA,以基因组DNA为模板,扩增引物采用16S通用引物。上游引物27F: 5′AGAGTTTGATCCTGGCTCAG 3′,下游引物1492R: 5′GATACCTTGTTACGACTT 3′。
PCR反应体系(25 μL):Mix 12.5 μL,DNA模板1 μL,上、下游引物各0.5 μL,ddH2O 10.5 μL。反应条件:90 ℃下预变性5 min;94 ℃下循环变性60 s,55 ℃下退火复性60 s,72 ℃下延伸90 s,共进行30个循环;最后在72 ℃下再延伸变性5 min。通过变性凝胶电泳(DGGE)分析PCR产物,PCR产物测序由北京诺禾致源科技股份有限公司完成。
测序结果通过BLAST程序与GenBank数据库比对(https://blast.ncbi.nlm.nih.gov/Blast.cgi)。应用MAGA 6.0软件构建菌株系统发育树(N-J法)。
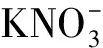
DO试验:体系中的DO通过摇床转速来控制。摇床转速分别设置为90 r/min(初始DO质量浓度5.58 mg/L)、120 r/min(初始DO质量浓度6.87 mg/L)和150 r/min(初始DO质量浓度7.48 mg/L),其余试验条件设置为C/N 10、温度30 ℃、pH 7.0±0.5,在此条件下摇床培养48 h。
C/N试验:将不同质量的乙酸钠分别加入以KNO3为唯一氮源的培养基中,控制C/N值分别为3、5、10、15,其余试验条件设置为温度30 ℃、pH 7.0±0.5、摇速150 r/min(初始DO质量浓度7.48 mg/L),在此条件下培养48 h。
温度试验:培养温度分别设置为20、30、40 ℃,其余试验条件设置为振荡摇速150 r/min、C/N 10、pH 7.0±0.5,在此条件下培养48 h。
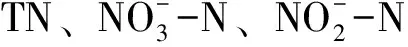
1.2.5 菌株HRL-11氮平衡测试分析 根据单因素试验结果,将菌株接种于盛有50 mL DM培养基的100 mL 西林瓶中,在30 ℃、150 r/min条件下培养48 h。菌液通过超声波细胞粉碎机(JY92-IIN,宁波新芝生物科技股份有限公司)处理。
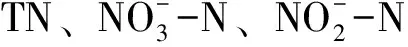
细胞内总氮=超声破碎后最终总氮-溶解态最终总氮,
总有机氮=溶解态总氮-硝酸氮-亚硝酸氮-氨氮,
氮损失=(初始总氮-超声破碎后最终总氮)/初始总氮×100%。
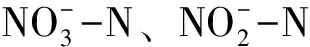
2 结果与分析
2.1 好氧反硝化菌的鉴定
菌株HRL-11为革兰氏阴性菌,菌落形态观察显示,该菌落在DM固体培养基上颜色微黄,直径为1.0~1.5 mm,边缘光滑,略微隆起,表面湿润,不透明,与培养基结合不紧密(图1A);扫描电镜观察显示,该细菌呈短杆状,未见鞭毛及芽孢(图1B)。
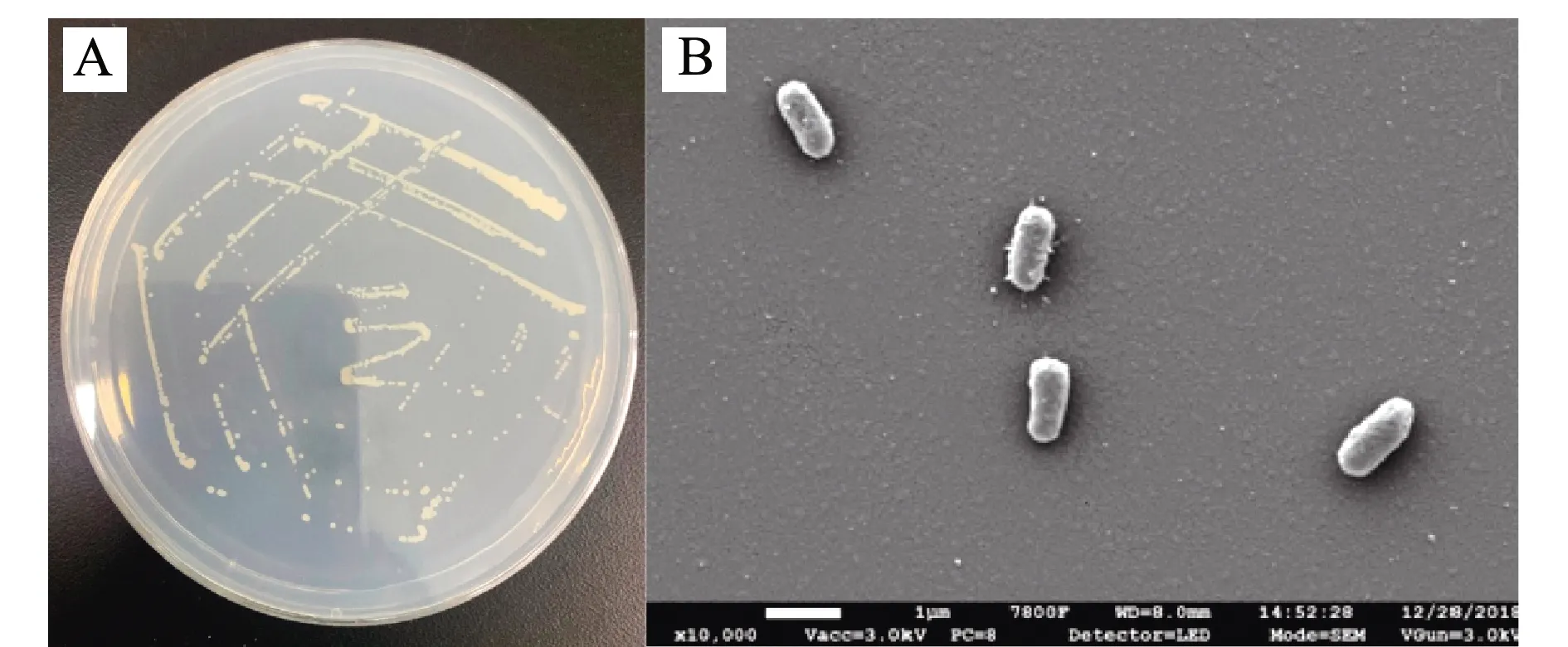
图1 菌株HRL-11的菌落图(A)和电镜图(B)
提取菌株HRL-11的总DNA,经16S rRNA基因序列扩增测序得到1 345 bp片段的DNA 序列,在NCBI数据库中BLAST检索显示,菌株HRL-11与多株Halomonassp.同源性最高,与菌株HalomonaszhaodongensisNEAU-ST10-25一致性为99.8%。系统进化分析显示,HRL-11与Halomonaszhaodongensis聚为一支,亲缘关系最近(图2)。结合形态学特征及16S rRNA基因序列分析结果,将该菌株鉴定为盐单胞菌属,命名为Halomonassp.HRL-11。于2019年9月17日,将该菌保存于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.18499。

图2 菌株HRL-11的系统发育树
2.2 DO对菌株碳、氮代谢及生长性能的影响
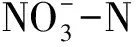
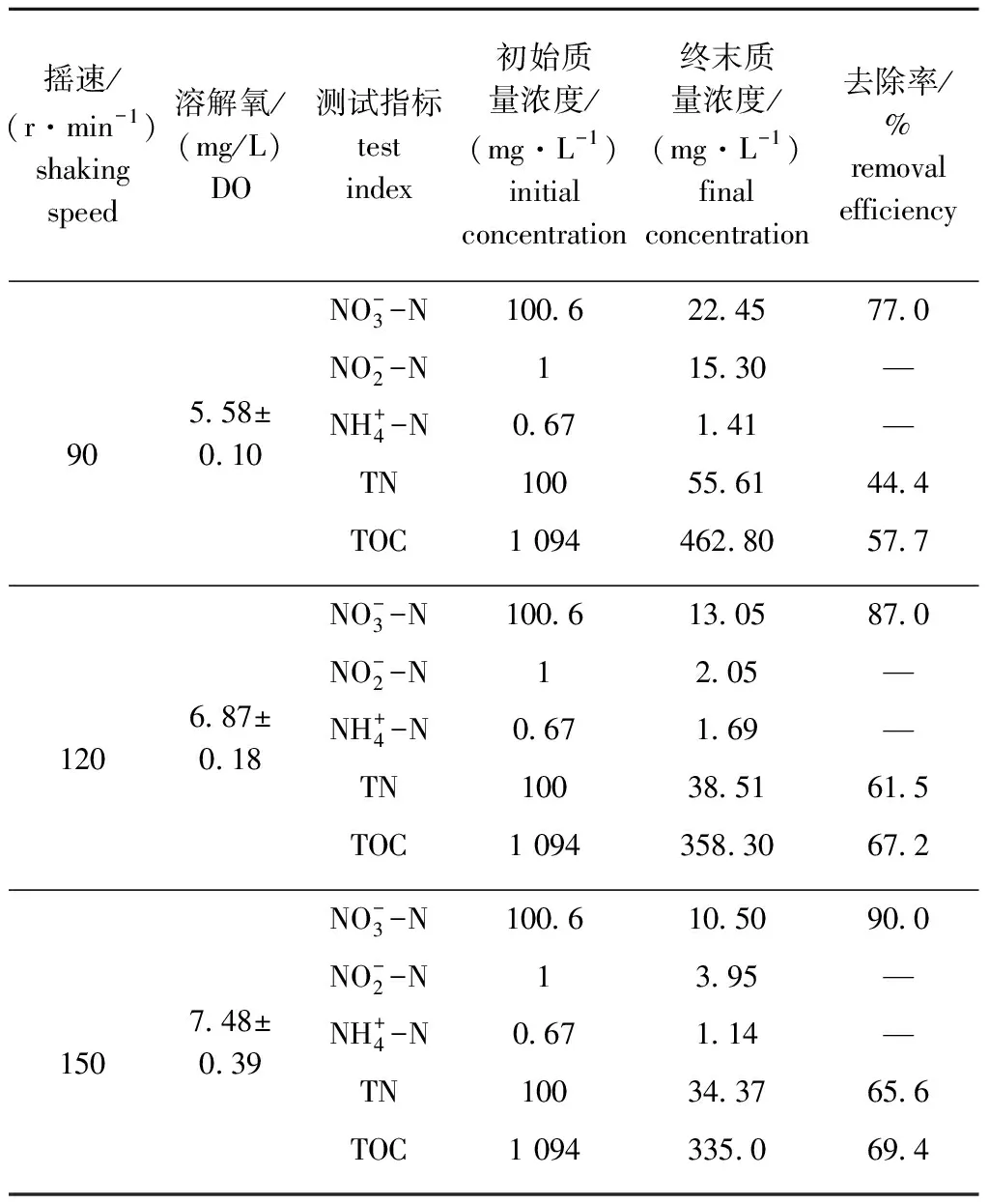
表1 不同溶解氧条件下氮、碳化合物的去除率(48 h)
2.3 C/N对菌株碳、氮代谢及生长性能的影响

表2 不同C/N条件下氮、碳化合物的去除率(48 h)
2.4 温度对菌株碳、氮代谢及生长性能的影响
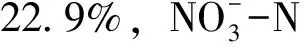
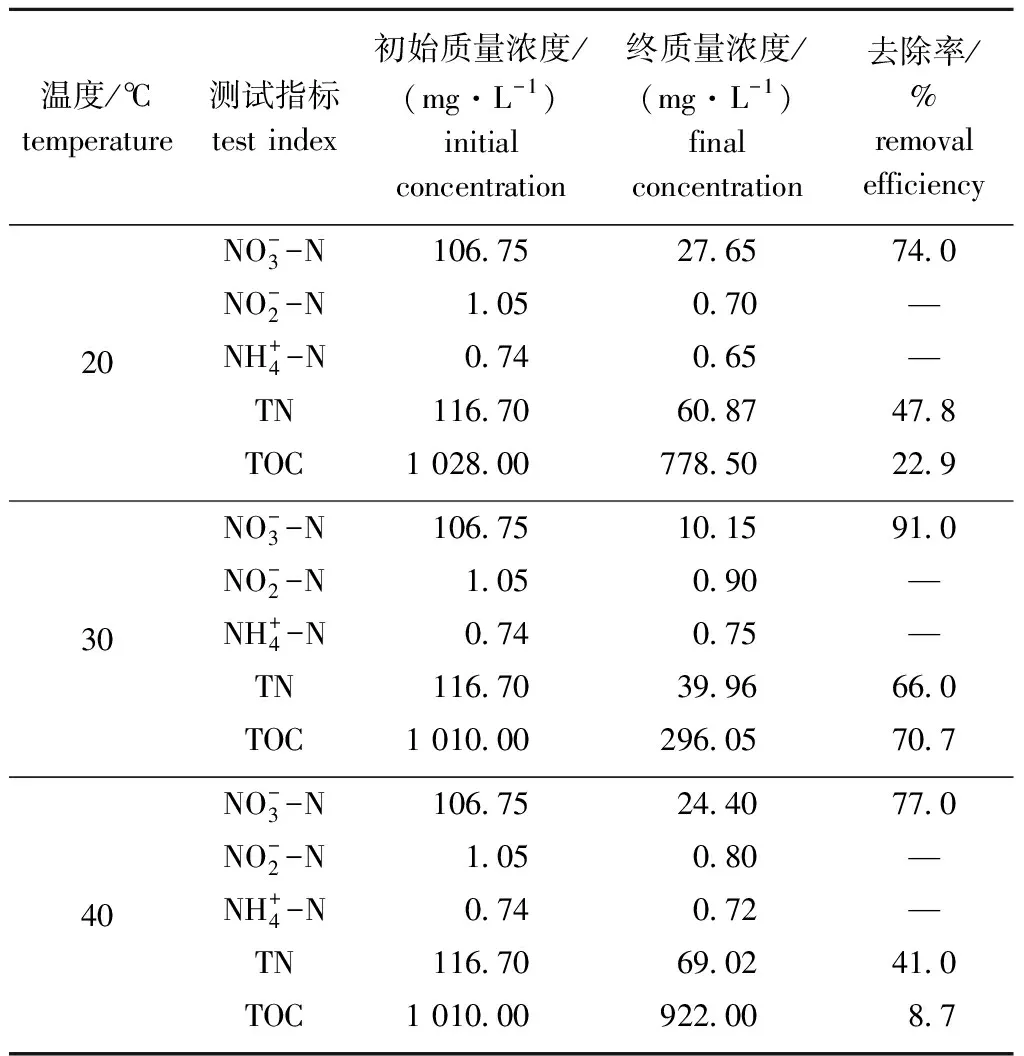
表3 不同温度条件下氮、碳化合物的去除率(48 h)
2.5 Halomonas sp.HRL-11的好氧反硝化性能
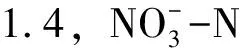
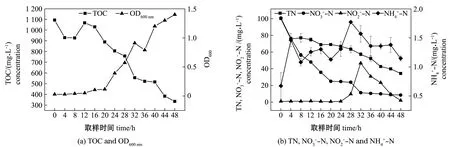
图3 Halomonas sp.HRL-11最佳脱氮条件(150 r/min,30 ℃,C/N 10)下试验系统水质参数的变化
2.6 菌株在好氧反硝化过程中的氮素转化途径

表4 Halomonas sp.HRL-11好氧反硝化过程中的氮平衡分析
3 讨论
3.1 HRL-11菌株的鉴定分析
本研究中,从海水生物滤池生物滤片上分离得到一株Halomonassp.HRL-11。根据已有研究,盐单胞菌是一种中度嗜盐细菌,包括70多个物种[11]。研究表明,一些盐单胞菌菌株具有好氧反硝化能力,如Halomonascampisalish3[12]、HalomonasalkaliphileHRL-9[13]和HalomonassalifodinaeY5[14]等。本研究中的单因素试验结果表明,不同因素(DO、温度和C/N)对菌株HRL-11的好氧反硝化性能有明显影响。
3.2 菌株Halomonas sp.HRL-11脱氮条件的优化
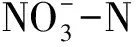
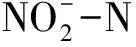
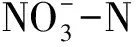
3.3 菌株Halomonas sp.HRL-11的氮转化途径
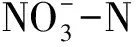
4 结论
1)从循环海水养殖系统曝气生物滤池生物滤片上分离得到一株高效耐盐好氧反硝化菌HRL-11,经形态学观察及16S rRNA序列分析鉴定为盐单胞菌属,记为Halomonassp.HRL-11。