Mn4+激活荧光粉可用锰源与制备方法
王兆武, 屈 巧, 姬海鹏*, 郝小非, 李金生
(1. 郑州大学材料科学与工程学院 郑州市先进能源催化功能材料制备技术重点实验室, 河南 郑州 450001;2. 中国地质科学院 郑州矿产综合利用研究所, 河南 郑州 450006;3. 东北大学秦皇岛分校 河北省电介质与电解质功能材料重点实验室, 河北 秦皇岛 066004)
1 引 言
美国通用电气公司成功将K2SiF6∶Mn4+荧光粉应用于白光发光二极管(LED),引发了Mn4+激活红光荧光粉的研究热潮。北京有色金属研究总院、华南理工大学、重庆邮电大学等单位已发表了数篇Mn4+激活荧光粉相关综述[1-3],介绍了Mn4+离子光谱学以及Mn4+激活荧光粉的研究历史、当前进展、专利情况、目前存在的问题等。
笔者近年来围绕Mn4+激活红光荧光粉展开研究,遇到了诸如如何选择锰源、如何选择制备方法、如何表征所合成荧光粉中锰离子价态、如何分析其占据格位等问题。前期我们相继探讨了Mn4+激活荧光粉中锰离子价态的表征技术[4]以及荧光粉中激活剂离子(包括Mn4+离子)所占据格位的分析方法[5];但就如何选择锰源和制备方法方面,发现不同文献分别使用了不同的锰源,如K2MnF6、KMnO4、Mn(HPO4)2、MnCO3、MnO2、MnO、Mn(NO3)2或Mn(CH3COO)2,所使用的制备方法也不同,有化学刻蚀法、离子交换法、水热法、共沉淀法、重结晶法、高温固相法、高能机械活化法、真空烧结加退火处理法等。
制备不同基质(氟化物、氟氧化物、氧化物)荧光粉时可用什么样的锰源?不同锰源有哪些相应的适用制备方法?在选择具体哪一种锰源和制备方法时有什么参考依据?为回答这些问题,本文尝试综述相关文献在制备不同基质荧光粉时所用锰源,对每一锰源依照所采取的制备方法进行叙述。此外,锰原子(电子构型[Ar]3d54s2)具有未充满d轨道,可呈现多种氧化态(+2、+3、+4、+6和+7等[6]);如何选择锰源及适宜制备方法以提高荧光粉中Mn4+含量从而降低其他杂质价态含量,以及不同锰源和制备方法对产物的量子效率、蓝光吸收效率及使用性能(如耐潮解劣化性能)有何影响,本文也尝试讨论总结,以期为研发高效Mn4+激活红光荧光粉提供参考。
2 锰源与制备方法
2.1 合成氟化物基质荧光粉可用锰源
K2MnF6和KMnO4是制备氟化物荧光粉最重要的锰源。早在1973年,数篇文献报道采用K2MnF6制备氟化物荧光粉。2008年以来,在日本群马大学报道金属单质在酸溶液的化学刻蚀过程中采用KMnO4为氧化剂偶然得到K2SiF6∶Mn4+后,后续报道合成氟化物荧光粉时类似地也采用KMnO4为锰源。近年来,由于采用K2MnF6为锰源在控制荧光粉中锰离子价态方面更有优势,经室温溶液方法合成氟化物荧光粉时又多采用K2MnF6为锰源。
2.1.1 KMnO4等高锰酸盐
以KMnO4等高锰酸盐为锰源合成氟化物荧光粉时,可采用化学刻蚀、水热、离子交换等方法。
2.1.1.1 化学刻蚀法
2008年,Adachi等[7]通过室温下将单质Si片在HF/KMnO4溶液中刻蚀合成了发射红光的K2SiF6∶Mn4+。此后,他们在HF/KMnO4溶液中刻蚀Si/Ge等,相继合成了Na2SiF6∶Mn4+[8]、Na2GeF6∶Mn4+[8]、K2GeF6∶Mn4+[9]、KNaSiF6∶Mn4+[10]等一系列Mn4+掺杂氟化物材料。该方法需要使用大量氢氟酸以及高纯硅/锗/钛单质,且室温下氢氟酸的刻蚀反应速率慢,因此合成效率低且合成的产物光效相对较低。2011年,Adachi等又报道通过刻蚀上述金属单质相应的氧化物粉体也可以制备氟化物荧光粉,如将TiO2在HF/AMnO4/AF(A=K,Cs,Na)溶液中经化学刻蚀可制备A2TiF6∶Mn4+(A=K,Cs,Na)荧光粉[11]。但因为金属氧化物在高浓度HF中的溶解度较大,因此这种方法的产率较低。
2.1.1.2 化学刻蚀+离子交换法
2015年,Adachi等[6]报道采用两步反应、以KMnO4为锰源制备BaGeF6∶Mn4+。首先以HF、H2SiF6、BaF2和GeO2为原料制得BaGeF6,再将其在HF/KMnO4溶液中浸泡6 h经离子交换反应制得BaGeF6∶Mn4+。
2.1.1.3 水热法
2014年,Liu等[12]通过水热法合成了BaSiF6∶Mn4+荧光粉。将一定比例的Ba(NO3)、(NH4)2SiF6、 KMnO4加入HF溶液中,在Teflon反应釜中,经120 ℃反应12 h得到BaSiF6∶Mn4+红光荧光粉。KMnO4在HF溶液中被还原为Mn4+,但当KMnO4过量时,其会还原为Mn2+并留在溶液中;此外,他们也尝试以醋酸锰为锰源进行BaSiF6∶Mn4+的水热合成,但在无氧化剂条件下,醋酸锰中的Mn2+离子无法氧化为Mn4+,因此制备的产物无红光荧光发射。2021年,Gao等[13]将XO2(X=Ge,Si)溶入HF溶液中,再加入BaCO3和KMnO4,然后将混合溶液转移至Teflon反应釜中经180 ℃加热8 h,制得BaGe1-xSixF6∶Mn4+(0 ≤x≤ 1)荧光粉,呈均一柱状形貌(长度1~7 μm);通过调控Si4+的固溶含量,荧光粉的发光强度与荧光热猝灭性能可显著提高。同年,Zhang等[14]将KF、KMnO4、K2SiF6在HF溶液中充分搅拌后,转移至Teflon反应釜中,经120 ℃加热10 h,制得K2SiF6∶Mn4+荧光粉。
2.1.1.4 离子交换法
2013年,Adachi等[15]报道利用H2SiF6和BaCl2反应制备BaSiF6,然后将其浸泡在HF/KMnO4溶液中经离子交换反应制得BaSiF6∶Mn4+荧光粉,呈不规则团聚体形貌,其红光发射峰峰值位于630 nm。
此外,NaMnO4与RbMnO4也被用作锰源,采用的制备方法有离子交换法和共沉淀法。
2.1.1.5 离子热+离子交换法
2020年,McKittrick等[16]以NaMnO4为锰源,采用离子热和离子交换两步法合成Na2SiF6∶Mn4+。首先以1-丁基-3-甲基咪唑四氟硼酸、NaBr、原硅酸四乙酯为前驱物,通过离子热反应制得Na2SiF6基质,然后将其加入HF(10%)溶液中,依次加入NaMnO4、H2O2(还原剂)后经离子交换反应制得Na2SiF6∶Mn4+,直径为500 nm左右;经离子交换反应后,短柱体形貌受HF侵蚀而变得更接近于球形。荧光光谱中位于596,610,618,629,644 nm的发射峰分别来自于ν3、ν6、零声子线、ν6和ν3振动模式,而未见来自于ν4振动模式的发光峰。作者认为这可能是因为所用HF溶液浓度较低,未为Mn4+提供足够F-配位离子。
2.1.1.6 共沉淀法
2015年,汪正良等[17]报道了以NaMnO4为锰源经共沉淀法制备Na2XF6∶Mn4+荧光粉。首先将XO2(X=Si,Ge,Ti)在HF(40%)溶液中溶解;然后加入NaMnO4·H2O,此时将溶液升温至70 ℃后,缓慢加入NaF并在70 ℃下持续搅拌0.5 h后过滤沉淀得到产物。2016年,Liu等[18]以RbMnO4为锰源,通过一步共沉淀法制备了Rb2SiF6∶Mn4+。首先经70 ℃水浴1 h将SiO2在HF(48%)溶液中溶解;随后在剧烈搅拌下将其与溶解有RbMnO4、RbF的HF溶液混合,再加入H2O2后析出Rb2SiF6∶Mn4+。产物为5~20 μm大小、具有清晰晶面和晶棱的多面体颗粒,其荧光热猝灭性能优异,150 ℃时积分发光强度为室温时的115%。
2.1.2 K2MnF6
KMnO4作为锰源时,所含Mn7+在还原为Mn4+过程中易出现Mn3+、Mn2+等价态,造成荧光粉的量子效率降低。为避免这种情况,可首先由KMnO4制得K2MnF6,然后再将其与基质进行离子交换掺杂、共沉淀等反应。而K2MnF6易潮解劣化[19],因此需要实验室现用现制并在干燥器中储存。其合成多采用Bode等[20]在1953年所报道的方法:在冰水浴中强磁力搅拌下将KMnO4和过量KHF2溶入HF(40%)溶液中,KMnO4充分溶解得到深紫色溶液;然后缓慢滴入(如3 min/滴)H2O2(30%)溶液,此时溶液中出现黄色固体K2MnF6;当溶液紫色快速褪去而呈浅棕色时立即停止滴加H2O2,过滤沉淀后加入适量HF溶液洗去可能残余的KHF2,重复两次后再用丙酮冲洗数次得到K2MnF6。反应过程如反应式(1)所示:
2KMnO4+2KHF2+8HF+3H2O2→
2K2MnF6↓+8H2O+3O2↑,
(1)
制备过程中,还原剂H2O2的滴加速率和滴加量是影响K2MnF6产率的重要因素。此外,在氟源方面,加入过量KHF2或KF都可以为Mn4+离子提供足够F-离子以形成相对稳定的[MnF6]2-基团。当使用KF提供氟源时,由于溶液中K+浓度更大,导致沉淀物中KHF2残留更多,对所得沉淀物进行冲洗洗去KHF2杂质时需要使用更多的HF溶液;以KHF2为氟源时,由于溶液中K+含量相对较低,产物中残留的KHF2较少,需要较少的HF溶液进行冲洗即可得到高纯K2MnF6。图1所示为本课题组所制备K2MnF6的照片和XRD图谱[21]。

图1 K2MnF6粉末。(a)可见光下的照片;(b)XRD图谱;(c)光学显微图像[21]。
以K2MnF6为锰源多用于制备氟化物基质荧光粉,可采用重结晶、共沉淀、离子交换等方法。
2.1.2.1 重结晶法
1973年,Paulusz[22]报道了利用重结晶法制备K2MF6∶Mn4+(M=Si,Ge,Ti)荧光粉。将K2MF6与K2MnF6放入HF(40%)溶液中,溶液缓慢挥发再结晶得到K2MF6∶Mn4+荧光粉,其在蓝光激发下发射红光。1973年,Helmholz等[23]报道将Cs2GeF6和K2GeF6与Cs2MnF6或K2MnF6放入HF溶液中,缓慢挥发重结晶制备Cs2GeF6∶Mn4+和K2GeF6∶Mn4+。1976年,Chodos等[24]报道将A2MF6(A=K,Rb,Cs;M=Si,Ge,Ti)与A2MnF6放入HF溶液中,经重结晶方法制得A2MF6∶Mn4+。2010年,Setlur等[25]报道将K2TiF6或K2SiF6与K2MnF6放入高浓度HF溶液中,在70 ℃下挥发溶剂至干燥得到K2TiF6∶Mn4+或K2SiF6∶Mn4+,其量子效率与商业石榴石黄光荧光粉相当,且在150 ℃时的荧光热猝灭在5%以内。但重结晶方法相对耗时,挥发出的大量HF需无害化处理。
2.1.2.2 共沉淀法
2016年,Song等[26]报道了利用共沉淀法制备Na3AlF6∶Mn4+荧光粉。首先在室温下将K2MnF6和AlF3在HF(49%)溶液中完全溶解;随后加入NaF后持续搅拌0.5 h,溶液中缓慢形成Na3AlF6∶Mn4+;然后将悬浊液降温至0 ℃附近并保温1 h后过滤沉淀物得到荧光粉产物。其为毫米尺寸的、具有光滑晶面的柱状晶,表现出强零声子线发光(620 nm)和高荧光热稳定性。2017年,Song等[27]又报道利用共沉淀法制备Cs2SiF6∶Mn4+。首先将SiO2在HF(49%)中溶解,然后加入K2MnF6,再加入CsF并搅拌半小时,得到含Cs2SiF6∶Mn4+的悬浊液在冰水浴中陈化2 h,收集固体得到产物。其内、外量子效率分别高达89%和71%;荧光热稳定性好,150 ℃时可保持室温发光强度的95%。2019年,Zhang等[28]报道采用共沉淀法制备Cs2MnF6∶Si4+荧光粉。首先将K2MnF6在HF溶液中溶解后加入CsF,搅拌1 h后得到Cs2MnF6;将适量Cs2MnF6加入HF溶液后再加入K2SiF6制得Cs2MnF6∶Si4+。Si4+掺杂可显著提高发光强度,其吸收效率、内/外量子效率分别高达88%、54.9%和48.3%。共沉淀法高效且可通过冰水浴等方式控制反应在较低温度下进行,适用于大多数氟化物荧光粉制备。
2.1.2.3 离子交换法
离子交换法与重结晶法具有一定相似之处,即都是将氟化物基质与K2MnF6锰源放置在HF溶液中。区别在于前者HF溶液用量大,可同时将氟化物基质溶解;而后者HF溶液用量大幅减少,仅提供反应介质。2014年,陈学元等[29]报道用K2TiF6与K2MnF6经离子交换反应(如图2所示)制备K2TiF6∶Mn4+荧光粉,其吸收效率、内/外量子产率分别高达54%、93%和50%。离子交换法所消耗HF溶液量(~0.36 mL·g-1K2TiF6)约为前述共沉淀法所消耗HF溶液量(~6 mL·g-1K2TiF6)的1/17,因此可大大降低HF溶液使用量。此外,离子交换反应速率很高,反应过程可控性强,利于掺杂反应控制,且可以方便地扩展至其他氟化物荧光粉的合成,如K2SiF6∶Mn4+、NaGdF4∶Mn4+和NaYF4∶Mn4+等。进一步采用扫描透射电子显微镜和能量色散光谱技术分析Mn4+在K2TiF6颗粒内的分布情况。如图3所示,不管是元素线扫描还是面扫描,都可见Mn相对于Ti元素具有相似的浓度分布,说明经20 min离子交换反应后Mn4+均匀地掺杂进入了K2SiF6晶体颗粒中。
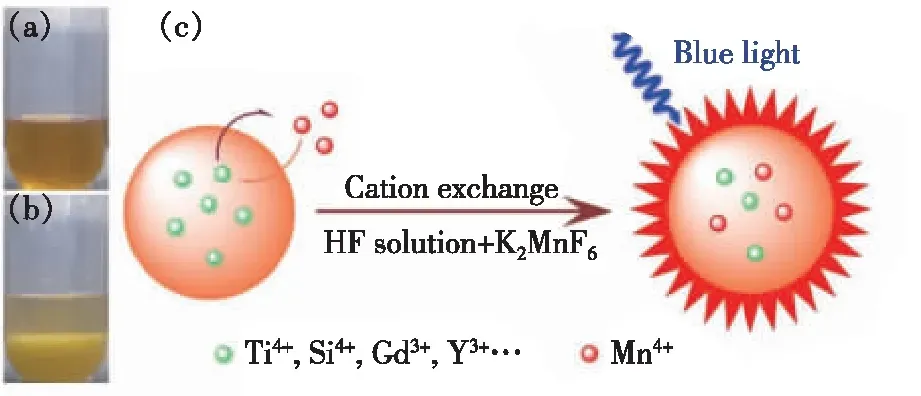
图2 (a)将K2MnF6在HF溶液中溶解后的照片;(b)上述溶液中加入K2TiF6后离子交换反应进行3 min后的照片;(c)离子交换反应制备Mn4+激活氟化物荧光粉示意图[29]。

图3 K2TiF6∶Mn4+(6.96%)荧光粉的元素分布表征。(a)用于EDS线扫描的一个随机选择的K2TiF6∶Mn4+荧光粉颗粒的扫描透射电子显微镜照片;(b)颗粒的EDS谱表明含有K、Ti、F和Mn元素;(c)EDS线扫描所得Ti元素分布;(d)EDS线扫描所得Mn元素分布;(e)用于扫描透射电子显微分析的一个随机选择的K2TiF6∶Mn4+荧光粉颗粒;(f)在所选区域的Ti元素分布;(g)在所选区域的Mn元素分布[29]。
当氟化物基质为更大尺寸(如毫米级晶体)时,离子交换反应难以实现均匀掺杂且也将有副反应发生。2021年,本课题组[21]曾报道利用离子交换反应向Na2SiF6单晶体中掺杂Mn4+。经降温结晶制备的Na2SiF6柱状晶表面光滑,结晶度高(图4(a));将其浸入K2MnF6/HF溶液中24 h后,晶体表面沉积了一层颗粒物(图4(b)),这些颗粒物具有不同形貌(图4(c)),能量散射谱分析其成分或含Na-F、或含K-Si-F,推测在离子交换反应进行中伴随着Na2SiF6在HF中的部分溶解。离子交换反应后,在365 nm照射下,Na2SiF6晶体两端比其晶体中段发射更强的红光(图4(d))。

图4 (a)经降温结晶制备的Na2SiF6柱状单晶;(b)Na2SiF6单晶在K2MnF6/HF溶液中浸泡24 h后,表面沉积了一层霜状物质;(c)上述表面沉积物的扫描电子显微镜图像;(d)Na2SiF6单晶掺杂Mn4+后在365 nm照射下的照片[21]。
2.1.2.4 水热法
2020年,汪正良等[30]将BaCO3、HfO2、K2MnF6在HF(40%)中混合后转移至Teflon反应釜,经150 ℃水热8 h制得Ba2HfF8∶Mn4+荧光粉,其表现出622 nm处的强零声子线发光。2021年,Wu等[31]将K3NbOF6、K2MnF6、HF(40%)装入Teflon反应釜中,经120 ℃水热1.5 h制得K2NbF7∶Mn4+,产物为1~2 μm的片状颗粒,在600~650 nm之间具有多个尖锐发射峰,并具有强零声子线发射(620 nm),内量子效率为~82%。
由上述文献可知,以K2MnF6为锰源时,经共沉淀法或离子交换法可制备得到高量子效率(如内量子效率达>90%)的氟化物荧光粉。这可能得益于掺杂过程中Mn4+价态得以较好保持,且可实现较高浓度掺杂。
2.1.3 Mn(HPO4)2
在使用上述锰源时,相应的制备方法中都需要使用高危性氢氟酸。为开发相对绿色、不使用氢氟酸的制备方法,需要为Mn4+寻找一种新的配体离子,避免在溶液中还原得到的Mn4+发生快速水解。[HPO4]2-可稳定Mn4+,因此Mn(HPO4)2也被用作锰源。
2017年,王静等[32]报道了采用水溶性Mn-(HPO4)2为锰源制备K2SiF6∶Mn4+。首先通过磷酸活化法制备Mn(HPO4)2。将KMnO4的深紫色溶液滴加到甲酸钾溶液中,离心收集沉淀物后得到深棕色MnO(OH)2(反应式2):
2MnO(OH)2(s) + 3CO2(g) + 5OH-(aq.),
(2)
再将其分散到磷酸中静置得到Mn(HPO4)2溶液(反应式3):
MnO(OH)2(s) + 2H3PO4(aq.) →
Mn(HPO4)2(aq.) + 3H2O(l),
(3)
该溶液室温下能够稳定存在15 d以上。图5为所制备的MnO(OH)2固体和Mn(HPO4)2溶液。将Mn(HPO4)2溶液与SiO2、KHF2混合后,再经水热法制得K2SiF6∶Mn4+红光荧光粉,产物为10 μm大小的十二面体形颗粒,内量子效率为28%。当在H3PO4溶液中加入[HF2]-,中间态锰源Mn-(HPO4)2缓慢转变为[MnF6]2-,SiO2转变为[SiF6]2-(反应式4和5):

图5 (a)深棕色的MnO(OH)2;(b)Mn(HPO4)2溶液[30]。
Mn(HPO4)2(aq.) + 3[HF2]-(aq.)+
H+(aq.)↔[MnF6]2-(aq.) + 2H3PO4(aq.),
(4)
SiO2(s) + 3[HF2]-(aq.)+
H+(aq.) → [SiF6]2-(aq.) + 2H2O(l),
(5)
最终,K+/[SiF6]2-/[MnF6]2-离子间反应得到K2SiF6∶Mn4+。
在上述反应过程中,H3PO4/KHF2组合使用作为溶剂,起到了与高危性HF溶液相同的稳定Mn4+的作用,促进了[MnF6]2-的形成;但所得产物的量子效率较低。
2.2 合成氟氧化物基质荧光粉可用锰源
目前报道的Mn4+激活氟氧化物荧光粉主要有R2WO2F4∶Mn4+(R=Na/Cs)、Cs2NbOF5∶Mn4+、BaNbOF5∶Mn4+、Sr2ScO3F∶Mn4+、Mg28Ge7.55-O32F15.04∶Mn4+、LiAl4O6F∶Mn4+、K3MoOF7∶Mn4+和K3WOF7∶Mn4+等,使用的锰源有K2MnF6或CsMnF6、Mn(NO3)2和MnCO3,可采用共沉淀、高温固相反应、高能机械活化等方法制备。关于氧氟化物荧光粉结构与荧光特征的详细信息,请参见笔者之前的综述[33]。本章节侧重叙述合成氧氟化物荧光粉时所用锰源与制备方法。
2.2.1 K2MnF6或Cs2MnF6
2.2.1.1 共沉淀法
采用共沉淀法时通常以K2MnF6为锰源,流程与制备Mn4+激活氟化物荧光粉相似。2017年,Hu等[34]采用共沉淀法合成了Na2WO2F4∶Mn4+。在磁力搅拌下将Na2WO4·2H2O溶入HF溶液中,然后加入K2MnF6,再加入甲醇为沉淀剂得到产物,其表现出非常强的零声子线发光(620 nm),内量子效率最高达76%(此时荧光寿命为2.59 ms),但其荧光热猝灭严重,在340 K时发光强度即降低为300 K的一半。同年,Cai等[35]将Cs2WO4溶入HF溶液后,加入K2MnF6,50 ℃下干燥12 h得到Cs2WO2F4∶Mn4+产物,但其零声子线发光强度却很弱。2018年,Ming等[36]通过共沉淀法制备Cs2NbOF5∶Mn4+。首先将Nb2O5溶入HF溶液中,随后加入K2MnF6和CsF,搅拌2 h并陈化8 h后制得产物,为10~25 μm长的柱状颗粒,表现出与氟化物荧光粉类似的锐线发射,峰值位于633 nm,150 ℃时可保留室温时发光强度的60.97%。
2.2.1.2 水热法
2018年,Dong等[37]采用水热法制备了Ba-NbOF5∶Mn4+。在磁力搅拌下将BaF2、Nb2O5、K2MnF6在HF溶液中混合,在40~180 ℃下反应8 h得到荧光粉产物。随反应温度升高,其形貌由微米多面体逐渐变为长方体。发光峰值位于629 nm,零声子线发光较弱。
2.2.1.3 高能机械活化法
2019年,Huppertz等[38]采用高温固相和球磨两步法制备K3WOF7∶Mn4+。首先在氩气保护下将KHF2、WO3研磨均匀后装入铜安瓿瓶中,随后在管式炉中经400 ℃热处理48 h制得K3WOF7基质,再在惰性气氛下将K3WOF7与CsMnF6混合球磨实现Mn4+的机械化学掺杂。所得荧光粉表现出与Mn4+在典型氟化物基质中相似的发光特征,发射峰值位于627 nm,且零声子线较强,但在360 K时,发光强度已降为300 K时的一半。2019年,Huppertz等[39]采用相似方法将K3MoOF7与K2MnF6在惰性气氛下球磨制备K3MoOF7∶Mn4+荧光粉,室温下观察到7个尖锐发射峰,最强发射峰位于627 nm且零声子线较强,在100 ℃时的发光强度降低为25 ℃时的70%。
2.2.2 Mn(NO3)2
2018年,Kato等[40]采用高温固相法制备了Sr2ScO3F∶Mn4+。将SrCO3、SrF2、Sc2O3和Mn-(NO3)26H2O充分研磨后,经1 200 ℃热处理制得Sr2ScO3F∶Mn4+。其可在300~600 nm之间激发发射峰值位于697 nm的深红光,345 nm激发下内、外量子效率分别为50.5%和43.5%。
2.2.3 MnCO3
2016年,Brik等[41]采用高温固相法制备了Mg28Ge7.55O32F15.04∶Mn4+。将MgO、MgF2和GeO2与MnCO3磨匀后,在1 100 ℃下煅烧1 h,再次研磨后于1 200 ℃下煅烧16 h制得。理论计算表明,Mn4+在该荧光粉中优先取代[Ge(1)O6]中的Ge4+,但其零声子线发光位于642 nm,是Mn4+与O2-配位时表现出的较短的红光发光波长。
2.3 合成氧化物基质荧光粉可用锰源
以氧化物为基质时,MnCO3、MnO2、MnO、Mn(NO3)2、Mn(CH3COO)2常被用作锰源,其中MnCO3是文献中高温固相反应法最常使用锰源。有时,采用固相法合成系列锰掺杂浓度的样品时,为了控制很低掺杂浓度时的称量精准度,采用水溶性锰源配制稀释后的水溶液的方式加入锰源。而当采用液相方法参与制备时,文献报道采用水溶性的Mn(NO3)2和Mn(CH3COO)2为锰源。
2.3.1 MnCO3
2005年,Murata等[42]采用高温固相法,以MnCO3为锰源,将CaO和Al2O3与CaF2或MgF2熔盐混合后,在1 700 ℃下保温3 h制备了CaAl12O19∶Mn4+荧光粉,其呈现晶面清晰的六角片状,发射主峰为656 nm的红光。2020年,本课题组[43]以MnCO3为锰源,将不同α/γ晶型比例的Al2O3与MgO混合后经1 550 ℃保温5 h,制得了具有不同比例红光(主峰651 nm)/绿光(主峰520 nm)发光的MgAl2O4∶Mn4+/2+荧光粉。发现增加铝源中γ-Al2O3含量促进MgAl2O4∶Mn荧光粉中Mn以+4存在,而增加α-Al2O3含量促进荧光粉中Mn以+2存在。原因可能是使用高反应活性γ-Al2O3为铝源时,在相对低的温度范围内,含锰化合物先与γ-Al2O3固溶反应,形成的Al2O3∶Mn再在相对高的温度与MgO经固相反应得到MgAl2O4∶Mn4+。2020年,尤洪鹏等[44]以MnCO3或MnO2为锰源,经高温固相反应法制备了Gd3Ga5-x-δAlx-y+δO12∶yMn(x=0~4,y=0.002~0.030)荧光粉,将Gd2O3、Ga2O3、Al2O3与MnCO3或MnO2磨匀后,空气气氛下经1 400 ℃保温6 h得到产物。产物中Mn2+/Mn4+比例可通过Al3+替代Ga3+进行调控:锰离子占据八面体配位的Ga3+格位时,形成Mn2+发光中心,峰值位于630 nm;占据八面体配位的Al3+格位时,形成Mn4+发光中心,峰值位于698 nm。以MnO2为锰源时,x=0或1时,产物发光光谱仅显示出Mn2+发光,说明在Gd3Ga5-xAlxO12基质中Mn4+自还原为Mn2+;x=2~4时,产物发光光谱中Mn2+和Mn4+发光均存在,Al3+固溶量的增加促进了Mn4+发光的增强。而以MnCO3为锰源时观察到了相似现象,说明锰离子的价态演变与锰源无关,而与Al3+的固溶浓度相关。
2.3.2 MnO2
2018年,Huang等[45]报道采用高温固相法,以MnO2为锰源,将MgO、TiO2、MnO2在1 450 ℃保温8 h制得Mg2TiO4∶Mn4+荧光粉,呈现峰值位于658 nm的非对称发射带,并可通过共掺Nb5+使荧光强度增大243%。2019年,Peng等[46]报道以MnO2为锰源,经固相反应法合成Mg2TixGe1-xO4∶Mn4+。将MgO、TiO2、GeO2、MnO2混合经1 400 ℃保温6 h得到产物;经调控Ge4+固溶比例,荧光粉的量子效率和热稳定性有所提升,330 nm激发下150 ℃时可保留室温发光强度的80.2%,内量子效率可保留77.8%。
2.3.3 MnO
2018年,Hu等[47]采用提拉法制备了BeAl2O4∶Mn4+单晶体。以BeO和Al2O3为原料,MnO为锰源,按照化学计量比混合后,在高纯氮气保护下于感应加热炉中进行晶体生长,固液界面温度梯度控制为60 ℃/cm,提拉和旋转速率分别控制为1 mm/h和10~15 r/min。所得单晶体呈浅粉色,尺寸为45 mm × 80 mm,418 nm激发下发射主峰为681 nm的深红光。
2.3.4 Mn(NO3)2
锰的氧化物不溶于水,因此在采用液相合成方法时,使用水溶性的Mn(NO3)2作为锰源。
2.3.4.1 共沉淀法+高温固相法
2020年,本课题组[48]以Mn(NO3)2为锰源,首先采用共沉淀法制备了含Mg2+/Al3+溶液;然后滴入氨水作为沉淀剂,溶液中即刻析出白色沉淀,经老化、干燥后在450 ℃热处理并研磨;最后分别经700,1 000,1 300 ℃热处理3 h得到产物。MgAl2O4∶Mn4+表现出超宽带红光发射,峰值位于651 nm,其发光光谱的半高宽依赖于晶体结构的有序度和Mg2+↔Al3+反占位缺陷浓度。
2.3.4.2 溶胶凝胶法+高温固相法
2014年,Medic等[49]报道以Mn(NO3)2为锰源,采用溶胶凝胶法制备含Mg2+/Ti4+的凝胶前驱体,然后经600 ℃热处理1 h得到Mg2TiO4∶Mn4+纳米荧光粉。产物为由10 nm大小的晶粒松散地团聚为1 μm大小的二次颗粒组成,表现出峰值位于658 nm的红光发光,荧光寿命为1.2 ms。
2.3.5 Mn(CH3COO)2
Mn(CH3COO)2同样溶于水,因此被用于液相合成过程。2019年,Hasegawa等[50]以Mn-(CH3COO)2为锰源,采用溶胶凝胶法合成了含Ti4+/Li+前驱体,经500 ℃热处理6 h使有机物分解,再在空气气氛下经600~1 000 ℃煅烧6 h,制备了Li2TiO3∶Mn4+荧光粉。与经传统固相反应法合成的Li2TiO3∶Mn4+对比发现,通过溶胶凝胶法制备的荧光粉对蓝光的吸收效率大幅增强。经X射线吸收近边结构谱分析产物中Mn化合价和有效Mn4+浓度,发现产物的量子效率强烈依赖于有效Mn4+的浓度,最高内量子效率为31.6%,存在少量Mn2+或Mn3+时可导致量子效率的急剧下降。
3 锰源/制备方法对产物荧光性质的影响
锰源的种类在一定程度上限定了可采用的制备方法。虽然不同锰源及制备方法对所合成产物的发光光谱特征影响不大(更多地取决于Mn4+的配体离子种类和其取代基质中某一具有固定晶体学特征的阳离子格位后所形成微观配位体的结构),但对产物的荧光量子效率和形貌尺寸等影响较大,笔者总结为以下几个方面:
(1)制备Mn4+激活氟化物荧光粉时,采用K2MnF6为锰源、在室温溶液介质中经共沉淀法或离子交换法合成,可更有效地促进产物中锰离子以+4形式存在,可更容易地制备出内量子效率达90%以上的荧光粉。使用新鲜制备的高纯K2MnF6作锰源、提供酸性低温环境抑制溶液中[MnF6]2-基团因歧化或水解反应引起的变价劣化、在尽量短的时间内将Mn4+掺杂进入氟化物晶格中,是提高量子效率的关键。
(2)制备Mn4+激活氧化物荧光粉时,多采用高温固相方法,经常使用MnCO3作为锰源,所得产物中锰离子主要价态为Mn4+;而使用其他锰源如MnO2、MnO、Mn(NO3)2、Mn(CH3COO)2时,经高温热处理后所得荧光粉中锰离子主要价态也为Mn4+。此时,锰源种类对产物中锰离子价态影响不大,其主要受基质中晶体学格位和所取代离子的配位结构影响。文献中多采用MnCO3而非MnO2或MnO作为锰源的原因可能是因为前者是淡粉红色至近乎白色化合物,而后者为棕色(MnO2)和草绿或灰绿色(MnO)化合物(如果其固溶反应不完全将造成荧光粉着色而降低发光效率);也可能是因为MnCO3受热分解温度低,分解产生的中间化合物反应活性高,有利于锰离子在荧光粉基质中固溶掺杂反应的进行。
(3)在合成氧化物基Mn4+激活荧光粉时,虽然锰源种类对产物中锰离子价态影响不大,但制备方法对其影响较大。比如,在氧化气氛中进行高温固相反应或者将经真空烧结的锰离子掺杂透明陶瓷材料在氧气中退火处理,有利于荧光材料中Mn4+含量比例的增加[51]。再如,在合成MgAl2O4∶Mn4+荧光粉时,采用高反应活性的γ-Al2O3,使锰源先与之反应固溶进入Al2O3晶格中,然后再与MgO反应形成尖晶石物相,有利于得到Mn4+占据Al3+格位的MgAl2O4∶Mn4+红光荧光粉[43]。
(4)在制备Mn4+激活氧化物荧光粉时,除上面介绍的制备方法对产物中锰离子价态影响较大外,基质的晶体结构及所形成的点缺陷对产物中锰离子价态也影响较大。比如,BaMgAl10O17与Ba0.75Al11O17.25具有类似晶体结构,两者之间可形成连续固溶体;但在BaMgAl10O17基质中可获得Mn4+红光发光,而在Ba0.75Al11O17.25基质中,无论是改变锰源(MnCO3、MnO2或KMnO4)或者改变热处理气氛(空气或纯氧气),都只获得Mn2+绿光发光;在上述两种铝酸盐形成的固溶体组分中,调节端元组分比例可相应地调节产物中Mn2+/Mn4+的相对发光强度[52]。因此,产物中Mn离子价态主要受Ba0.75Al11O17.25晶体结构及其点缺陷影响。再如,在Zn2GeO4和Na2ZnSiO4基质中经高温固相反应掺杂锰离子时,无论使用MnCO3、MnO2或KMnO4中的哪一种锰源,都将发生Mn7+/Mn4+→Mn2+的自还原现象,而只得到Mn2+绿光发光[53-54]。
(5)在制备Mn4+激活氧化物荧光粉时,如何控制产物中只形成Mn4+价态是重中之重,但也是一个难点。作者在上述(3)、(4)之基础上进一步总结,认为可从以下七方面进行控制:第一,所选取基质化合物应含有可供Mn4+稳定掺杂的八面体配位结构;第二,设计Mn4+的掺杂取代格位为与其有效离子半径相近的四价阳离子格位,以形成等价取代;第三,为尽量避免Mn2+离子的形成,基质化合物中尽量不含有XO4配位四面体(X为2+阳离子,如MgO4四面体);第四,采取合适的合成方法(如先用溶胶凝胶法制备前驱体后再高温热处理[50])或反应原料(如制备MgAl2O4∶Mn4+荧光粉时采用高反应活性γ-Al2O3作为铝源[43]);第五,在氧化气氛下合成或在氧化气氛下退火处理[55];第六,不等价取代时,共掺杂电荷补偿剂(如在铝酸盐中掺杂时共掺杂Mg2+作为电荷补偿离子[56],Mn4++Mg2+→2Al3+);第七,将Mn的掺杂浓度控制在适量水平。
4 展 望
(1)高量子效率是决定所制备Mn4+激活荧光粉能否走入应用实践的关键之一。尽管本文中给出了一些高量子效率的文献实例,但总结的不够全面和深入。笔者仍期待未来有论文专门论述如何制备高量子效率荧光粉。
(2)在采用水热法制备氟化物荧光粉时,可获得高结晶度、特殊生长形貌(如花状、针状)和前驱体中含有室温难溶化合物(如BaF2)的氟化物荧光粉。但即使采用高浓度HF溶液为溶剂,无论以KMnO4还是以K2MnF6为锰源所合成不同Mn名义掺杂浓度的荧光粉一般都体色发白,意味着其所含Mn4+较少;在水热法合成的荧光粉中,是否存在其他价态的锰离子、所含Mn4+价态的比例达到多少,未见明确实验数据支撑;是否有办法提高其中Mn4+含量比例,值得研究。
(3)锰离子存在多价态问题,在所合成产物中少量Mn2+/Mn3+的存在即可对Mn4+发光的量子效率产生较大的负面影响。一方面,X射线吸收近边结构谱可用以定性及定量表征所合成荧光粉中锰离子的多种价态及其含量,但需要用到同步辐射光源。因为Mn2+离子在四面体或八面体配位结构中常可产生荧光,利用常见荧光光谱仪可定性表征荧光粉中Mn2+的存在;但Mn3+离子在很多结构中没有高效荧光(文献[55]报道Mn3+在石榴石结构中发射近红外光,通过阴极射线荧光光谱可探测),如何定性表征Mn3+离子尚未见有效且方便的手段。另一方面,为抑制荧光粉中Mn2+/Mn3+杂质离子的出现,在合成氟化物荧光粉时用K2MnF6为锰源并采用室温或低温合成方法,而在合成氧化物荧光粉时以水溶性锰源为原料并采用溶胶凝胶等合成方法,已初步证明可有效提高荧光粉产物中Mn4+的含量而有利于量子效率的提高。探索一些新的有效控制产物中锰离子为Mn4+进而提高其量子效率和蓝光吸收效率的方法,具有重要研究价值。
(4)考虑到氢氟酸的巨大危害性,如何在不使用氢氟酸条件下制备Mn4+激活氟化物荧光粉具有重要研究意义。但除了利用H3PO4/KHF2溶液或NH4F/HCl溶液取代氢氟酸溶液,以及利用KHF2作为熔盐采用熔盐法制备[57]的报道外,其他报道不多。是否有可能开发出合适锰源及绿色制备方法,前景不明朗。
(5)K2MnF6是当前制备氟化物荧光粉最重要的锰源,但其很容易潮解变质。一方面,需要在干燥环境中短时存储;另一方面,需要在氢氟酸溶液环境中使用。为了减小荧光粉合成过程中HF的环境危害性,开发相对室温而言的低温制备方法抑制HF向周围环境中挥发具有重要意义。
(6)相比于稀土离子的f-d跃迁,Mn4+离子d-d跃迁的吸收截面较低,导致其掺杂的荧光粉的吸收效率相对较低。如何实现高浓度Mn4+掺杂情况下不发生浓度猝灭进而提高荧光粉的蓝光吸收效率,是值得深入探究的问题。Mn4+掺杂荧光粉中临界猝灭浓度的高低,可能与由制备方法和Mn4+与被取代离子间价态/半径的匹配度等引起的产物中缺陷浓度(如空位和间隙原子等点缺陷)和Mn4+离子相对于Mn2+/Mn3+杂质离子的有效含量、以及[MO6]与[MnF6]基团间声子能量差异有关。比如,Garcia-Santamaria等[58]报道采用不同方法合成的K2SiF6∶Mn4+荧光粉的临界猝灭浓度彼此可相差3倍;Hasegawa等[50]报道分别采用高温固相法和溶胶凝胶法合成Li2TiO3∶Mn4+荧光粉,后者可使荧光粉中Mn4+有效含量从前者的89.4%提高到98.1%,该有效Mn4+含量的提高使荧光粉的内量子效率从9.6%大幅提高至31.6%。上述结果为实现荧光粉中高浓度Mn4+掺杂的进一步研究提供了重要参考。
(7)Mn4+激活氟化物荧光粉易潮解劣化([MnF6]2-水解为Mn(OH)4和MnO2)是影响其长期使用性能的关键问题。对荧光粉进行后处理(如有机包覆、无机包覆、基质自包覆、表面减Mn4+钝化等使Mn4+离子富集分布在晶体颗粒内部而较少分布在颗粒表面)、后加工(如将荧光粉烧结成陶瓷、将荧光粉与玻璃共烧成玻璃陶瓷体等)或者改变制备方法(如制备单晶荧光体),可显著提高其耐潮解劣化性[59-63]。而关于锰源的选择如何影响所合成荧光粉中[MnF6]2-基团的水解,目前未见深入报道。
(8)利用氟化物荧光粉制作荧光膜时,大粒径宽分布将难以制作厚度薄且均匀性好的荧光膜。如何选择适宜制备方法,制备球形度高、粒径分布狭窄、Mn4+掺杂含量高且在晶体颗粒内分布均匀的氟化物荧光粉,具有实用研究价值。
本文专家审稿意见及作者回复内容的下载地址:http://cjl.lightpublishing.cn/thesisDetails#10.37188/CJL.20210412.

