基于伤害性指数实时监测评价右美托咪定辅助臂丛阻滞麻醉镇痛效果
张思源,黄 毅,武京伟,赵 萌,王天龙,王小华
1.首都医科大学附属大兴区人民医院儿科,北京 102600;2.首都医科大学宣武医院麻醉科,北京 100053;3.首都医科大学宣武医院影像科,北京 100053;4.首都医科大学宣武医院创伤外科,北京 100053
疼痛会加重身体的应激反应,对内分泌和免疫功能产生影响,并进展为慢性疼痛[1-2],多模式镇痛是术中维持镇痛的常用方法[3]。通常,骨折患者焦虑和疼痛风险较高,目前上肢骨折手术首选麻醉方式是臂丛神经阻滞,但局麻药单独使用时无法提供有效全身镇痛效果,需联合使用静脉辅助用药,且多数临床试验应用清醒状态下视觉模拟评分(VAS)评价镇痛,不适用于镇静及全麻患者的镇痛评估。因此,为达到最佳的术中镇痛效果,研究静脉辅助用药的优劣,优化术中疼痛管理是目前的热点。
右美托咪定(DEX)是高选择性α2肾上腺素受体激动剂,具有镇痛、交感神经阻滞和抗焦虑作用,是一种相对较新的辅助镇痛麻醉药[4-5]。作为多模式镇痛的重要组成部分,DEX即使低剂量也能增强镇痛作用,并能有效抑制阿片类疼痛高敏和镇痛耐受,提供良好的术中镇痛,减少术后疼痛和阿片类药物需求[6-11]。同时,应用DEX辅助围术期疼痛管理时血流动力学稳定,不良反应小[8-11]。因此,DEX因独特的镇痛作用[12]而被广泛应用于临床。此前的研究中,DEX联合局麻药能强化周围神经阻滞,鞘注能有效控制膝关节镜术后患者关节疼痛,而全身给药有显著的镇痛作用,可用于清醒气管插管和术中镇痛[13-15]。
从无创脑电图(EEG)信号中获取的伤害性指数(index of consciousness 2,IOC2)可以作为判断镇痛深度的指标[16]。IOC2可有效评估全麻患者的镇痛状态、效果及强度[17-18]。IOC2的程度定量为0~99(镇痛状态越深时指数越低),IOC2<20提示镇痛过深(等电位脑电图),>90提示镇痛不足。研究发现,麻醉中可以通过IOC2实现镇痛深度监测,减少麻醉药的用量并优化苏醒时间[19-21]。因此,在外科手术中IOC2监测的重要性体现在:安全有效地评估镇痛效果,最大限度地减少不良反应,并加快麻醉复苏[19-23]。
到目前为止,暂无报道右美托咪定术中定性及定量的镇痛研究以及维持期内不良反应的研究,尤其是静脉注射DEX在神经阻滞期间的镇痛效能没有被详述。本研究前瞻性分析2020年12月—2021年6月首都医科大学宣武医院创伤外科接受上肢骨折手术的176例住院患者,采用Anegle6000镇痛监测仪的IOC2定量评估DEX及咪达唑仑(MID)的镇痛效果,比较手术患者中DEX的IOC2的达目标阈值(达标)的比例和时间,旨在确定DEX的镇痛作用及镇痛达标的时间,同时探讨DEX术中镇痛的安全性和耐受性。
临床资料
1 一般资料
纳入标准:(1)年龄18~80岁;(2)接受臂丛阻滞麻醉下上肢骨折内固定手术;(3) 美国麻醉医师协会(ASA)分级Ⅱ~ Ⅳ级;(4)体质量指数(BMI) 18.5 ~ 35kg/m2;(5) 手术时间3h以内;(6) 臂丛神经丛阻滞完全。排除标准:(1)ASA评级>Ⅳ级;(2)长期使用酒精、阿片类药物或其他镇静药;(3)既往曾对本次研究中的使用药物过敏;(4)术前经其他药物治疗(麻醉镇痛药); (6)收缩压持续<85mmHg或心率持续<45次/min;(7)阿尔茨海默病;(8)癫痫以及其他自主神经功能紊乱等疾病会影响脑电图结果的器质性脑病;(9)有植入式心脏起搏器。
本组共176例患者,随机分为右美托咪定组(DEX组89例)和咪达唑仑组(MID组87例)。本研究遵循《赫尔辛基宣言》[24],经笔者医院医学伦理委员会(IRB-XWAD-202008-12)批准,并在国际伦理委员会国际标准随机对照试验(http://www.ClinicalTrial.com)中注册(NCT-04675372)。患者及家属均签署知情同意书。
2 盲法和质量控制
本研究为随机、双盲、对照组研究。神经阻滞的操作及术中观察并记录不良事件的人员对试验分组均不知情。为保证研究数据分析的准确性和完整性,统计分析是独立执行的。另有独立的数据和安全监测委员会可以非盲访问数据,并定期审查安全结果。
3 方法
3.1操作过程 患者到达手术室,采用林格氏液8mL/kg静点,术中维持4mL/(kg·h)静点。采用无创血压测量、心电监测和脉搏血氧仪进行全面生命体征监测。患者仰卧位进行生命体征基线记录,测量前3个读数的平均值。IOC2可以连续监测并记录患者镇痛水平(Angel-6000D多参数麻醉监测器,深圳威好康医疗科技有限公司,中国广东),当IOC2评分降低到90分即为达标。同时监测并持续记录肌肉放松程度的肌松指数(EMG)。反映监测过程监测信号稳定性的质量指数(SQI)>99提示数据信号稳定,监测结果可靠。一旦确认臂丛神经阻滞效果完全,即给予研究药物,整个手术过程中每隔5min测量并记录1次收缩压(SBP)、舒张压(DBP)、平均动脉压(MAP)、心率(HR)及IOC2值。然后每5min记录一组试验数据,90min基本能覆盖记录到大部分手术患者的全部手术时间,一共15个时间点(T1~T15)。需要记录的不良反应:低血压(SBP<90mmHg或DBP<60mmHg)、心动过缓(HR<55bpm、低氧血症(血氧饱和度SpO2<93%)。当SpO2下降到93%以下时,即给氧2~4L/min 。记录者(对患者的试验分组不知情)会动态观察患者生命体征,并统一报告不良反应,若有药物剂量调整及其他药物使用也会一并记录。
锁骨上臂丛神经阻滞由超声引导联合神经刺激装置 (MultiStim SENSON,PAJUNK,d-78187,Gerdingen,德国)完成。当神经刺激装置提示注射器到达阻滞神经周围,即注射20mL罗哌卡因(3.5mg/mL;Naropin,JX20190083,阿斯利康AB,SE-151 85 Sodertalje,瑞典)。若上肢出现完全的运动和感觉阻滞代表神经阻滞成功,使用改良Bromage量表评估运动阻滞,当Bromage评分达到2分时,认为运动阻滞成功(上肢改良Bromage评分:0分,运动功能正常;1分,只有手指能动的能力;2分,完全运动阻滞,肘关节、手腕和手指不能活动)。采用针刺法(26G皮下针沿腋中线针刺)观察记录感觉阻滞水平,当手术区域完全没有疼痛感时,即感觉阻滞成功[25-26]。这些阻滞成功的患者被随机分配接受1.5μg/(kg·h)右美托咪定(H20090248,海博瑞制药,江苏连云港)或0.05mg/(kg·h)咪达唑仑(H10980025 Nhwa Phama,徐州)静脉维持输注。用药剂量按标准体重=(身高厘米数值-100)kg计算。药物均在预期手术结束前20min停用。即使在终止注射研究药物后,监测指标也被记录。
3.2研究试验终点 试验的主要疗效终点是IOC2达标的比率(目标阈值IOC2定义为90),同时笔者也在试验中关注两种药物的达标时间。本研究的次要终点是低氧血症、血流动力学改变和肌松指数(EMG)的综合指标。
3.3试验样本量计算 根据预试验收集的数据进行样本大小计算,本研究每组纳入患者至少83例[27]。
4 统计学分析
结 果
1 患者一般情况和基线特征
两组患者一般情况(年龄、性别、体重、身高、BMI、ASA分级)差异无统计学意义,手术时间、麻醉时间、术中输液量、失血量、手术分布差异无统计学意义(P>0.05),见表1。

表1 两组患者一般情况及监测基线指标比较
2 主要试验终点
试验研究IOC2的达标比率,同时对手术期间达标的时间也进行评估。DEX组74例(83.15%)患者IOC2达标,MID组18例(20.69%),从Kaplan-Meier生存曲线分析中(图1),采用Log-rank检验,确定DEX和MID两种干预措施的生存曲线差异有统计学意义(P<0.001)。对于IOC2达标时间,DEX组IOC2达标时间从MID组的48min降至13min (P=0.021)。DEX输注组的中位达标获得时间为14.00min,短于MID组的60.00min。综上,试验中实际观察到DEX组的达标比率和达标时间比MID组更高更快。
3 次要试验终点
DEX组89例患者中有2例(2.25%)发生低氧血症,MID组87例患者中有46例(52.87%)发生低氧血症(P<0.001,图2),DEX治疗的患者低氧血症的实际发生率低于MID组患者。且低氧血症平均持续时间DEX组为6min,MID组为12min(P=0.021),采用独立样本Mann-Whitney U检验DEX组低氧血症累积中位数和平均秩次分别为0.8、3.3。
两组患者在手术过程中血流动力学参数相对稳定,在整个手术过程中SBP、DBP和MAP的变化趋势相似,收缩压、舒张压、平均动脉压在T2及T10时间点均降低,但两组差异无统计学意义(图3c~e,P>0.05)。各记录节点的心率均值中,DEX组在T6、T7、T8、T11的心率值较MID低(图3a,P<0.001),DEX有减少心动过速的作用,从循环及心率方面体现降低患者紧张程度及交感过度兴奋的作用,但两组心率均在临床合理范围。手术期间,没有观察到任何受试者出现严重的低血压(MAP<65mmHg)或心动过缓(心率<45次/min)。
从T2至记录时间结束,DEX肌松指数较低,且DEX组肌松指数最初下降幅度大于MID组,两组肌松指数比较差异有统计学意义(P<0.010,图3b)。T10时,DEX组肌松指数从(相较于入室时的基值)53%下降到4% (P=0.033),提示右美托咪定能提供更好更持久的肌肉松弛作用。所有纳入研究的质量指数(SQI)始终维持在100。

图3 两组患者术中血流动力学及肌松散点图。a.患者术中心率; b.患者术中肌松指数; c.患者术中收缩压; d.患者术中舒张压; e.患者术中平均动脉压
4 亚组内分析
对于DEX组中IOC2达标比率存在显著性差异,进行亚组分析,进一步检测其影响因素。在DEX组的亚组分析中进一步检测IOC2达标的整体人群,包括性别、年龄、ASA评分和BMI变量。ASA(Ⅰ/Ⅱ)亚组比ASA(Ⅲ/Ⅳ)亚组的IOC2指数更容易达标(P=0.034,图4c)。但年龄、性别及BMI亚组分析中IOC2达标的时间和比率差异无统计学意义(图4a、b、d)。

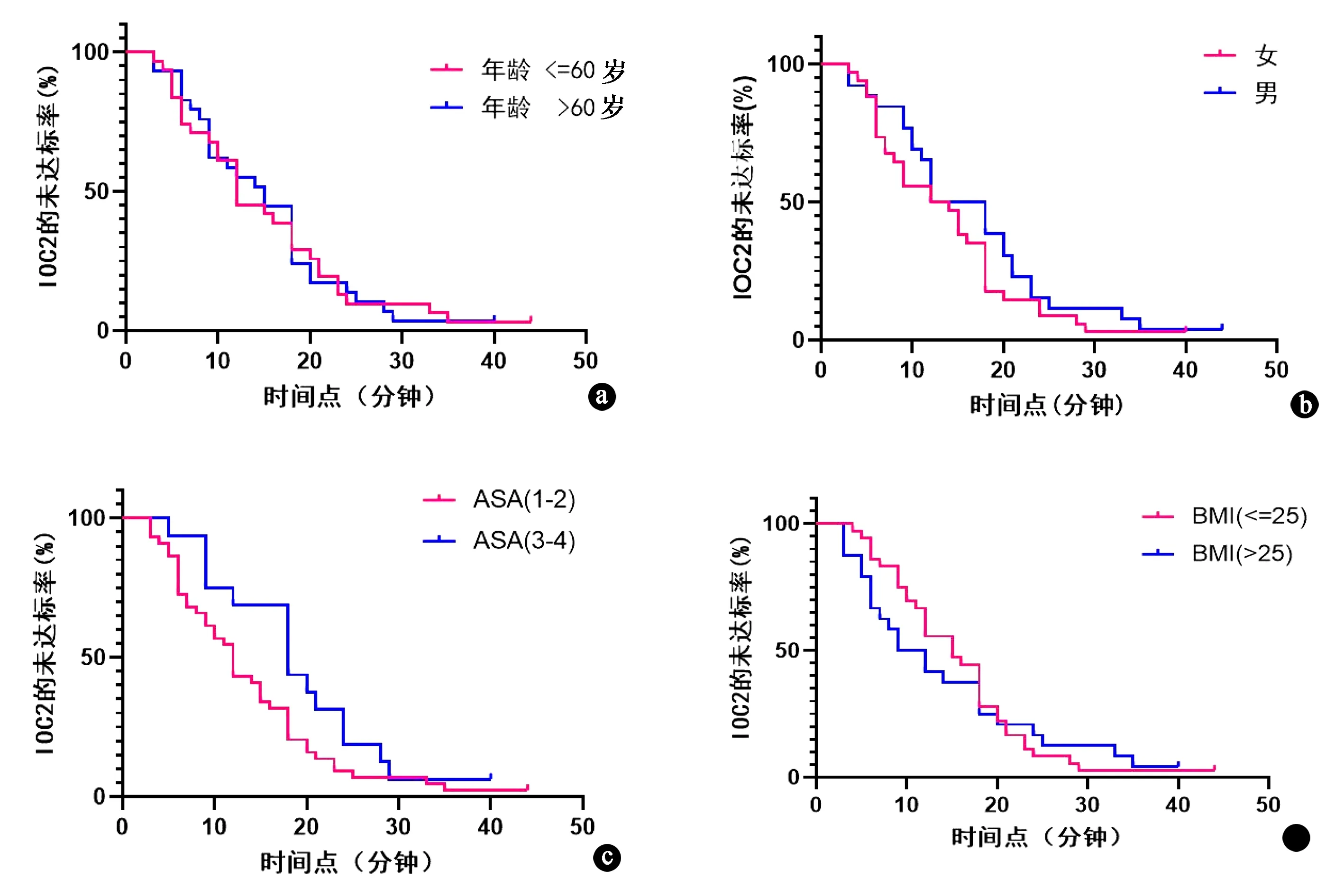
图4 DEX组亚组分析比例风险回归(COX)曲线。a.年龄亚组间COX曲线; b.性别亚组间COX曲线; c.美国麻醉医师协会(ASA)分级亚组间COX曲线; d.BMI亚组间COX曲线。
讨 论
本研究主要发现,在臂丛神经阻滞下静脉给予DEX的IOC2达标比率及速度相较MID更高更快,提示其显著的镇痛作用。
既往研究已证实全身使用DEX具有显著的镇痛作用[28-29],且有多种假说解释术中DEX的镇痛特性。(1)通过中枢介导的交感神经效应产生联合镇痛作用[30]。同时作用于突触前和突触后交感神经末端,从而减少交感神经外流和去甲肾上腺素的释放,产生镇痛和解交感作用[31-33]。(2)镇痛控制手术产生的强烈炎症反应。手术引起的疼痛反应非常复杂,包括伤害性炎性反应[16,34]。(3)通过作用于蓝斑[35]的中枢发挥镇痛作用。DEX能够改善传统的镇痛药物如阿片类药物不能改善的神经病变/神经源性疼痛成分[17-18,34,36]。(4)能够与突触前C纤维和脊髓后角突出后神经元结合[37-39],通过激活脊髓中的a2受体而具有镇痛作用[40]。(5)能抑制脊髓小胶质细胞和星形胶质细胞的活化,减少有害刺激引起的物质释放,进一步阻断慢性疼痛条件下脊髓神经元和神经胶质细胞之间的串扰,有效拮抗外周伤害感受器的激活,调节有害信息的传递,从而产生神经轴性镇痛作用[41],以及对局部血管收缩、神经的直接作用[42-44]。
本研究探讨了DEX的镇痛效果和安全性,DEX组没有出现低血压和心动过缓等不良反应。而且,与MID组患者相比,DEX组患者的镇痛效果更高效安全。关于呼吸抑制,超过1/2的MID患者出现低氧血症。而在本研究中,大多数DEX组患者的SpO2均维持在93%以上。综上所述,DEX术中使用的安全性和血流动力学的稳定性在相较于MID时优势突出。
此外,本研究也存在一些局限性:(1)虽然本研究在应用DEX时未出现明显不良反应,但未评价DEX联合阻滞对长期预后的影响,包括慢性疼痛和患者出院后满意度。需要更大规模的研究来排除未来任何短期或长期的不良影响。(2)纳入的研究人群大部分是相对健康和年轻的患者,对儿童患者或其他严重疾患人群影响尚未调查,未来的试验将会研究DEX对这些人群的影响。(3)DEX镇痛的脑网络或神经元水平的机制仍有待阐明。
总之,DEX相较MID作为术中神经阻滞的辅助镇痛用药在实际应用中是更优的选择,因为它提供更满意的术中镇痛效能,没有显著的血流动力学不稳定,术中呼吸抑制发生率极低。这些结果表明DEX具有显著的改善术中疼痛的作用。
作者贡献声明:张思源:资料收集、论文撰写、文献检索;黄毅、武京伟、赵萌:病例资料整理、统计学分析;王天龙:研究指导、论文修改、经费支持、数据整理;王小华:论文修改及审校、论文撰写、研究(内容)设计