口蹄疫O型LPB-ELISA免疫抗体高通量定性检测技术的建立
祁君 王丽

摘要:为提高偶蹄动物口蹄疫O型液相阻断酶联免疫吸附(LPB-ELISA)免疫抗体检测效率,优化动物疫情监测策略,提高动物疫病防控效能。结合基层一线对免疫质量评价实际需求及财力人力等因素,在该试验通用操作步骤基础上,特对操作步骤及96孔ELISA板检测样品布局进行了技术改进。改进后的1块ELISA板可检测样品80份,在检测通量上较试剂盒使用说明书标明1块ELISA板可检测样品10~20份增加到4~8倍,在ELISA板检测样品利用率上从10.42%~20.83%提高到83.33%,在检测费用、检测时效及人力成本上则可压缩4~8倍。同时,亦可减少试验废弃物产生量,有一定的社会效益及生态效益。改进后的口蹄疫O型LPB-ELISA免疫抗体高通量定性检测技术,适用于大样本情况下以免疫抗体合格率为指标的免疫质量评价工作,尤其对检测数量多、经费人员配置有限,且要求出结果快的基层一线,具有很好的现实操作性和借鉴性。
关键词:口蹄疫;LPB-ELISA;免疫抗体;高通量;定性检测
口蹄疫是由口蹄疫病毒引起的偶蹄动物急性、热性、接触性传染病,对畜牧业健康发展危害巨大,该病被世界动物卫生组织列入法定上报传染病[1]。2005年5月—2017年1月,我国共发布了125次口蹄疫疫情,主要为O型和A型,口蹄疫防控形势依然严峻[2]。目前,我国对口蹄疫采取强制免疫的防控政策,而提高免疫质量无疑是对该病防控最有力的措施之一。LPB-ELISA试验则是目前用于评价免疫质量方面普遍采用的技术,但该试验通用操作步骤较为繁琐,尤其是被检血清倍比稀释次数多、ELISA板利用率低,在进行大量样品检测时,需要配备较多检测人员及工作经费,开展工作耗时费力。有研究者就基层实验存在诸多不利的现实条件对兽医血清学试验方法进行了改进,今后如何在诸多不利条件下更加准确快速地开展血清学试验,仍有不断努力的空间[3]。本文在LPB-ELISA试验通过操作技术基础上,参照口蹄疫诊断技术标准(GB/T18935—2018),以定性需求为主要考量目的,合理设置被检血清稀释度(免疫抗体合格滴度),将被检血清多步倍比稀释步骤进行一步到位稀释改进,并对ELISA板检测布局进行了优化,建立起了基于以免疫抗体合格率为评价指标的口蹄疫O型LPB-ELISA免疫抗体高通量定性检测技术,为基层开展口蹄疫免疫抗体质量评价提供一种高效、快速、经济的检测方法。
1 材料与方法
1.1 材料
诊断试剂:10块装口蹄疫O型LPB-ELISA抗体检测试剂盒(内含:口蹄疫O型病毒抗原、口蹄疫O型豚鼠抗体工作液、兔抗豚鼠IgG-HRP工作液、口蹄疫O型阳性对照血清、口蹄疫阴性对照血清、25倍PBST浓缩液、终止液、TMB底物A溶液、TMB底物B溶液、兔抗包被ELISA板、U型96孔抗原抗体反应板、移液槽、封板膜),由兰州兽研生物科技有限公司生产,自制去离子水或蒸馏水;主要器材:酶标仪、洗板机、微量振荡器、生化恒温培养箱、冷藏柜、96孔血清稀释板(加样槽)、量筒(10、100、1,000mL等不同规格)、微量可调移液器(5、10、50、100、200、300、1,000μL等不同规格)、吸水纸巾、锡纸;被检样品:偶蹄动物血清。
1.2 方法
1)试剂准备。稀释PBST浓缩液:将25倍PBST浓缩液用去离子水或蒸馏水稀释成1倍PBST(1份浓缩液加24份去离子水或蒸馏水进行稀释),用于洗板或稀释血清和病毒抗原。
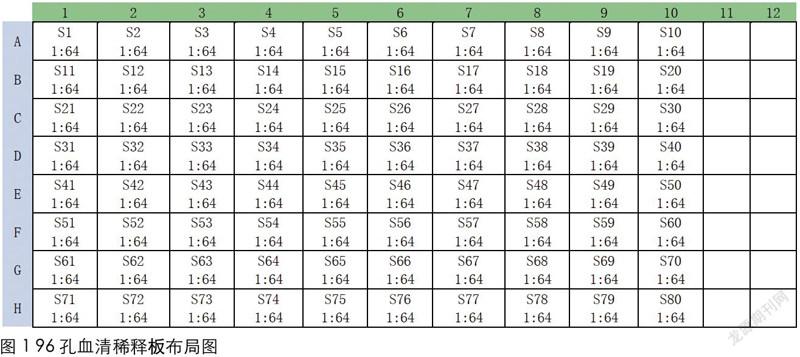
2)试验程序。①稀释被检血清:被检血清稀释布局如图1所示,在96孔血清稀释板第1~10列每孔各加315μL的1倍PBST,每孔再各加5μL的被检血清后混匀,此时每孔被检血清的稀释度为1:64。
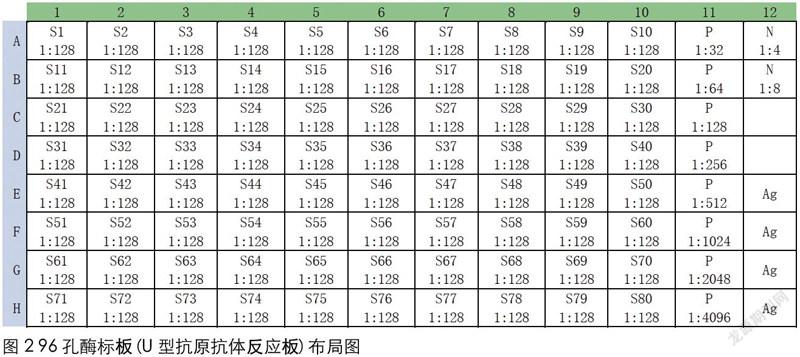
②平移稀释后的被检血清并稀释阴阳性对照血清。将稀释度为1:64的被检血清以50μL/孔的量,从96孔血清稀释板按次序平移至U型抗原抗体反应板上。在U型抗原抗体反应板第11列每孔各加50μL的1倍PBST,在第11列A11孔加50μL的阳性对照血清,然后吹打3次,以50μL/孔沿列连续倍比稀释至H11孔后弃去50μL液體,由于阳性对照血清在厂家生产时已预先作了8倍稀释,此时第11列8个孔的阳性对照血清稀释度则为1:16~1:2048。在第12列A12到B12两个孔每孔各加50μL的1倍PBST,在A12孔加50μL的阴性对照血清,然后吹打3次以50μL/孔连续倍比稀释至B12孔后弃去50μL液体,此时A12到B12两个孔阴性对照血清的稀释度则为1:2~1:4。
③加病毒抗原。将病毒抗原用1倍PBST稀释至工作浓度后,以50μL/孔的量加入到U型抗原抗体反应板上的被检血清、阴阳性对照血清的稀释孔内。如图2所示,由于加入了等量的病毒抗原液体,此时被检血清的稀释度则从1:64变为1:128,阳性对照血清的稀释度则从1:16~1:2048变为1:32~1:4096,阴性对照血清的稀释度则从1:2~1:4变为1:4~1:8。同时,在第12列E12到H12四个孔每孔仅加100μL稀释至工作浓度的病毒抗原。封板震荡,4℃静置过夜或37℃孵育90min。
④平移U型板内液体。将U型板内各孔液体以50μL/孔的量按次序平移至兔抗包被ELISA板上,封板,37℃孵育60min。
⑤洗板加豚抗。洗ELISA板6次,在吸水纸巾上甩拍干,以50μL/孔的量均加口蹄疫O型豚鼠抗体工作液,封板,37℃孵育60min。
⑥洗板加兔抗。洗ELISA板6次,在吸水纸巾上甩拍干,以50μL/孔的量均加兔抗豚鼠IgG-HRP工作液,封板,37℃孵育60min。
⑦洗板加底物溶液。洗ELISA板6次,在吸水纸巾上甩拍干,将TMB底物A溶液和B溶液以1:1比例混匀,以50μL/孔的量均加混匀后的底物溶液,封板,37℃温育15min进行显色反应。
⑧加终止液并读值。以50μL/孔的量均加终止液,混匀后在酶标仪上读取OD450nm值。
3)试验成立条件。每块ELISA板设4孔病毒抗原对照,病毒抗原对照至少两孔OD450nm值在1.0~2.0范围内,阳性血清对照抗体滴度应在1:512~1:2048之间,阴性血清对照抗体滴度应小于1:4。
4)结果判定。以病毒抗原对照OD450nm平均值的50%为临界值(对照值),被检血清稀释孔OD450nm值大于临界值的为阴性孔,小于或等于临界值的为阳性孔。被检血清抗体滴度大于或等于1:128判为阳性(免疫抗体合格),被检血清抗体滴度小于1:128判为阴性(免疫抗体不合格)。
2 结果与分析
从表1可看出,在检测通量上,改进后的1块ELISA板可检测样品份数较试剂盒使用说明书原有布局增加到4~8倍,在检测样品ELISA板利用率上则大幅度提高到83.33%。同时,在检测试剂盒费用、检测时效及人力成本上则可压缩4~8倍,也可减少诊断液及相关耗材等试验废弃物产生量,有较为积极的社会效益及生态效益。
3 讨论
3.1 关于定性检测与定量检测的适用性
就目前基层一线对口蹄疫免疫质量评价而言,主要是基于农业农村部所要求的免疫抗体合格率这一指标来评价偶蹄动物口蹄疫免疫质量的。免疫抗体合格率大于等于70%的畜群,则表明免疫质量较高,一定范围内建立起了有效的免疫屏障,在免疫期内牲畜对口蹄疫疫病具有较强的免疫持久性和保护力。免疫抗体合格率小于70%的畜群,则表明畜群免疫质量较差,存在较大的疫病传播风险,提示需强化免疫。因此,在此评价指标和实际工作考量下,合格或不合格则是免疫抗体检测的关键,此评价只需定性结果,无需具体抗体滴度。本文所建立的口蹄疫O型LPB-ELISA免疫抗体高通量定性检测技术,则能很好地适用于基于此指标下大样本的定性检测需求,也类比适用于A型和亚洲I型LPB-ELISA免疫抗体的定性检测。一个好的疫病防控路线,一定是综合权衡技术、财力、人力、推行难易程度等社会各个因素来制定的,而不是单纯只考虑某一因素,从这个角度来说,本定性检测技术也是与基层一线实际情况紧密结合,是基层用于口蹄疫免疫质量评价很好的选择。也有研究者针对地方外调畜数量大、检测量多的实际情况,以另一个思路对口蹄疫LPB-ELISA方法进行了改进,也取得类似本文改进后的良好效果[4]。汤天元等[5]对5块装口蹄病毒O型LPB-ELISA抗体检测试剂盒操作步骤进行了改进,改进后的每份样品检测成本由原来32~16元降低到4元,这也与本文改进后可压缩检测费用4~8倍相吻合。而对于研究分析免疫抗体消涨、抗体滴度高低分布及小样本的检测等工作时,则适宜选择试剂盒说明书中的定量检测技术。
3.2 关于血清稀释比例及抗体滴度合格值的设定
考量到微量移液器精度、吸头质量、血清稀释板孔容量、基层单位操作人员娴熟程度等,将被检血清稀释设定为315μL的1倍PBST加5μL的被检血清,一步将血清稀释到1:64,此稀释方案适合于基层普通操作人员和操作设备。也可将血清的稀释设定为157.5μL的1倍PBST加2.5μL的被检血清,此血清稀释方案则对操作人员和设备提出的要求较高,对基层来说不宜采用,而对于各方面条件成熟者,亦可尝试采用此稀释方案。对于630μL的1倍PBST加10μL的被检血清的稀释方案,则稀释液体体系过大,对血清稀释板孔容量有较高的要求,且操作不便,不宜采用。另外,参照国标,将1:128设定为抗体滴度合格值,对于大样本下的定性检测现实工作来说,介于1:128~1:64之间的疑似结果极少,从统计学的角度来说,极少的疑似结果对免疫抗体合格率的统计影响可忽略不计,从提高免疫质量的角度来说,即使有较多样品免疫抗体滴度处于疑似区、游走于合格线附近,表明免疫对象免疫抗体水平衰减厉害,免疫质量不高,对疫病起不到很好的保护力,亦需强化免疫。因此,未设定疑似血清稀释滴度,对于血清免疫抗体滴度小于1:128的,直接判定为免疫抗体不合格。
3.3 关于试验操作注意的关键点
LPB-ELISA试验操作繁琐,周期长,需要注意的事项多,操作中稍有不慎就会导致试验结果发生偏差或试验失败[6]。在检测前,要将试剂盒和被检血清恢复至室温状态,打开ELISA板真空包装膜后需尽快用完,在操作中要保持ELISA板底部不被脏物污染,确保酶标仪读数准确,要避免同一厂家不同批次、不同厂家的试剂混合使用;有研究者对该试验的测量不确定度在严格控制反应时间、反应温度等因素下进行了评估,找出影响检测质量的主要因素为酶标仪的测量和1:128稀释倍数下的样品浓度,其对不确定度影响最大[7],而本文一步稀释法所加入的被检血清只有5μL,量极少,易导致加样量不准,因此要严格加样操作,且在加入后要充分混匀,保证稀释比例准确,对于酶标仪要定期检定校准,加强日常维护管理,规范操作,在检测时可提前打开酶标仪运行数分钟待稳定后再行检测;TMB底物溶液的保存、配置、加样等环节须做好避光措施,且现用现配,如出现溶液变色则弃之勿用;眼观底物显色情况,结合操作经验,灵活掌握显色时间,可对其进行适当调整,显色时间过长或过短,都可能会导致试验条件不成立;终止反应后,要尽快对ELISA板读值,一般情况下拖延读值时间不宜超过30min。
4 结论
口蹄疫O型LPB-ELISA免疫抗体高通量定性检测技术,一块ELISA板可定性检测样品80份,能很好地服务于检测数量多、且要求出结果快的基层一线,对基层技术人员具有很好的实用性和借鉴性。同时,可大幅度节约检测费用、降低人力成本,对保护环境也具有积极作用。
参考文献:
[1] 王世杰,王新春,卢菲,等.O型口蹄疫病毒抗体高通量液相阻断CLIA检测方法的建立[J].生物学杂志,2017,35(6):102-103.
[2] 赵柏林,孔冬妮,楊林.我国口蹄疫研究进展[J].中国动物检疫,2017,34(7):67-69.
[3] 贺鹏程.基于基层实验条件的几种兽医血清学试验方法改进[J].畜牧兽医杂志,2018,37(6):95-96.
[4] 张雁,刑作志.外调猪、牛和羊口蹄疫液相阻断ELISA免疫抗体检测方法的改进和应用[J].国外畜牧学(猪与禽),2019,39(12):50-52.
[5] 汤天元,赵永虎.口蹄疫抗体检测试验的试验设计[J].中兽医学杂志,2019(3):20.
[6] 孙燕,董洪英,骆璐,等.监测口蹄疫抗体的液相阻断ELISA法的改进和体会[J].中国动物检疫,2012,29(4):58-59.
[7] 杜鹃.口蹄疫病毒O型抗体液相阻断ELISA试验的测量不确定度评估[J].中国动物检疫,2018,35(4):82-87.

