外源赤霉素和缩节胺处理对伸长期甘蔗关键酶活性的影响
莫善平,陈荣发,范业赓,丘立杭,周慧文,周忠凤,闫海锋,邓宇驰,罗 霆,吴建明
(广西壮族自治区农业科学院甘蔗研究所/农业农村部广西甘蔗生物技术与遗传改良重点实验室/广西甘蔗遗传改良重点实验室/中国农业科学院甘蔗研究中心,广西南宁 530007)
0 引言
甘蔗是我国最重要的糖料作物,蔗糖占中国食糖总产量90%以上,因此,甘蔗对中国的食糖供给和产销平衡起到举足轻重的作用。甘蔗是以收获地上茎为主的糖料作物,适当调控节间伸长的比例是决定产量和糖分的关键。因此,深入研究甘蔗节间伸长相关酶动态变化的机理,对于提高甘蔗和蔗糖产量有重要意义。潘有强等[1-3]研究甘蔗节间Mg2+、ATP酶活性、蛋白质含量与节间生长的关系,结果表明,从+2到+8节间,不同基因型节间长度的变化极为相似,从+3到+5、+8节间,不同基因型的3种Mg2+、ATP酶活性、溶性蛋白质、细胞壁离子型结合蛋白质、细胞壁共价型结合蛋白质都逐渐下降,而可溶性总糖含量逐渐提高;甘蔗节间的α-葡萄糖苷酶和POD和β-半乳糖苷酶活性负调控节间伸长,α-半乳糖苷酶、β-葡萄糖苷酶活性正调控节间伸长,钙调素和β-甘露糖苷酶变化趋势为单峰型[4]。前人研究结果表明,甘蔗节间相关酶在节间伸长过程中起着十分重要的作用,但其作用机理还未明确。
据Hamano等[5]研究表明,赤霉素可以促进卷心菜茎伸长和花蕾的伸长;Ross等[6]研究也表明,赤霉素伸进野生豌豆茎的伸长。许多研究均表明,赤霉素最突出的效应是刺激甘蔗茎的伸长[7-9]。缩节胺是赤霉素(Gibberellin,GA)生物合成抑制剂,通过降低内源GA水平减缓细胞伸长率及细胞分裂速率,进而缩短植株节间长度,使株型紧凑,防止植物旺长。因此,为了进一步揭示甘蔗节间伸长过程相关酶调控的生理机制,本研究以桂糖42号甘蔗品种为研究材料,通过分析赤霉素处理、缩节胺处理和清水处理三者的相关酶活性变化,以期为甘蔗节间伸长化学调控提供生理技术支持。
1 材料与方法
1.1 试验材料准备
试验在广西壮族自治区农业科学院甘蔗研究所进行。供试材料为节间较长的甘蔗优良品种“桂糖42号”。2016年3月1~2日,选取桂糖42号芽体完好的蔗茎,将甘蔗砍成单芽茎段,并进行52℃恒温水浴30 min脱毒处理,然后放进沙盘中进行育苗。随后,选取株型和长势相当的二叶龄甘蔗幼苗移栽到塑料黑桶中(内径35 cm,高50 cm),栽培的土壤营养状况为碱解氮89.6 mg/kg、有效磷48.82 mg/kg、速效钾125 mg/kg、有机质25.6 g/kg、pH 5.38,每桶移栽甘蔗幼苗3株,用土量为20 kg,并以20 g复合肥作为基肥。缓苗5天后,随机分为3组进行叶面喷施植物生长调节剂处理,选用GA3和DPC的浓度均为200 mg/L,以喷施清水为对照。待甘蔗长至12~13叶龄时,即伸长初期,选取长势一致的甘蔗开始进行叶面喷施处理,以叶面欲滴水珠为度。分别于喷药后第3、6、12和24天随机采取各个处理的3株甘蔗新生的第一片真叶,每株甘蔗作为1个重复,擦净后迅速投入液氮处理10 min,然后转入-80℃超低温保存,用于植物酶活性的测定。
1.2 试验方法
1.2.1 株高的测定
随机选择10株甘蔗,于处理后第3、6、12和24天测定清水对照、GA3和DPC处理后的甘蔗株高。
1.2.2 酶活性的测定
采用酶联免疫吸附分析法(Enzyme-Linked Immunosorbent Assay,ELISA)测定植物NAD激酶(NADK)、钙调素(CAM)、蛋白激酶(CDPKs)、过氧化氢酶(CAT)、过氧化物酶(POD)、木葡聚糖内糖基转移酶(XTH)和木葡聚糖内转糖苷酶(XET)的活性;采用分光光度法测定N-乙酰-β-D-葡萄糖苷酶(NAG)、α-半乳糖苷酶(α-GAL)、α-甘露糖苷酶(α-Manase)、α-葡萄糖苷酶(α-GC)、β-半乳糖苷酶(β-GAL)、β-甘露糖苷酶(β-Manase)、β-葡萄糖苷酶(β-GC)、果胶酶(Pectinase)和纤维素酶(Cellulase,CL)的活性;每个处理3次重复,技术重复测定3次。
1.3 数据分析
用Microsoft Excel 2019整理数据,用DPS 16.05软件进行数据方差分析和LSD法显著性检验,用GraphPad Prism 8.2作图,图表中的数值为均值±标准差。
2 结果与分析
2.1 外源GA3和DPC处理对甘蔗株高的影响
植物生长调节剂与甘蔗生长发育密切相关,外源GA3和DPC处理对株高的调控作用正好相反,甘蔗株高表现为GA3>CK>DPC(图1)。与同期叶面喷施清水对照(CK)相比,外源GA3处理后第3、6、12和24天的株高分别高于对照3.06%、17.58%、29.54%和18.51%,其中处理后第6、12和24天差异达显著水平;而外源DPC处理后的株高一直低于对照,处理后第3、6、12和24天的株高分别低于对照1.27%、7.85%、8.07%和4.52%(图1)。

图1 喷施赤霉素和缩节胺对甘蔗株高的影响
2.2 外源GA3和DPC处理对甘蔗节间伸长过程中信号传导因子的影响
由图2可知,GA3处理明显提高了NADK的活性,与同期叶面喷施清水对照(CK)相比,处理后第3、6、12和24天的NADK分别高于对照14.68%、7.83%、14.26%和10.06%;而DPC处理在第3天高于对照,在后面的时期却明显低于对照。对照处理、GA3处理和DPC处理的CAM活性都呈现先下降后上升的趋势,GA3和DPC处理高于对照,GA3处理在第24天最高,GA3处理后第3、6、12和24天的CaM分别高于对照9.73%、13.32%、47.96%和33.21%,DPC处理后第3、6、12和24天的CaM分别高于对照14.61%、9.44%、21.32%和17.52%;对照、GA3和DPC的CAM呈现先下降后上升趋势,而GA3在第24天最高,且高于其他处理。GA3处理的CDPKs活性在第3天低于对照,随着时间的增长明显提高了CDPKs活性且高于对照,处理后第6、12和24天分别高于对照3.95%、5.70%和2.56%; 而DPC处理在整个时期均低于对照。

图2 喷施赤霉素和缩节胺对甘蔗节间伸长过程中信号传导因子的影响
2.3 外源GA3和DPC处理对甘蔗节间伸长过程中糖苷酶的影响
糖苷酶与植物细胞生长发育过程中壁的松驰或 加固有关,还与植物细胞的识别和一些信号分子的产生相联系[10]。由图3可以看出,整个处理期3个处理的α-GC活性呈现下降趋势,对照与GA3处理的α-GC活性较为一致,而DPC处理却明显提高了α-GC活性;β-GC活性呈现上升趋势,而GA3处理明显抑制了β-GC活性,处理后第3、6、12和24天的β-GC活性分别低于对照21.24%、28.37%、20.29%和13.75%,而DPC处理却提高了β-GC活性,处理后第3、6、12和24天的β-GC活性分别高于对照7.33%、3.86%、2.64%和9.98%。GA3处理的α-Manase活性呈现一个先上升后下降再上升的趋势,处理后第24天达到峰值,为129.76 nmol/min/g.FW;而DPC处理α-Manase活性虽然呈上升趋势,但是整个处理期都低于对照,说明DPC处理对α-Manase活性有抑制作用。整个处理期对照和DPC处理的β-Manase活性整体呈现先下降后上升的趋势,而GA3处理呈现整体上升后下降趋势,处理后第12天到达峰值,为52.0 nmol/(min.g).FW,处理后第12天和第24天达显著水平。
2.4 外源GA3和DPC处理对甘蔗节间伸长过程中胞壁松弛因子的影响
植物细胞要进行扩大生长,细胞壁就必须在一些酶蛋白的作用下进行修饰,引起细胞壁网络结构松弛的主要因子有膨胀素、木葡聚糖内糖基转移酶/水解酶(XTH)、纤维素酶(CL)、果胶酶(Pectinase)、过氧化氢酶(CAT)、过氧化物酶(POD)等[11]。由图4可以看出整个处理期对照、GA3和DPC处理的CAT活性呈现上升趋势,而GA3处理明显抑制了CAT 活性,始终低于对照,处理后第3、6、12和24天的CAT活性分别低于对照13.62%、13.28%、11.93%和5.92%;而DPC处理却提高了CAT活性,效果不明显。GA3处理对POD活性的影响呈现先下降后上升的趋势,处理后第3天低于对照,处理后第6~24天提高了POD活性,高于对照,且在处理后第24天到达高峰,整体来说GA3处理对POD活性变化影响不明显,而DPC处理则明显抑制了POD酶的活性。GA3处理明显提高了XTH活性,在处理后第3、6、12和24天的XTH活性分别高于对照27.39%、29.74%、32.58%和23.93%,而DPC处理抑制了XTH酶的活性。GA3和DPC处理对果胶酶活性影响不大,3个处理呈现平稳态势,在处理后第3天GA3和DPC处理对果胶酶活虽然有所提高,但并不明显,在处理后第6~24天GA3处理的果胶酶活性低于对照,而DPC处理出现先升后降趋势。整个处理期对照、GA3和DPC处理的XET活性呈现上升趋势,而GA3处理明显抑制了XET酶活性,GA3处理后第3、6、12和24天的XET活性分别低于对照24.27%、25.86%、8.72%和6.63%;DPC处理明显提高了XET酶活性,DPC处理后第3、6、12和24天的XET活性分别高于对照43.97%、62.63%、63.15%和40.96%。整个处理期对照、GA3和DPC的CL活性呈现上升趋势,而DPC处理明显抑制了CL酶活性,DPC处理后第3、6、12和24天的CL活性分别低于对照16.28%、36.46%、26.97%和16.82%;GA3处理明显提高了CL酶活性,GA3处理后第6、12和24天的CL活性分别高于对照19.40%、13.01%和11.60%,在处理后第24天到达峰值,为757.57 nmol/(min.g).FW。
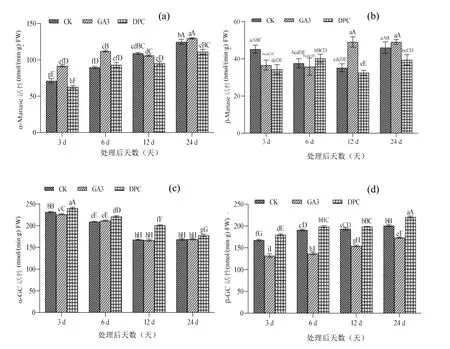
图3 喷施赤霉素和缩节胺对甘蔗节间伸长过程中糖苷酶的影响
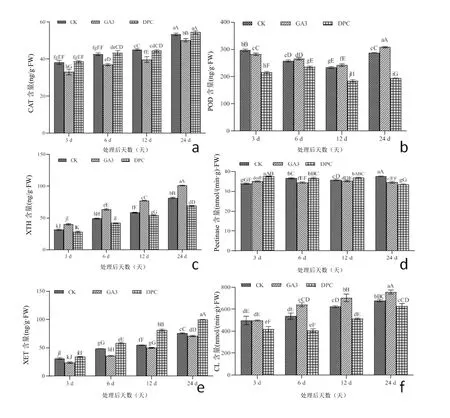
图4 喷施赤霉素和缩节胺对甘蔗节间伸长过程中胞壁松弛因子的影响
3 讨论
3.1 外源GA3和DPC处理下信号传导因子与甘蔗节间伸长的关系
钙调素(CaM)、NAD激酶(NADK)和钙依赖蛋白激酶(CDPKs)是细胞内信号传导的主要组分或起参与调节作用。NADK是受钙调素(CaM)激活的重要酶之一[12],钙调素(也称钙调蛋白)是一种广泛存在于真核生物中的钙感受器, 参与各种生理活动的信号转导。CaM生理功能的研究涉及面相当的广泛,参与调控多种的生理功能。早期研究表明,外源CaM具有促进花粉萌发及花粉伸长,并能诱导特定基因的生理功能[13]。随后研究还发现,花柱细胞外CaM对花粉在柱头上的萌发起促进作用,对花粉管的伸长起促进作用[14-15]。本研究中3个处理发现CaM含量在处理后3天开始下降,然后在处理后6天随着甘蔗节间伸长的生长而增加,到处理后24天GA3处理达到高峰,说明可能CaM动态性地响应细胞质Ca2+浓度的变化,最终产生刺激特异性的生理反应达到促进伸长的目的,CaM对于伸长起促进作用;这与前人研究CaM对花粉管的伸长起促进作用的结果相似。而DPC处理的CaM含量仍然高于对照却低于GA3处理,这可能是外源刺激影响了CaM的活性,却达不到GA3处理的效果。
NADK是植物细胞内CaM被Ca2+活化后所作用的重要靶酶之一。有研究表明在豌豆根尖伸长过程中,NADK活性和CaM含量都随着伸长过程而变化[16]。王小菁等研究指出,红光处理在引起绿豆下胚轴线粒体NADK活性增加的同时,胞质中活性CaM含量也相应增加[17]。到目前为止,还没有直接研究证明NADK与节间伸长的关系。本研究结果表明,GA3处理明显提高了活性,且随着甘蔗节间伸长的生长呈现显著增加的趋势,而DPC处理的NADK活性低于对照;这说明,NADK可能通过影响甘蔗体内的CaM含量或活性氧物质进而调控甘蔗节间伸长。
CDPKs参与调控赤霉素(Gibberellin,GA)生物合成或信号通路[18]。CDPKs参与GA合成主要是通过影响GA20-氧化酶(GA20ox)和GA3-羟基化酶(GA3ox)来调控活性GA的合成。植物CDPKs参与了植物细胞肌动蛋白张力的调节、气孔开放特征和植物的生长发育调节等[19-21]。CDPKs参与调控植物开花、花粉萌发及花粉管生长、种子发育等过程[22]。本研究结果表明,甘蔗幼茎的钙依赖蛋白激酶(CDPKs)活性随着节间伸长的生长呈显著增加的趋势,GA3处理明显提高了CDPKs的活性,而DPC处理的CDPKs活性虽然随着节间伸长的生长呈增加趋势,但仍然低于对照处理;这说明GA3处理正调控了钙依赖蛋白激酶(CDPKs)活性,DPC处理对CDPKs活性起到负调控作用。
3.2 外源GA3和DPC处理下糖苷酶与甘蔗节间伸长的关系
细胞壁的松弛是细胞伸长所必需,糖苷酶与细胞壁的松弛与延长[21]。本研究结果也发现,GA3处理的α-甘露糖苷酶(α-Manase)和β-甘露糖苷酶(β-Manase)活性呈现一个先上升后下降的趋势,分别在处理后第24天和第12天达到峰值,且显著高于对照,说明GA3提高了α-Manase和β-Manase的活性;而DPC处理明显抑制了α-Manase和β-Manase的活性。GA3处理明显抑制了α-葡萄糖苷酶(α-GC)和β-葡萄糖苷酶(β-GC)活性,尤其是β-葡萄糖苷酶(β-GC)活性显著低于对照;而DPC处理却明显提高了α-葡萄糖苷酶(α-GC)和β-葡萄糖苷酶(β-GC)活性。说明α-甘露糖苷酶和β-甘露糖苷酶可能也通过影响细胞壁的松弛对甘蔗节间伸长具有正调控作用,但是它们作用时间和影响效果有差异。而α-葡萄糖苷酶(α-GC)和β-葡萄糖苷酶(β-GC)的活性正好相反,随着甘蔗节间伸长而下降,但从未伸长期到伸长初期显著下降后趋于平稳,说明α-葡萄糖苷酶(α-GC)和β-葡萄糖苷酶(β-GC)在甘蔗节间伸长过程起着负调控的作用,但是作用时间主要是在未伸长期到伸长初期。
3.3 外源GA3和DPC处理下细胞壁松弛因子与甘蔗节间伸长的关系
植物节间的伸长是植物组织生长的结果,而植物细胞的伸长受制于细胞壁,植物要生长必须使细胞壁松驰与延长。植物细胞壁的松弛与伸展在调控细胞延伸生长方面具有重要作用[22]。研究还发现细胞壁松弛与延长还与羟基自由基(OH.)、H2O2等活性氧(ROS)对细胞壁多聚糖的切割有关[23-25]。植物体内O2-可以在POD作用下与H2O2反应生成OH.[26],细胞壁中POD参与OH.形成[27]。H2O2处理细胞壁会使植物细胞壁中的自发荧光强度增强,酚类物质含量增加,从而增加细胞壁硬度,阻止细胞壁延伸[28]。而过氧化氢酶(CAT)活性与H2O2的活性氧有关[29-31]。POD、CAT是植物体内清除O2-和H2O2的重要保护酶,对H2O2的清除是促进植物代谢正常进行的基础。陈芬[32]研究发现重瓣大花萱草喷施不同浓度赤霉素(GA3)处理均可提高花芽过氧化物酶(POD)活性,抑制过氧化氢酶(CAT)活性。
纤维素酶(Cellulase,CL)和果胶酶(Pectinase)是细胞壁重要的水解酶。有研究表明,促进细胞伸长是由于IAA促进H+分泌到细胞壁中并激活细胞壁中的纤维素酶,从而诱导纤维素降解导致细胞壁松弛所致[33]。本研究结果表明,纤维素酶活性随着甘蔗节间伸长而增加,GA3处理显著提高了纤维素酶的活性,差异达到显著水平;而DPC处理却抑制了纤维素酶活性,说明纤维素酶可能通过影响纤维素降解导致细胞松弛进而影响甘蔗节间伸长。果胶酶在节间伸长不同时期差异不大,GA3和DPC处理对果胶酶影响不大,3个处理在节间伸长期间无明显差异,说明其对甘蔗节间伸长的影响不大。
木葡聚糖内转糖苷酶(XET)和水解酶(XTH)广泛地存在于植物的各种组织和细胞中,是植物细胞壁重构过程中的关键酶[34]。相关研究表明,木葡聚糖内转糖基酶(XET)对于细胞壁松弛非常重要,在细胞的伸长中起主要作用[23,35]。在赤霉素 GA3 诱导下,莴苣和黄瓜下胚轴、豌豆节间和大麦叶片伸长生长的过程中,XET的酶活性显著增强[36]。这说明在植物生长过程中 XTH 参与细胞壁松弛引起的细胞扩展伸长。本研究结果也表明,木葡聚糖内糖基转移酶(XET)和水解酶(XTH)是随着甘蔗节间伸长而增加,GA3显著提高了XTH活性却抑制了XET的活性,DPC却显著提高了XET活性,抑制了XTH活性。说明木葡聚糖内糖基转移酶(XET)/水解酶(XTH)在调控甘蔗节间伸长过程中起着重要作用,而在GA3处理下更能有效提高XTH活性。
活性氧(Reactive Oxygen Species,ROS)是植物生长发育的重要调控因子,并直接参与细胞壁松弛和变硬的可塑性变化,影响细胞壁的特性,进而调节细胞的生长[28,37],而过氧化氢酶和过氧化物酶均与活性氧(ROS)密切相关[38-39]。据研究不同条件下向日葵种子萌发过程中胚根伸长速率与活性氧清除系统中各酶的相关性表明:胚根的伸出与过氧化氢(CAT)活性呈显著正相关[40]。之前我们的研究结果也表明,GA3处理后甘蔗节间得到伸长,过氧化氢酶也得到提高[39]。这些研究结果表明,过氧化氢对细胞或组织伸长具有促进作用。本研究结果也验证了这个观点,对照中CAT酶活性随着甘蔗节间伸长而增加,虽然GA3处理抑制了CAT酶活性,DPC处理提高了CAT酶活性;说明,甘蔗伸长期是启动植物生长的重要时期,植物体内代谢旺盛,产生的自由基增多,在这个时期甘蔗体内诱导合成了更多的CAT,去清除产生的大量自由基再到促进节间伸长的目的。过氧化物酶具有氧化分解吲哚乙酸的功能[41-42],由于IAA在调节植物细胞伸长、顶端优势、生根、休眠、春花作用等方面具有重要作用,因此过氧化物酶与吲哚乙酸之比对植物的生理作用非常关键[43]。而相关的研究结果也表明,高粱、小麦、玉米伸长节间的过氧化物酶活性与株高呈负相关[43-45];而我们之前的研究结果也表明,GA3处理后甘蔗节间得到伸长,过氧化物酶活性也相当下降。而本研究结果表明,甘蔗不同伸长期POD活性呈现先下降再上升的过程,在处理后24天前与甘蔗伸长呈现负相关关系;GA3处理有提高POD活性的效果,而DPC处理逐步抑制POD活性。这与前人研究高粱、小麦、玉米、甘蔗过氧化物酶活性与株高呈负相关的结果一致。
4 结论
本研究中GA3处理显著提高了甘蔗株高,提高了NAD激酶(NADK)、钙依赖蛋白激酶(CDPKs)、α-甘露糖苷酶(α-Manase)、β-甘露糖苷酶(β-Manase)、纤维素酶(CL)、木葡聚糖内糖基水解酶(XTH)和水解酶(XTH)活性,与甘蔗节间伸长呈显著的正相关;而DPC处理株高明显低于对照,但提高了钙调素(CAM)、α-葡萄糖苷酶(α-GC)、β-葡萄糖苷酶(β-GC)、过氧化氢酶(CAT)和木葡聚糖内转糖苷酶(XET)活性。GA3通过提高NAD激酶(NADK)和钙依赖蛋白激酶(CDPKs)促进GA20-氧化酶(GA20ox)和GA3-羟基化酶(GA3ox)活性GA的合成,通过提高α-甘露糖苷酶(α-Manase)、β-甘露糖苷酶(β-Manase)、纤维素酶(CL)和酶木葡聚糖内糖基转移酶(XET)活性促进节间细胞壁的松弛,从而促进甘蔗节间伸长;而DPC则对节间调控伸长起负调控作用。

