二代测序技术检测胸腔积液中细胞沉淀物及上清液中DNA的价值
周金梅,熊柳冰,黄 浩
(惠东县人民医院肿瘤内科,广东 惠东 516300)
从癌细胞中提取DNA 是检测表皮生长因子受体(EGFR)突变的“金标准”。但手术前患者组织样本的获取十分困难,对临床治疗的指导具有滞后性[1]。许多研究者逐渐采用胸腔积液等易获取的样本替代组织样本进行DNA 分析,但存在较高的误诊率。由于EGFR 突变分析通常是在细胞学诊断中的免疫染色之后进行,而恶性胸腔积液一般属于渗出液,因此可用于EGFR 突变分析的沉淀物较为有限[2]。同时,当沉淀物中癌细胞很少时,EGFR 突变分析会产生假阴性的结果[3]。此外,采用胸腔积液标本检测EGFR 突变状态与细胞学诊断之间的关系尚不清楚。因此,我们猜测联合检测胸腔积液中细胞沉淀物DNA 和无细胞上清液基因组DNA(cell-free DNA,ccfDNA)可能比单独使用细胞沉淀物DNA 或上清液ccfDNA检测更能有效诊断EGFR 突变状态。基于此,本研究探讨采用二代测序技术检测胸腔积液中细胞沉淀物DNA 及上清液ccfDNA 的临床价值。
1 资料和方法
1.1 基线资料
选取2016 年1 月至2020 年10 月我院收治的156 例肺腺癌患者作为研究对象。其纳入标准是:经病理学检查或细胞学检查明确诊断患有肺腺癌,且癌细胞存在远处转移;出现胸腔积液;知晓本研究内容,并签署了知情同意书。其排除标准是:存在其他类型的恶性肿瘤;合并有免疫系统疾病、炎性疾病等可能产生胸腔积液的疾病;基因检测前已接受放化疗等抗肿瘤治疗;病历资料缺失。在156 例肺腺癌患者中,有45 例(28.8%)患者检测出EGFR 突变(EGFR 突变采用TaqMan 突变检测法进行检测)。将45 例EGFR 突变型肺腺癌患者作为EGFR 突变组,另选同期我院收治的29例野生型EGFR 且上清液样本充足的肺腺癌患者作为EGFR 野生组。两组患者的基线资料见表1。

表1 两组患者基线资料的比较
1.2 方法
1.2.1 组织标本、胸腔积液标本的收集 收集患者的胸腔积液细胞学标本,在800 g 条件下离心10 min,收集上清液后立即保存在-80℃的冰箱中,直到提取DNA。取标本中的细胞沉淀物,将细胞沉淀物浸泡在固定液中至少30 min。每个液基细胞学(liquid based cytology,LBC)涂片都采用SurePathTM 系统进行处理,然后将LBC 玻片用Papanicolaou 法染色以进行细胞学诊断。液基胸腔积液细胞学检查中肺腺癌的典型细胞学表现见图1。同时,在胸腔镜下夹取适量组织标本,并通过细胞抽吸或在术后病理组织中获取转移的肿瘤标本。
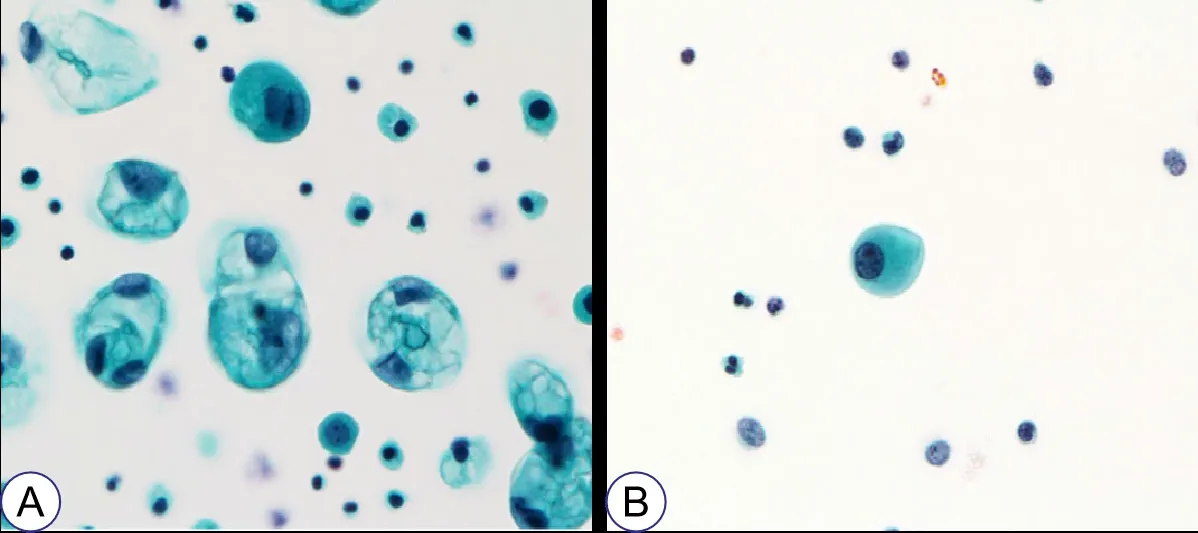
图1 液基胸腔积液细胞学检查中肺腺癌的典型细胞学表现
1.2.2 高通量二代测序分析 采用TaqMan 突变检测法或F-PHFA 法检测EGFR 基因第19 号外显子(DelE746A750)和第21 号外显子(L858R)突变的情况。提取胸腔积液中LBC 涂片的细胞沉淀物和上清液基因组DNA(cell-free DNA,ccfDNA),DNA 含量用生物光度计进行检测。从恶性细胞涂片中提取DNA,利用NextSeq 500 高通量测序平台,采用二代测序技术检测组织、细胞等样本中基因变异序列的数目及EGFR 基因变异的情况。
1.3 观察指标
观察采用胸腔积液中细胞沉淀物DNA、上清液ccfDNA 单独检测及联合检测评估EGFR 突变的结果。
1.4 统计学方法
用SPSS 20.0 软件处理本研究中的数据,计量资料用±s表示,用t检验,计数资料用% 表示,用χ² 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 胸腔积液中细胞沉淀物DNA、上清液ccfDNA单独检测评估两组患者EGFR 突变的情况
EGFR 野生组患者胸腔积液中所有细胞沉淀物DNA、上清液ccfDNA 单独检测的结果均显示EGFR 突变呈阴性,EGFR 突变组患者胸腔积液中细胞沉淀物DNA、上清液ccfDNA 单独检测的结果均显示原发灶和相应转移灶EGFR 基因第19 号、21 号外显子的突变情况无差异。
2.2 胸腔积液中细胞沉淀物DNA、上清液ccfDNA联合检测评估两组患者EGFR 突变的情况
在EGFR 突变组患者中,细胞沉淀物DNA 中EGFR 突变与上清液ccfDNA 中EGFR 突变的符合率为35.6%(16/45),表明这两种标本在EGFR突变检测中经常表现出不一致。对这两种标本进行联合检测后发现,联合检测可将EGFR 突变检测的敏感度提高至60.0%。详见表2。
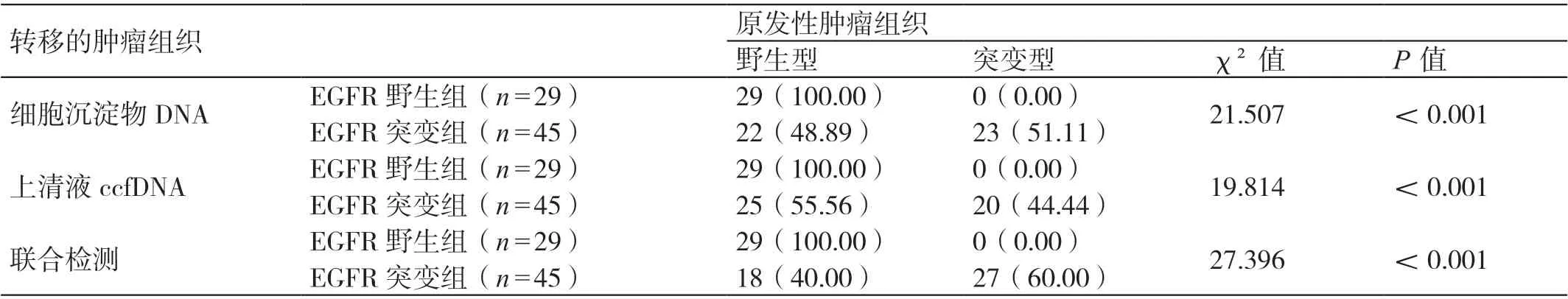
表2 胸腔积液中细胞沉淀物、上清液ccfDNA 联合检测评估两组患者EGFR 突变的情况[ 例(%)]
3 讨论
胸腔积液或血浆中的游离DNA 可用来检测EGFR 突变,这不仅有助于肺癌治疗方案的制定,还有利于动态监测患者的治疗效果。研究证实,胸腔积液标本中的EGFR 突变筛查对于预测肺癌患者的预后十分有效[4]。Karlovich 等[5]通过PCR检测发现,从液体标本上清液中提取的ccfDNA 中可检测到激活的EGFR 突变,这可能是一种通过形态学和DNA 分析实现对肺癌快速诊断的敏感方法。本研究中我们发现,经胸腔积液中细胞沉淀物DNA 和上清液ccfDNA 联合检测,共在27 个样本中发现EGFR 突变,检测的敏感性为60.0%。提示采用二代测序技术同时对胸腔积液中细胞沉淀物DNA 和上清液ccfDNA 进行基因分析对于准确检测EGFR 突变具有重要的意义。近年来,已有多项研究发现原发性非小细胞肺癌EGFR 突变与相应转移灶的EGFR 突变不一致。Zhao 等[6]报道,原发性肺癌EGFR 的状态不能完全正确地预测相应转移灶中EGFR 的状态。也有学者研究发现,虽然肿瘤组织样本中EGFR 的突变率略高于胸腔积液样本中EGFR 的突变率,但二者相比无统计学差异。本研究中,细胞沉淀物和细胞培养上清液中EGFR 突变型的检出率并不完全一致。从样本中提取的DNA 质量不佳或肿瘤细胞存在异质性可能是导致两个样本中EGFR 突变型检出率不一致的原因。而联合检测细胞沉淀物DNA 和上清液ccfDNA,可提高原发肿瘤与相应转移瘤中EGFR 突变的符合率。在临床上,术前获取患者的肿瘤组织样本比较困难,这促使研究者开始使用血浆或胸腔积液等体液样本进行DNA 分析,而这些样本中通常含有循环中的无细胞DNA。在以往的无细胞DNA 研究中,研究人员研发了多种肺癌患者血浆/ 血清样本中EGFR 突变的检测技术,如扩增阻滞突变系统、高效液相色谱等,报告的检测灵敏度在43.1%~91.7%之间。在本研究中,我们主要采用二代测序法来检测胸腔积液中细胞沉淀物DNA 和上清液ccfDNA 中的EGFR 突变,因此报告的阳性率比以往的研究更高。在非恶性细胞标本的上清液ccfDNA 中无法检测到EGFR突变,因此我们认为肿瘤细胞未侵犯支气管的肺癌患者上清液中的无细胞DNA 不在支气管内循环。相比之下,晚期肺癌患者通常会出现胸腔积液,这些患者的无细胞DNA 可能在全身循环,而不仅仅是在支气管内循环[7]。尽管导致EGFR 突变阳性标本出现假阴性的原因尚不清楚,但在细胞学上,这些非小细胞肺癌病例的癌细胞可能较小,且有更多的单细胞核或未成熟的未分化细胞,这些细胞在大小、染色程度或形态上可能与典型非小细胞肺癌患者的癌细胞不同。
综上所述,采用二代测序技术对胸腔积液中细胞沉淀物DNA 和上清液ccfDNA 进行联合检测可有效提高原发肿瘤和相应转移瘤之间EGFR 突变的符合率。

