长链非编码RNA TPTEP1在肺腺癌中的表达及作用研究
潘春峰,刘锦源
南京医科大学第一附属医院胸外科,江苏 南京 210029
肺癌作为世界上发病率及病死率最高的肿瘤之一,其分型中肺腺癌的发病率持续性升高,已经成为占比最高的肺癌病理亚型[1]。尽管目前手术、放疗、化疗及靶向治疗等各项疗法取得了长足发展,其预后仍不够理想[2]。因此,寻找新的生物标志物及治疗靶点具有重要意义。
长链非编码RNA(long non⁃coding RNA,lncRNA)作为一类不具有编码功能的RNA,近年来被证实在转录前、转录后等多种途径参与了多种肿瘤的发生及发展过程[3-5]。lncRNA TPTEP1 作为抑癌基因被证实在肝癌组织中明显低表达,并且通过微小RNA(miRNA)⁃454⁃3p调控DLG5表达来抑制肝癌细胞的生长和转移[6]。在StarBase 数据库中,TPTEP1 在肺腺癌组织中呈现了明显的低表达,但其在肺腺癌中的具体作用缺乏研究,因此本研究旨在探索TPTEP1 在肺腺癌中的表达,尤其是在肺腺癌术前及术后血浆中的表达,探讨其与肺腺癌患者临床特征的关系,研究其对肺腺癌细胞生长及转移的作用,以期为肺腺癌的病情评价及靶向治疗提供可行的生物靶点。
1 材料和方法
1.1 材料
收集2017年6月—2020年12月86例在南京医科大学第一附属医院接受手术治疗的肺腺癌患者癌组织、癌旁组织;同时收集33 例肺腺癌手术患者的术前血浆及术后血浆(术后1个月)样本。所有样本取材后立即保存液氮中。术后病理均证实为肺腺癌并剔除临床资料(符合第8版AJCC病理分类)不完整病例。每例患者都签署了知情同意书。本研究得到了医院伦理委员会的批准(2019⁃SRFA⁃261)。此外,本研究还检索了TCGA数据库中TPTEP1与肺腺癌预后的相关数据[7]。
肺腺癌细胞系A549、SPCA1、H1299、H358、PC⁃9和正常支气管上皮细胞系BEAS⁃2B 来自于本实验室冻存,原始细胞株购自于中国科学院典藏生物细胞资源中心。细胞培养于含有10%胎牛血清的RPMI1640 培养基中,放置于37℃含有5%CO2的细胞培养箱中培养。
RNA 提取试剂TRIzol(Invitrogen 公司,美国),逆转录试剂盒PrimeScriptTMRT Master Mix、PCR 试剂盒SYBR Green PCR Kit(南京碧云天科技有限公司),CCK⁃8 试剂盒(同仁公司,日本)。Transwell 小室(Corning 公司,美国),Matrigel 基质胶(BD 公司,美国)。
1.2 方法
1.2.1 RNA提取和实时荧光定量PCR(qRT⁃PCR)
肺癌及癌旁组织、术前及术后血浆采用TRIzol法提取总RNA后反转录为cDNA,利用美国Applied Biosystems 公司的ABI7900 快速实时PCR 系统进行基因扩增。条件为95 ℃5 min,然后94 ℃15 s,55 ℃30 s,进行40 个循环扩增。GAPDH 作为TPTEP1 的内参基因。采用2-ΔΔCT定量法(CT表示循环阈值,ΔCT=CTTPTEP1-CTGAPDH),计算TPTEP1的相对表达量。TPTEP1引物序列:正向5′⁃GCTTCCCCTTTC⁃CAGAGAGC⁃3′,反向5′⁃CGGGCGACTGTAGTGTT⁃GTT⁃3′;GAPDH引物序列:正向5′⁃CTCACCGGATG⁃CACCAATGTT⁃3′;反向5′⁃CGCGTTGCTCACAAT⁃GTTCAT⁃3′。
1.2.2 细胞转染和分组
过表达TPTEP1 慢病毒载体(LV⁃TPTEP1)及其对照组(LV⁃Control)由上海吉凯生物技术公司合成。A549 细胞培养至适合密度后分两组利用poly⁃brene试剂分别转染LV⁃TPTEP1或LV⁃Control(称为TPTEP1组和Control 组)。培养24 h后,收集细胞提取RNA,利用qRT⁃PCR验证转染效率。
1.2.3 CCK⁃8实验
A549 细胞株实验组和对照组分别培养后接种到96 孔板,每孔约3 000 个细胞,正常培养24、48、72、96 h,在不同时间点选择不同复孔(n>4)分别加入CCK⁃8试剂,避光培养2 h后测量各孔在450 nm处的吸光度。
1.2.4 Transwell侵袭和迁移实验
采用8 μm 孔径的Transwell 小室进行实验。实验组和对照组A549 细胞培养消化后用无血清RPMI1640 培养液重悬。侵袭实验时,将小室上层均匀涂覆Matrigel 基质胶;迁移实验时不做涂覆。然后在小室上层加入200 μL无血清细胞悬液,小室下层中加500 μL 含10%胎牛血清的RPMI1640 培养液,培养箱中恒温培养36 h。取出Transwell 小室,甲醇固定后用0.1%结晶紫染色20 min,棉签擦去小室上层面余留细胞,显微镜下进行随机视野拍照后计数。
1.3 统计学方法
应用SPSS19.0 和Graphpad Prism 7.0 进行数据统计学分析,计数资料采用卡方检验;符合正态分布的计量资料,两组比较采用t检验;多组比较采用单因素方差分析。采用卡方检验对TPTEP1表达水平与患者临床特征的关系进行分析,P<0.05 为差异有统计学意义。
2 结果
2.1 TPTEP1在肺腺癌患者组织及血浆中的表达水平比较
选取了86 例接受肺腺癌手术患者的肿瘤组织及癌旁组织样本,采用qRT⁃PCR 检测了组织中TPTEP1 的相对表达水平。实验结果如图1A 所示,TPTEP1 在肺腺癌组织中的表达水平明显低于癌旁组织(P<0.001)。同时,还收集了33例肺腺癌患者手术前及手术后(>1个月)的血浆样本,检测了其相对的TPTEP1 表达量,肺腺癌患者术后血浆中的TPTEP1水平较术前明显升高(P<0.01,图1B)。
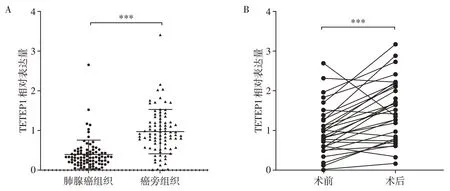
图1 TPTEP1在肺腺癌组织及血浆中的表达Figure 1 Relative expression of TPTEP1 in tumor tissues and plasma of lung adenocarcinoma patients
2.2 肺腺癌中TPTEP1表达量与肺腺癌患者临床特征的相关性
根据肺腺癌患者组织中TPTEP1 的表达中位数,将肺腺癌病例分为TPTEP1 高表达和低表达组(图2)。结合临床资料分析,发现TPTEP1的异常表达与肺腺癌患者的年龄、性别、吸烟史、患肺侧别等均没有明显相关性,而与肿瘤的大小、分化程度、淋巴结转移、TNM 分期等相关(P<0.05,表1)。分析了TCGA数据库中TPTEP1与肺腺癌预后的相关性,发现,TPTEP1的表达量高低与肺腺癌患者的总生存期和无病生存期没有明显相关性(图3,P>0.05)。
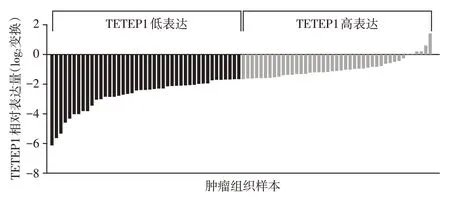
图2 TPTEP1在肺腺癌组织中的高低表达分组(log2变换)Figure 2 TPTEP1 High and low expression group in lung adenocarcinoma tissue(log2 change)
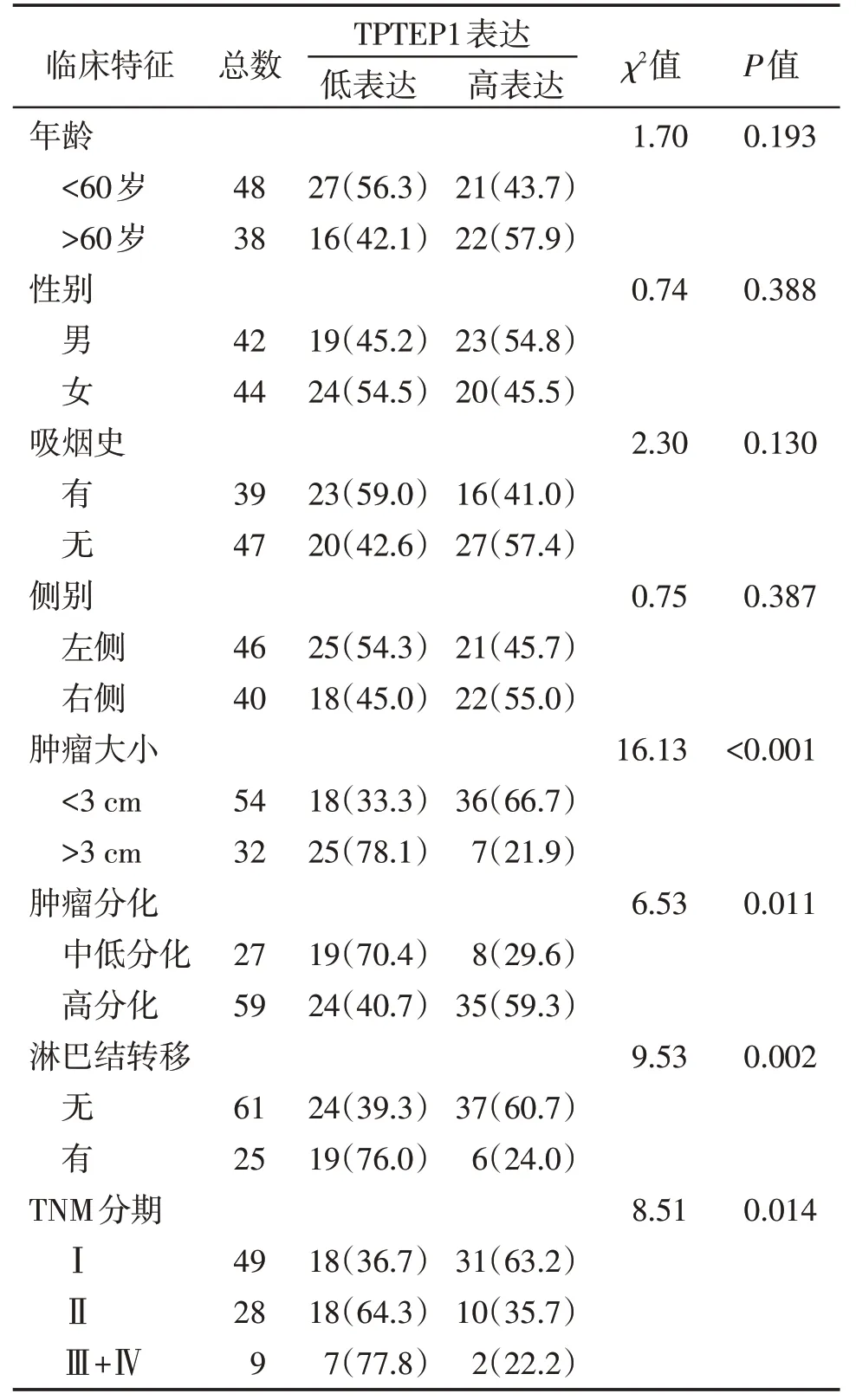
表1 TPTEP1与肺腺癌患者的临床病理特征的关系Table 1 Correlation between TPTEP1 expression and clinical characteristics of lung adenocarcinoma [n(%)]
2.3 肺腺癌细胞中TPTEP1的表达量及转染效率
检测5 个肺腺癌细胞系中TPTEP1 相对正常肺上皮细胞系BEAS⁃2B 的表达量后发现,TPTEP1 在5 个肺腺癌细胞系中均低表达(P<0.05,图4A)。选取表达量适中的A549细胞系,利用慢病毒载体过表达TPTEP1 后,检测发现TPTEP1 组TPTEP1 表达相较于对照组明显升高(P<0.001,图4B)。
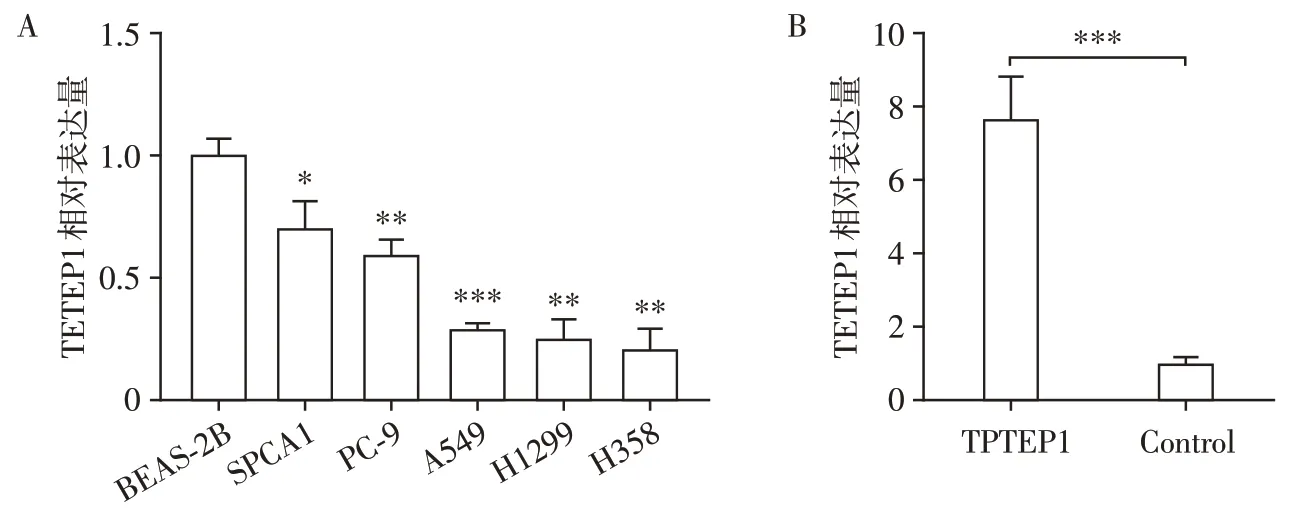
图4 TPTEP1在肺腺癌细胞中的表达Figure 4 Relative expression of TPTEP1 in lung adenocarcinoma cells
2.4 TPTEP1 抑制肺腺癌细胞的增殖、侵袭和迁移能力
对过表达后的A549细胞进行CCK⁃8实验,以研究TPTEP1 对肺腺癌细胞增殖的影响。如图5A 所示,过表达TPTEP1 后A549 细胞的增殖能力较对照组明显降低(P<0.01)。Transwell 侵袭和迁移实验说明上调TPTEP1 表达后,A549 细胞的侵袭和迁移能力被极大地抑制了(P<0.01 和P<0.001,图5B~E)。这些实验说明TPTEP1 可以抑制肺腺癌细胞的增殖和转移能力。
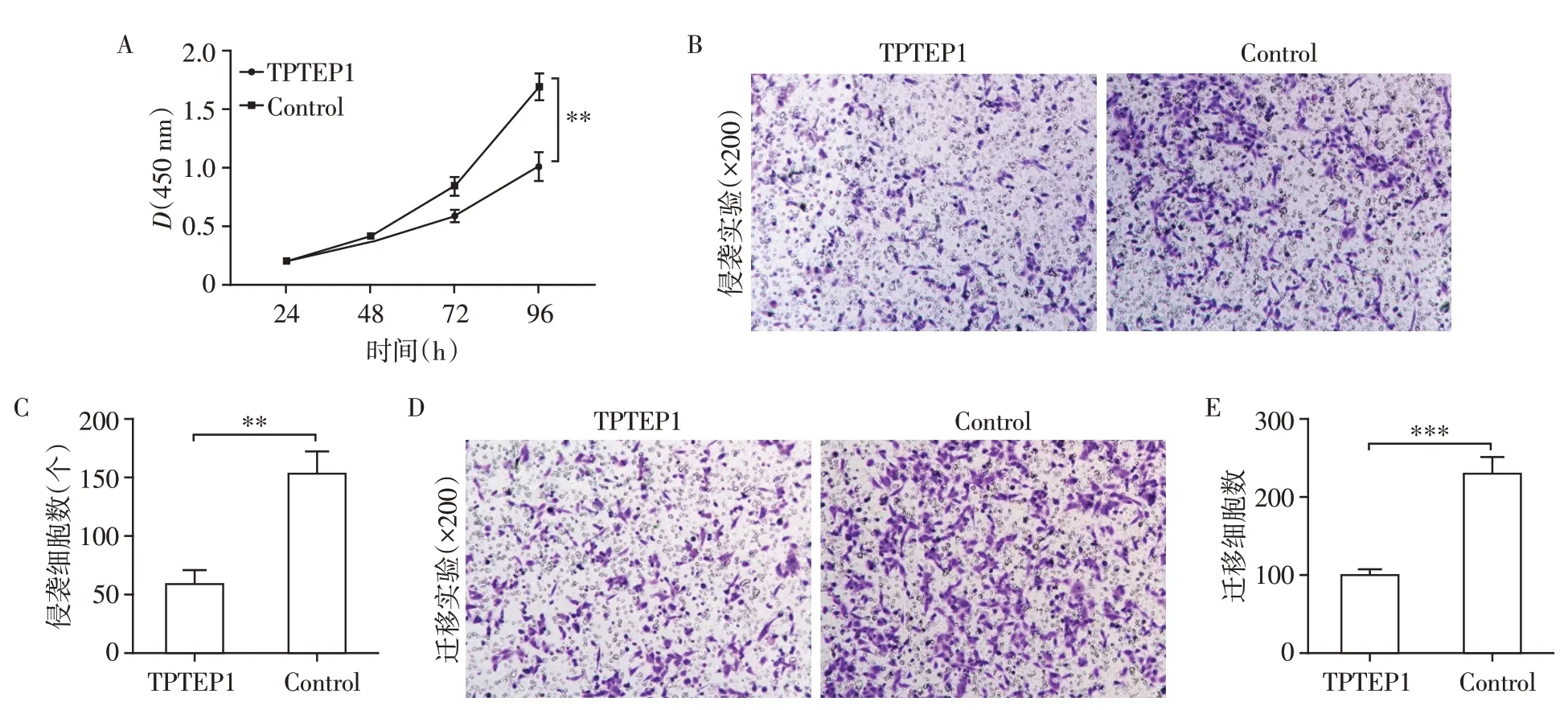
图5 过表达TPTEP1抑制肺腺癌细胞的增殖和转移Figure 5 Overexpression of TPTEP1 inhibited cell proliferation,invasion and migration of lung adenocarcinoma cells
3 讨论
肺腺癌的发病率与日俱增,由于其具有容易发生早期转移的特点,因此其预后表现不佳[8-9]。随着基因组学的研究发展,包括miRNA、lncRNA 在内的越来越多的分子被发现,它们可以成为提示肿瘤进展以及预后的潜在靶标,并且可以成为潜在的生物靶向治疗的靶点[10-11]。在肺腺癌中,很多lncRNA被证实扮演着“癌基因”或者“抑癌基因”的作用,例如肺腺癌转移相关转录因子1(MALAT 1)明显促进肺腺癌的增殖转移,并且与肺癌组织中Bcl⁃2 的表达相关。相反,lncRNA MEG3 可以抑制肺腺癌细胞的增殖,并且促进其凋亡,这种作用可能是通过影响p53 的蛋白表达来实现。另外,LINC01234、LINC00312、LINC00152、LINC00426 和 lncRNA CAR10 等长链非编码RNA 在肺腺癌中都表现出了或促进或抑制肿瘤发生发展及转移等作用[12-18]。
TPTEP1 位于人类染色体22q11.1,在急性髓系白血病中可以和miR⁃1303相互作用,抑制急性髓系白血病细胞的增殖;在肝癌中,TPTEP1 可以逆转由于miR⁃454⁃3p 引起的DLG5 表达下降,进而表现出抑制肝癌生长及肺转移的作用;另外,TPTEP1 通过miR⁃106a⁃5p 介导的p38 MAPK 信号来抑制胶质瘤的肿瘤干性和放疗抗性[19-21]。这些研究都证实了TPTEP1 可以作为抑癌基因参与肿瘤的生物学进程。本研究发现TPTEP1在肺腺癌组织中的表达量要明显低于正常组织,其表达量与肺腺癌患者的肿瘤大小、分化程度、淋巴结转移及TNM 分期存在着明显负相关性。本研究还检测了TPTEP1在肺腺癌患者术前与术后血浆中的表达量,发现经过手术治疗的肺腺癌患者术后血浆中TPTEP1表达量比术前显著升高。这些都说明TPTEP1可能作为一个抑癌因子在肺腺癌中发挥作用。此外,利用肺腺癌细胞系过表达TPTEP1,发现TPTEP1 水平增高可以明显抑制肺腺癌细胞的增殖和侵袭转移能力。这些研究与之前TPTEP1在其他肿瘤中起抑制肿瘤发展的作用的结论相一致。现行的肿瘤诊断方式主要依赖于影像学和中晚期出现的症状,而现行的肺腺癌根治方式主要还是依靠手术,而手术属于从局部的角度去对肿瘤进行机械性的切除[22]。结合本研究结果,检测组织及血液中TPTEP1表达,再结合临床资料及影像等方法综合分析,可能对肺腺癌的发生发展作出预测。然而,分析了相关数据库,发现TPTEP1 表达量的高低与肺腺癌患者的预后没有明显相关性,这可能是因为肿瘤的调控涉及复杂网络状调控系统,目前的随访数据仍有一定局限性,后续也会针对相关临床病例的预后进行预后分析,继续探讨TPTEP1与肺腺癌预后的相关性。
当然,本研究依然存在着许多未完善之处:①样本量不足;②研究涉及的肺腺癌患者的预后数据仍然在进一步的随访和统计之中;③针对TPTEP1在肺腺癌中作用机制研究仍需要进一步深入研究。
总而言之,本研究初步阐述了lncRNA TPTEP1在肺腺癌中低表达,且与肿瘤的大小、分化程度、淋巴结转移相关。更加全面深入地研究TPTEP1在肺腺癌中的作用机制将有助于显现TPTEP1作为潜在肺腺癌诊断治疗靶标的临床意义。

