Bmal1调控T型钙离子通道对慢性心衰室性心律失常昼夜节律的影响
俞 灏,周子皓,张南南,薛思源,钱智勇,王 垚,邹建刚
南京医科大学第一附属医院心血管内科,江苏 南京 210029
慢性心力衰竭(chronic heart failure,CHF)是导致60岁以上老年人住院的最常见的心血管疾病,且患者预后差,5年存活率只有50%左右[1]。一项亚洲心衰猝死研究(ASIAN⁃HF)报道,19.2%的心衰患者在1年内死亡或因心力衰竭再住院[2]。CHF患者易发生心脏性猝死(sudden cardiac death,SCD),而SCD 的主要原因为各种恶性室性心律失常(ventric⁃ulararrhythmia,VA)[3]。研究发现,CHF患者VA/SCD的发作表现出明显的昼夜节律,清晨时为发作高峰,称为晨峰现象[4],提示生物钟在CHF患者VA/SCD的发作中发挥重要作用。
脑和肌肉芳香烃受体核转运样蛋白1(brain and muscle ARNT⁃like protein⁃1,Bmal1)基因是调节昼夜节律的关键生物钟基因之一,其作为转录因子与昼夜运动输出周期蛋白(circadian locomoterout⁃put cycles kaput,Clock)基因结合为异质二聚体,通过结合到靶基因启动子上游的E⁃box 序列发挥调控作用[5]。心脏内源性生物钟对心脏功能具有广泛的调控作用,参与正常心率、血压的维持,在急性心梗、心功能不全、高血压等心血管疾病中发挥重要作用[4,6]。有研究报道,在小鼠心脏中,Bmal1可调控钠离子电压门控通道α亚单位5基因(sodium voltage⁃gated channel alpha subunit 5,Scn5a)和钾离子电压门控通道亚族h2基因(potassium voltage⁃gated chan⁃nel subfamily h member 2,Kcnh2)的转录,影响钠离子电压门控通道1.5亚型(voltage⁃gated sodium chan⁃nels,Nav1.5)和快速激活延迟整流钾电流(rapidly activiting delayed rectifier potassium current,Ikr)通道,心脏特异性敲除Bmal1基因将直接导致VA/SCD发生增加[7-8]。本课题组既往研究也发现心肌中L型钙离子通道(L⁃type calcium channel,LTCC)表达和电流具有昼夜节律特征,并证明了Clock⁃Bmal1通过调节Akt的T308 位点磷酸化参与调控LTCC 的生物节律[9]。因此,Bmal1可调控心肌细胞膜上的离子通道,参与心律失常的发生。
在心血管系统中除LTCC外,还有T型钙离子通道(T⁃type calcium channel,TTCC)[10]。TTCC 在心脏中分为Cav3.1(CNCNA1G,α1G)和Cav3.2(CNC⁃NA1H,α1H)两种亚型,生理情况下,心室中的TTCC仅在胚胎期表达,随着心室细胞逐渐成熟,其表达量逐渐降低,在成年心室肌细胞中基本不表达[10-11]。有研究报道,TTCC 在心肌肥厚合并心衰的心脏中表达量明显上调,且这可能是导致室性心律失常发生的原因之一[12-13]。Kinoshita 等[14]发现,在心梗后心衰小鼠中使用TTCC阻滞剂可以减少小鼠的心源性猝死。那么,生物钟调控VA/SCD 事件的昼夜节律是否与TTCC有关,生物钟基因Bmal1又是如何调控TTCC的,目前尚无相关研究。
结合目前研究现状,本研究采用主动脉缩窄术(transverse aortic constriction,TAC)构建心衰小鼠模型,应用免疫组织化学染色,程序性电刺激,染色质免疫共沉淀等技术探究Bmal1调控TTCC对慢性心衰室性心律失常昼夜节律的影响及可能的调控机制。
1 材料和方法
1.1 材料
小鼠C57BL/6J(南京大学模式动物研究所),均为4~8 周龄的雄鼠,待其成年后行TAC 手术构建慢性心衰小鼠模型。小鼠饲养于无特定病原体(spe⁃cific pathogen free,SPF)级动物房,室温20~25 ℃,相对湿度40%~50%,噪声<60 dB,每12 h开关照明昼夜循环,自由进食。本研究所有小鼠实验均严格遵循动物实验“3R”原则,按照中华人民共和国国家标准《实验动物福利伦理审查指南》(GB/T27416⁃2014)执行。所有小鼠实验均经南京医科大学动物管理和伦理委员会批准(编号:IACUC⁃2005052)。
GAPDH 抗体(江苏亲科生物研究中心有限公司)、Bmal1 抗体(CST 公司,美国)、Clock 抗体(CST公司,美国)、Cav3.1抗体(CACNA1G,α1G,Abcam公司,美国)、Cav3.2 抗体(CACNA1H,α1H,Abclonal 公司,美国)、α⁃平滑肌肌动蛋白抗体(α⁃smooth mus⁃cleactin,α⁃SMA,湖南艾方生物科技有限公司)、半乳糖凝集素⁃3 抗体(Galectin⁃3,GAL⁃3,湖南艾方生物科技有限公司)、羊抗鼠二抗(南京兰杰柯科技有限公司)、羊抗兔二抗(南京兰杰柯科技有限公司);全蛋白提取试剂盒、BCA 蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);核糖核酸(ribonu⁃cleic acid,RNA)反转录试剂盒、克隆用聚合酶链式反应酶LA Taq(南京诺唯赞生物科技股份有限公司);SYBR GREEN 实时定量PCR 试剂盒(Invitrogen 公司,美国);异丙肾上腺素(isoproterenol,ISO)、米贝拉地尔(mibefradil,MIB)(Sigma公司,美国)。
1.2 方法
1.2.1 CHF造模及小鼠分组
使用1%戊巴比妥钠,30 mg/kg腹腔注射麻醉小鼠。小鼠仰卧姿势摆放于37 ℃预热的加热操作台,脱去颈部及前胸部毛发并对裸露皮肤消毒处理,经口腔气管插管后连接小动物呼吸机,在胸骨上沿中部偏左位置用剪刀小心开胸至第二肋骨位置,在第一分支(无名动脉)和第二分支(左颈动脉)之间穿以6⁃0号丝线并结扎于27 G的针头上,缩窄主动脉,假手术组(CON)做同样的处理但不结扎主动脉。术后4周行小鼠心脏超声评估心功能。选取CHF的小鼠,予TTCC 抑制剂米贝拉地尔(MIB)10 mg/kg/d 腹腔注射2周。分组如下:CON组:行假手术小鼠作为对照组,CHF组:主动脉缩窄手术心衰组,CHF+MIB组:CHF小鼠腹腔注射MIB治疗组。
取样:自晚6 点关灯起暗适应36 h,后从晨6 点起,每4 h 取样1 次,收取48 h 左心室组织标本冻存于-80 ℃冰箱,分别标记为CT(circadian time,CT)0、CT4、CT8、CTl2、CTl6、CT20、CT24、CT28、CT32、CT36、CT40、CT44,供后续实验使用。
1.2.2 小鼠心脏超声检测
小鼠心脏超声检测在江苏省人民医院公共实验动物中心进行。使用仪器为配有30 MHz 高频探头的VisualSonic Vevo2100 型超声仪(VisualSonics公司,加拿大)。在使用异氟烷麻醉小鼠后,沿仰卧小鼠胸骨旁左室乳头肌水平短轴和长轴切面采集左室图像,同时在二维图像引导下分别获取5 个以上连续心动周期M⁃mode 超声影像。根据采集影像使用软件分析结果,得到心超参数。
1.2.3 心脏切片染色
处死小鼠后,分离心脏标本,10%磷酸缓冲液福尔马林固定24~48 h。HE 染色及Masson 染色按照试剂盒说明书中的方法进行操作,普通光镜下观察拍照。免疫组织化学(immunehistochemical,IHC)染色(α⁃SMA,Gal⁃3,α1G,α1H,1∶200)按照常规方法进行,每张切片滴加一抗溶液50 μL,次日滴加显色剂DAB工作液50 μL观察显色。IHC阳性染色为棕黄色。每个心脏样本取3个切片,在630×视野下随机选取5个视野,Image J计算心肌细胞横截面面积,纤维化面积,及免疫组化染色面积阳性率,取平均值。
1.2.4 小鼠程序性电刺激(programmed electrical stimulation,PES)
为了排除中枢生物钟通过自主神经系统对心脏电生理特性的调控,本部分采用小鼠离体心脏灌流条件下进行程序性电刺激诱发室性心律失常的发生。小鼠经过戊巴比妥钠腹腔注射麻醉,开胸取出心脏,迅速置于4 ℃预冷生理盐水中,清洗残余血液。分离主动脉,在主动脉中插入7F 鞘管,将鞘管调整至主动脉内合适位置(主动脉瓣开口上方)固定,10 mL 注射器连接鞘管,用灌流液注射入心脏,排净心脏内血液,最后连于Langendorff 灌流装。氧饱和灌流液持续灌流,灌流速度控制为3 mL/min,温度控制为37 ℃,并将心脏浸浴于灌流液中,两根心电记录电极分别接在主动脉根部与心尖部,稳定灌流20 min,使心电图图形稳定。
起搏电极为银质双极起搏电极,将两电极分别置于左心室心尖部,极间距为l mm。采用200%阈值的刺激强度,基础频率为150 ms 的S1⁃S1 刺激,S1⁃S2间隔由起始的150 ms以每5 ms的幅度递减至心脏不应期,Sl∶S2 为8∶1,即8 次S1 刺激后1 次S2刺激。按心脏刺激程序直至重复使用3个连续期前刺激以确定是否能够诱发VA。
1.2.5 蛋白免疫印迹法(Western blot)
收集处理提取小鼠心脏组织,加入预冷的RIPA裂解液提取组织总蛋白。常规SDS⁃PAGE 凝胶电泳、湿法转膜,5%BSA 溶液室温封闭2 h,随后加入一抗(1∶1 000)置于4 ℃冰箱孵育过夜。TBST 洗膜后加入二抗(1∶5 000),室温孵育2 h,洗膜后化学发光显影,使用Image J图像分析软件分析蛋白相对表达量。
1.2.6 实时定量逆转录聚合酶链反应(real⁃time quantitative reverse transcription polymerase chain re⁃action,qRT⁃PCR)
采用TRIzol试剂按操作说明书提取心肌组织总RNA。根据试剂盒操作说明进行后续qRT⁃PCR 扩增,采用Quantitation⁃comparative Ct(Livak)法 即ΔΔCt 法测定进行数据分析。所有引物定制于上海杰瑞生物工程有限公司。
1.2.7 染色质免疫共沉淀技术(chromatin immuno⁃precipitation,ChIP)
根据研究报道,Bmal1 作为转录因子可结合到目的基因的启动子E⁃box 区域发挥调控作用[5]。本文通过生物信息学检索α1G、α1H启动子上游E⁃box结合位点,使用ChIP检测观察Bmal1与α1G、α1H启动子的E⁃box 区域结合情况。超声破碎细胞,加入Bmal1 抗体,与靶蛋白⁃DNA 复合物相互结合,加入ProteinA,结合抗体⁃靶蛋白⁃DNA 复合物,沉淀,洗脱,得到富集的靶蛋白⁃DNA 复合物,解交联,纯化富集的DNA⁃片断,荧光定量PCR分析。
1.3 统计学方法
2 结果
2.1 CHF 小鼠心脏收缩功能降低伴心肌肥厚及纤维化
与假手术对照组(CON)相比,CHF 组小鼠左室射血分数及左室缩短分数均明显降低,左室收缩末及舒张末内径明显扩张,具有统计学差异(P<0.05,表1),且PCR检测心肌组织内心房钠尿肽(atrial na⁃triuretic peptide,ANP),脑钠肽(brain natriuretic pep⁃tide,BNP)明显升高(P<0.05,表1),提示CHF 组小鼠心脏收缩功能明显降低。图1为两组小鼠代表性心超图片。同时,CHF组小鼠左室间隔部厚度及左室质量均明显增加(P<0.05,表1),心肌细胞横断面(cross⁃sectional area,CSA)HE 染色提示CHF 组心肌细胞明显增大(P<0.05,图2B),提示CHF组小鼠心肌肥厚。上述结果表明,与CON组相比,CHF组小鼠心脏收缩功能明显下降并伴有心肌肥厚。
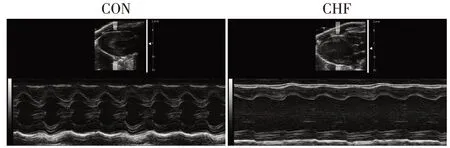
图1 CON组与CHF组小鼠代表性的超声心动图图片Figure 1 Representative echocardiography results in CON group and CHF group
表1 对照组与心衰组小鼠心超数据及心衰参数比较Table 1 Data comparison of echocardiography and heart failure between CON group and CHF group ()
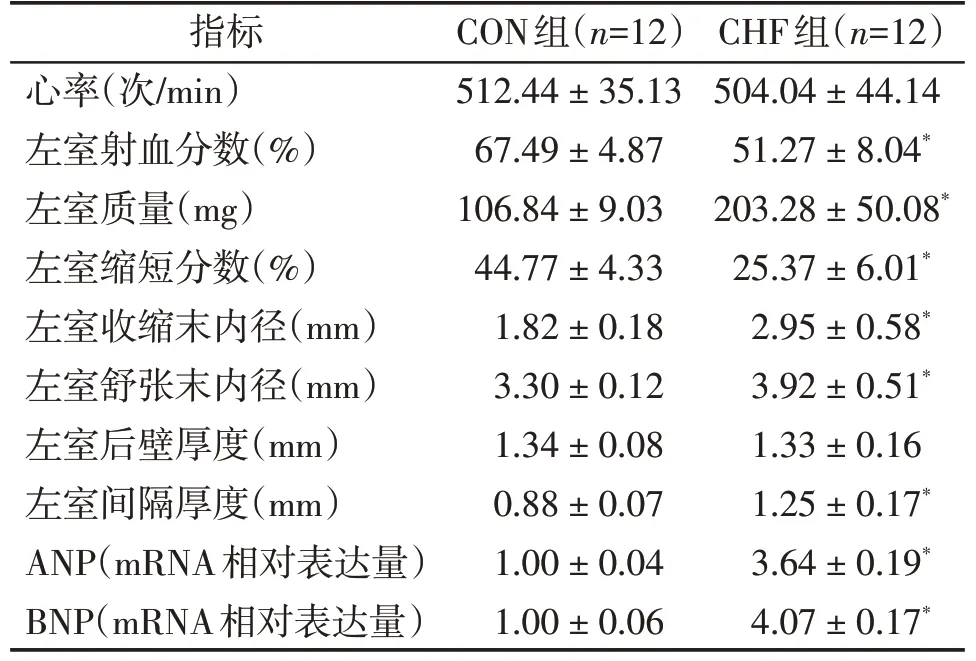
表1 对照组与心衰组小鼠心超数据及心衰参数比较Table 1 Data comparison of echocardiography and heart failure between CON group and CHF group ()
与CON组比较,*P<0.05。
与CON组相比,Masson染色提示CHF组小鼠心脏纤维组织明显增多(P<0.05,图2C)。α⁃SMA 和Gal⁃3 是与心脏纤维化密切相关的分子蛋白。IHC染色显示,与CON组相比,α⁃SMA及Gal⁃3在CHF组小鼠心脏中表达明显升高(P<0.05,图2D~E),表明CHF 组小鼠心肌纤维化显著增多。图2A 为心脏切片染色代表性图片。
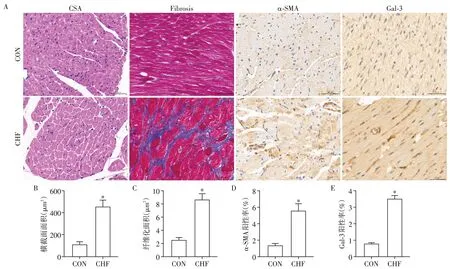
图2 CON组与CHF组小鼠心脏组织病理生理学的变化比较Figure 2 Comparison of cardiac pathophysiological changes between CON group and CHF group
2.2 CHF小鼠心脏中TTCC表达量增高
对CON 及CHF 组小鼠心肌两种TTCC 亚型(α1G,α1H)行IHC及Western blot检测(图3)。与CON组相比,CHF组α1G及α1H染色阳性面积明显增加,蛋白表达水平显著增高。结果提示,在CON组小鼠心肌中,TTCC 表达量很低,CHF 小鼠心肌中,TTCC表达明显增高。

图3 CON组与CHF组小鼠心肌T型钙离子通道两种亚型(α1G和α1H)的变化比较Figure 3 Comparison of TTCC(α1G and α1H)changes in myocardium between CON group and CHF group
2.3 CHF 小鼠VA 发作率明显增高与TTCC 表达增高有关
分别在CT0 和CT12 时间点对小鼠心脏进行离体电刺激诱发VA。标准刺激程序和VA 发作的典型图片见图4A。在CT0时间点行PES,CON 组诱发出1例心室颤动,VA发生率为10%;CHF组诱发出2例室性心动过速,5 例心室颤动,2 例同时诱发出室性心动过速和心室颤动,VA 发生率为90%;CHF+MIB 组诱发出3例心室颤动,VA发生率为30%。在CT12时间点行PES,CON组未诱发出VA;CHF组诱发出1例心室颤动,3例同时诱发出室性心动过速和心室颤动,VA发生率为40%;CHF+MIB组诱发出2例心室颤动,CHF+MIB 组VA 发生率为20%。以上结果提示,CHF 组小鼠在上述两个时间点的VA 发生率均明显高于CON组(P<0.05,图4B)。使用TTCC阻滞剂米贝拉地尔(MIB)后,和CHF小鼠相比,治疗组小鼠(CHF+MIB)在CT0+CT12 两时间点VA 的总发生率明显下降(P<0.05,图4B)。在3 组小鼠中,CT0 时间点VA 的发生率均高于CT12,在CHF 组小鼠中有统计学差异(P<0.05,图4B),提示在慢性心衰小鼠中,VA 发生率有昼夜差异。以上结果表明,在CHF小鼠中,VA发生率明显增加,且存在昼夜节律差异,使用MIB后VA发生率明显减少。
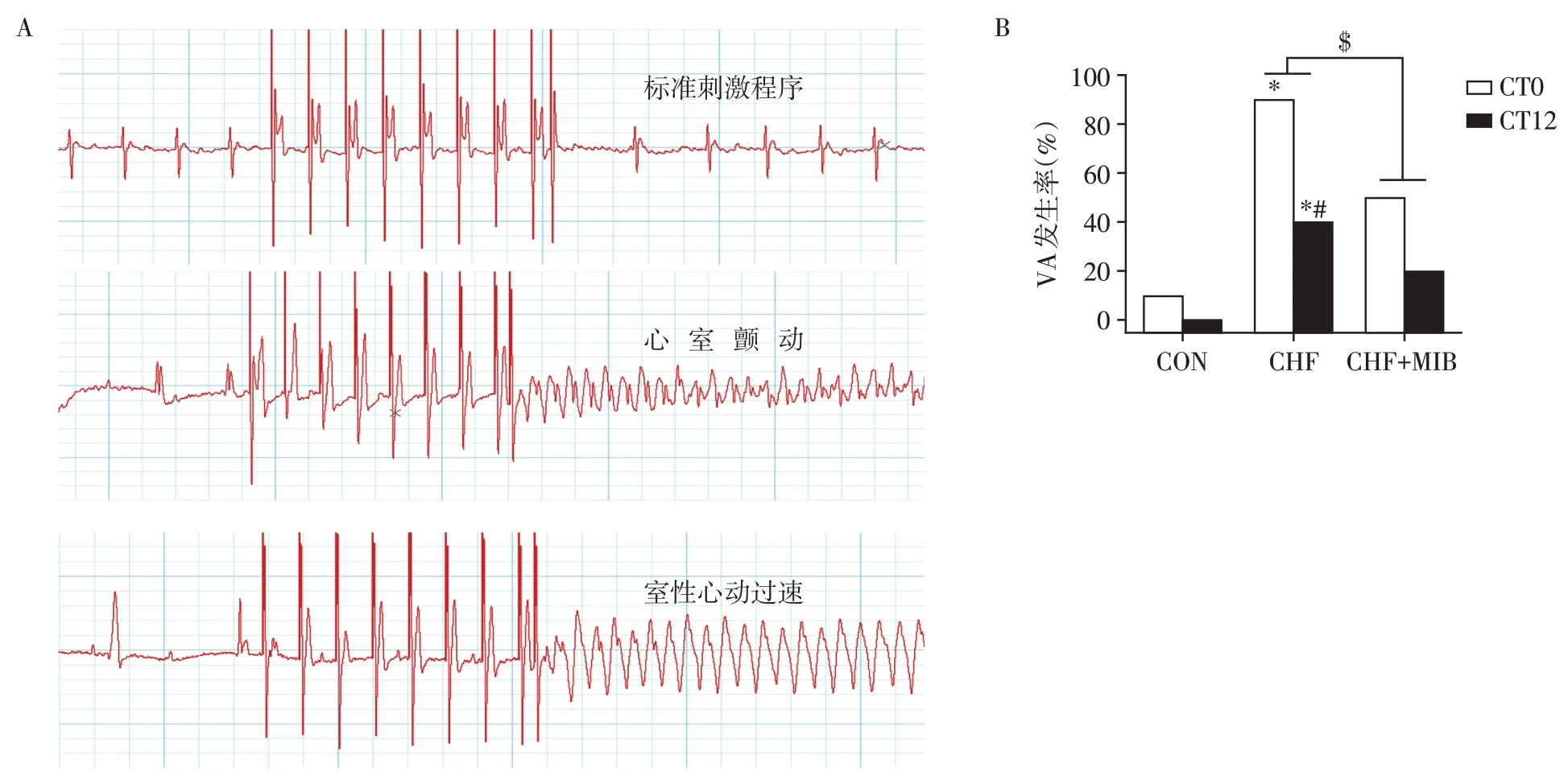
图4 CON组、CHF组及CHF+MIB组VA发生率及节律变化的比较Figure 4 Comparison of VA incidence and rhythm changes between CON group,CHF group and CHF+MIB group
2.4 CHF小鼠心脏TTCC及Bmal1表达具有昼夜节律
收取48 h CHF 小鼠左心室组织标本,使用Western blot 及qRT⁃PCR 检测心肌组织TTCC(α1G,α1H)及Bmal1节律表达情况。在48 h内,JKT cycle分析提示CHF 组小鼠的TTCC(α1G,α1H)及Bmal1蛋白表达均有节律性变化(P<0.05,图5B~D),其周期及相位一致,周期为24,相位为0。JKT cycle分析qRT⁃PCR 结果提示,TTCC(α1G,α1H)及Bmal1 mRNA 亦有节律性变化(P<0.05,图5E~G),其周期一致,均为24,但相位不同,TTCC 为20,Bmal1 为0。因Bmal1作为转录因子,调控下游转录可能存在延迟,所以TTCC表达的节律性可能与Bmal1节律表达有关。
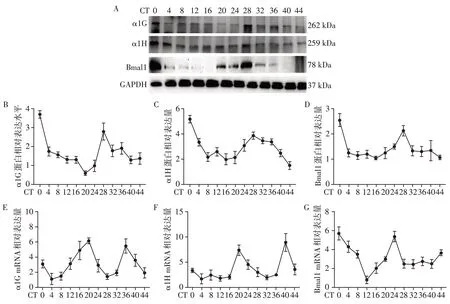
图5 CHF小鼠心肌组织TTCC(α1G、α1H)及Bmal1表达具有昼夜节律性Figure 5 Expression of TTCC(α1G,α1H)and Bmal1 in myocardium of CHF mice showed circadian rhythm
2.5 Bmal1直接参与调控T型钙离子通道转录
ChIP 结果显示,Bmal1 与α1G、α1H 和阳性参照组(PP)启动子区域结合的富集指数相对于阴性参照组(PN)明显增加,具有统计学差异(P<0.05,图6B~C)。同时使用IgG 作为阴性对照,排除启动子区域的非特异性结合。以上结果提示,Bmal1 可通过与TTCC 启动子区域的E⁃box 位点结合从而调控其转录。
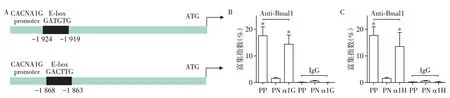
图6 染色质免疫共沉淀技术检测Bmal1与T型钙离子通道两种亚型(α1G和α1H)启动子区域的结合情况Figure 6 The bindings of Bmal1 to promoter regions of TTCC(α1G and α1H)detected by chromatin immunoprecipitation
3 讨论
本研究主要发现,在CHF小鼠中,TTCC(α1G,α 1H)通道重新高表达且呈昼夜节律性变化。使用PES 诱导CHF 小鼠VA 发作,提示VA 发生率与TTCC(α1G,α1H)重新高表达有关,使用TTCC 阻滞剂可减少CHF 小鼠VA 的发作。本研究第一次发现,Bmal1 作为转录因子可直接结合在TTCC(α1G,α1H)启动子区域的E⁃box位点,启动TTCC转录。
慢性心力衰竭是各种心脏疾病的严重表现或晚期阶段,死亡率和再住院率居高不下,给患者、家庭及社会造成了严重的经济负担[15]。国内一项对10 714 例住院心衰患者的调查数据显示,1980、1990、2000 年心衰患者住院期间死亡率分别为15.4%、12.3%和6.2%,心衰患者死亡原因依次为泵衰竭(59%)、心律失常(13%)和心脏性猝死(13%)[16]。因此,VA/SCD 是心力衰竭病人死亡的主要原因之一[3,15-16]。在本研究中,和正常对照组(CON)相比,CHF 小鼠心脏呈心衰表现(心肌细胞体积增大,纤维化增多,EF 值降低),程序性电刺激后CHF 小鼠VA 发生率明显增加,这与之前研究结果相符。目前研究报道,CHF患者VA/SCD更常发生在清晨,具有晨峰现象[17-18],且越来越多的证据表明这些心血管不良事件的昼夜节律性至少部分与内源性生物钟对离子通道的调控有关[4,9,19]。在Jeyaraj 等[20]的研究中,转录调节因子Klf15 基因缺失或过表达都可导致心脏复极异常,增强心脏VA 发生的易感性。在心脏中,Bmal1 调控Klf15 呈节律性表达,这可能是导致VA发作具有时间点高发现象的原因之一。在本研究中,发现在CHF 小鼠心脏中Bmal1 及TTCC 表达在48 h 内有昼夜节律性,蛋白表达水平在CT0时出现第一个峰值,于是在CT0及其相对应的CT12两个时间点对小鼠心脏行离体程序性电刺激,发现在CHF小鼠中,CT0时间点VA的发生率明显高于CT12,表明心脏内源性生物钟参与了VA的发生。
许多在动物和人类身上的实验证明,细胞内钙调节失衡会增加细胞对VA的敏感性[21]。心肌细胞膜上存在两种电压门控Ca2+通道:L 型Ca2+通道(LTCC)和T型Ca2+通道(TTCC)[10]。TTCC只有α1一种亚基,包括Cav3.1(α1G),Cav3.2(α1H),Cav3.3(α 1I)3 种亚型,其中心肌中仅表达Cav3.1(α1G)和Cav3.2(α1H)[22]。在大多数哺乳动物胚胎期心脏中,TTCC 在心房和心室肌细胞中明显表达,但出生后在心室肌细胞中表达量逐渐减少或不表达,仅在窦房结及传导系统中表达,参与心脏IV期的自动去极化[11]。然而,在许多病理条件下如心肌肥厚或者心力衰竭时,TTCC 会再次重新表达,但其机制尚未阐释清楚[12-13]。在本实验中,TAC诱导的心衰小鼠中,免疫组化及Western blot 结果提示α1G 和α1H 两种亚型表达水平较对照组(CON)明显升高,提示CHF小鼠心脏中TTCC重新高表达,同时VA发生率明显增加。在CHF 小鼠使用TTCC 阻滞剂米贝拉地尔(MIB)后,VA 发生率明显下降。有研究报道,在病变心肌中TTCC 重新高表达将增加心肌细胞内Ca2+内流,导致细胞内Ca2+超载和心律失常[14,23]。同时,也有研究发现,α1H在钙调磷酸酶/核因子病理性激活的T 细胞信号的诱导中发挥关键作用,这也会增加心律失常的易感性[24-25]。Kinoshita 等[14]研究中,TTCC 阻滞剂可通过复极静息膜电位及改善心脏自主神经的平衡发挥抗心律失常作用。以上结果提示心衰中,VA 发生增加与TTCC 重新高表达有关。收集48 h CHF小鼠心脏组织行Western blot 及qRT⁃PCR,发现心脏内源性Bmal1 的表达依旧保留生物节律,TTCC 亦存在昼夜节律,且在CT0 表达量最高。因此,发现在心衰中,Bmal1可调控TTCC使其昼夜节律性表达,这与VA/SCD发作的昼夜节律相关。
本课题组既往研究显示心脏内源性生物钟可直接调控β1⁃肾上腺素能受体(β1⁃AR),在心脏中完整的Clock⁃Bmal1 二聚体结构可通过与β1⁃AR 的编码基因Adrb1启动子上游区域的E⁃box结合,直接调控β1⁃AR 的表达[26]。所以,进一步验证Bmal1 作为转录因子是否可以调控TTCC 转录。ChIP 结果显示,Bmal1 可以直接结合至TTCC 启动子区域的E⁃box 位点,调控其转录,从而TTCC 通道表达存在昼夜节律。本研究发现,当CHF时,TTCC通道重新高表达,通道开放将增加舒张期钙渗漏,导致细胞内钙超载,触发VA/SCD,这一变化受生物钟基因Bmal1 直接调控从而使VA/SCD 发作有昼夜节律现象。事实上,在人类和小鼠研究中发现,存在多个与VA 有关且呈节律性表达的基因,如Calm2、Kcnh2、Scn5a、Cx43、Cx45 等[21]。所以VA 发作的昼夜时间差异很可能是由多个基因变化共同导致。
本研究的不足之处在于未能深入探究TTCC激活后生物钟基因与胞浆钙浓度变化的关联。在心脏,L 型Ca2+通道含量丰富,负责大部分Ca2+进入细胞,是心肌细胞以钙释钙触发心肌收缩的主要钙离子通道,所以TTCC 引起细胞内钙超载的作用大小仍需进一步研究。本实验研究中的动物为心肌肥厚伴心功能不全的模型,而早期心衰和失代偿期心衰的调控机制并不完全一致。生物钟基因在早期和晚期心衰中表达是否一致及调控机制目前仍未阐释清楚。此外,TTCC 特异性抑制剂米贝拉地尔因存在严重的药物相互作用并未在临床中推广使用。有研究报道,恩格列净可通过抑制心脏Na+/H+交换降低心肌细胞胞质Ca2+浓度,然而这类钠⁃葡萄糖共转运蛋白2(SGLT⁃2)抑制剂是否能够抑制TTCC尚未有研究报道,仍需进一步探讨[27]。
综上所述,本研究发现在CHF 手术小鼠中,TTCC 通道重新高表达且呈昼夜节律性,使用TTCC阻滞剂可减少CHF 小鼠VA/SCD 的发作,且TTCC这一变化受生物钟基因Bmal1直接调控。

