带血管蒂自体腓骨头骨骺移植重建儿童肱骨近端原发恶性肿瘤切除后骨缺损
肱骨近端是骨原发恶性肿瘤好发部位
,手术切除是最主要的治疗方式。肱骨肿瘤切除后常用重建方法包括肿瘤型假体、同种异体骨、同种异体骨复合自体骨、自体锁骨移植等
,但对于肿瘤切除范围较长,残余肱骨无法固定肿瘤型假体或异体骨大小不匹配的儿童患者,重建肱骨近端更是一种挑战。游离腓骨重建作为一种生物重建方式广泛用于外伤、感染、肿瘤等造成的骨缺损
,特别是带血管蒂腓骨头骨骺移植,对于大范围骨缺损具有骨愈合率高、感染率低等优点
。但国内在肱骨近端肿瘤切除后使用带血管蒂腓骨头骨骺移植重建的报道较少。本研究通过 11 例儿童肱骨近端原发恶性肿瘤的临床和随访数据,分析肱骨近端切除后使用带血管蒂腓骨头骨骺移植重建的儿童患者手术结果、并发症和术后功能以及该手术的适应证。
材料与方法
一、纳入标准与排除标准
1. 纳入标准:( 1 ) 2009 年 5 月至 2018 年 5 月11 例在我院行手术治疗的儿童肱骨近端恶性肿瘤患者;( 2 ) 年龄 < 14 岁者;( 3 ) 肿瘤位于肱骨近端者;( 4 ) 组织学证实为骨原发恶性肿瘤者;( 5 ) 为初次手术治疗者;( 6 ) 肿瘤切除后采用带血管蒂自体腓骨头骨骺移植方式重建者。
2. 排除标准:( 1 ) 移植腓骨不包含腓骨头者;( 2 ) 使用带血管蒂腓骨头骨骺移植同时复合同种异体骨重建者。
二、一般资料
数据来自我院骨与软组织肿瘤临床数据库和影像数据库
。本研究共纳入 11 例,男 9 例,女2 例,年龄 4.6~13.5 岁,平均 ( 9.0±2.45 ) 岁。根据WHO 骨肿瘤分类,经典型骨肉瘤 10 例,Ewing 肉瘤1 例。
三、治疗方法
所有患者入院后完善常规影像检查及病理检查,明确诊断后行 4 个周期化疗。化疗后进行影像学评估,其后手术治疗。
手术中肱骨肿瘤切除采用 Henry 切口,根据MSTS 外科边界定义,实施肿瘤广泛切除。切除肿瘤后仔细解剖旋肱前动静脉或旋肱后动静脉作为膝下外侧动静脉的受体血管,解剖肱深动静脉作为腓动静脉的受体血管。
肱骨近端恶性肿瘤治疗需要将肱骨近端骨及周围软组织一并切除,而保留上肢远端功能。为了保留肘关节功能,肱骨近端肿瘤切除后需重建肩关节稳定性及上臂长度,维持上臂肌肉张力。肱骨近端的重建方式有很多种。肿瘤型假体是最常见的重建方式,此方式可以提供术后早期稳定性,有成熟产品应用,可及性好,且不需要牺牲自体其它部位组织,但假体置换后出现的并发症也受到越来越多的关注,如:感染、远期假体松动、脱位及假体断裂等
。生物材料重建也是肱骨近端重要重建方式,如:使用巴氏杀菌法、辐射或液氮冷冻进行瘤骨灭活再植,或者使用同种异体骨移植进行重建,或者使用 Capanna 技术用同种异体骨复合游离腓骨重建
。当然,生物重建也面临一定自身缺陷,如:肿瘤溶骨明显,骨皮质强度差不适于进行灭活再植,而同种异体骨面临组织相融性问题,这些会导致骨折、骨吸收、不愈合、感染等风险
。
arcpy.DefineProjection_management(os.path.join(newgdb , da) , sr)
市、县(区)财政每年都要安排专项资金,支持农村产业融合发展。同时,还要大力整合各类涉农资金,向产业融合新业态、新产业重点倾斜。
在进行作文教学的时候,很多的老师都能够听见学生发出抱怨之声:唉,又是写作文;这题目怎么写等等。因为面对作文,学生都不知从何处下手,经常是一篇作文布置下去很久,还需要老师一次又一次的催促才能够交上来。由于学生的年龄较小,所以他们的认知水平非常有限,导致学生对枯燥乏味的写作失去兴趣,在加上老师在教学写作的时候使用的不恰当的教学方式,这更是导致写作成了师生心中共同的迫切需要解决一个难题。
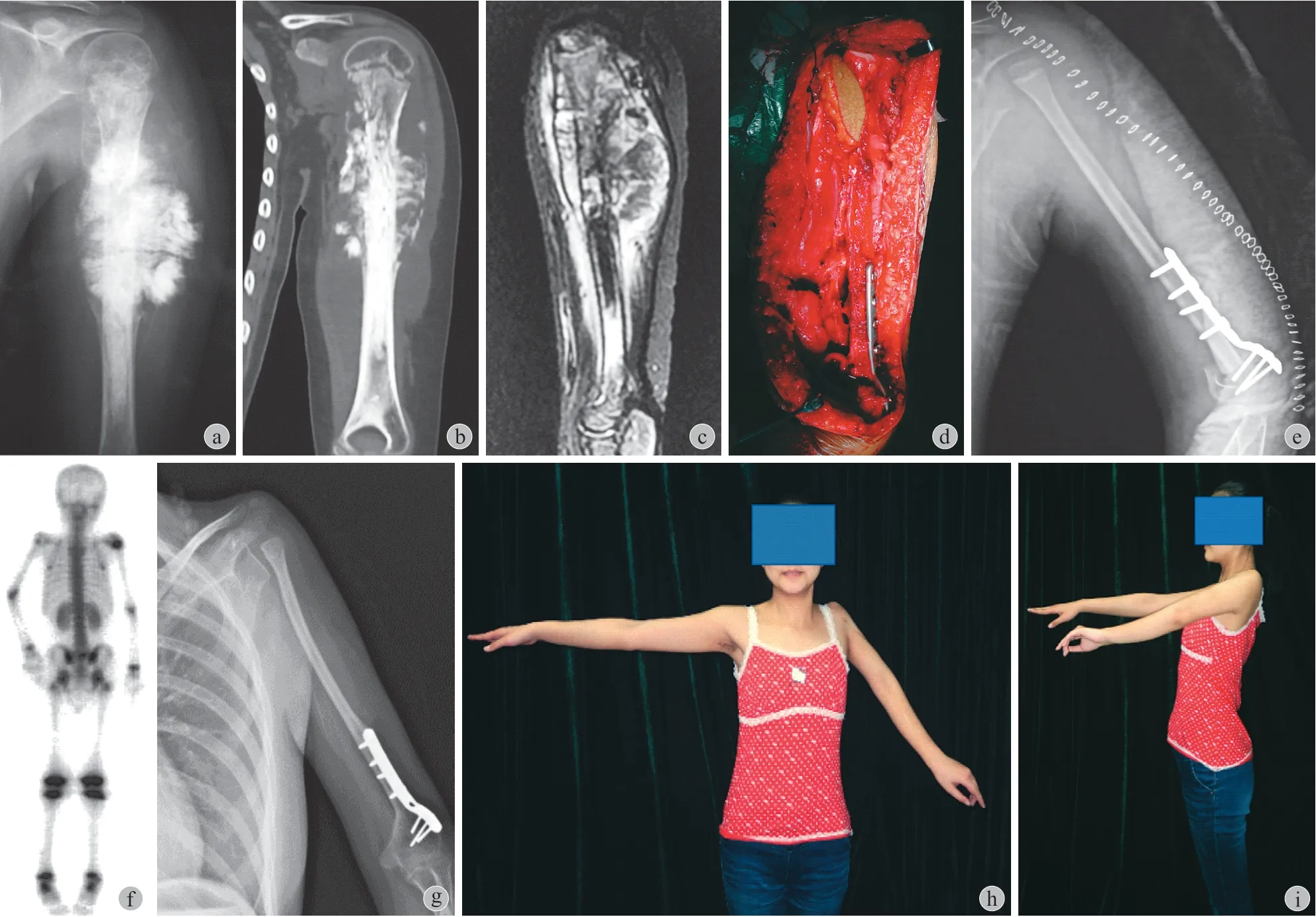
术后化疗 12~15 个疗程。术后第 2 天开始主动手腕和手指锻炼以及肩部和肘部周围肌肉的等长锻炼。术后 2 周开始主动进行肩肘关节功能锻炼,开始锻炼时采取非对抗阻力方式,约术后 2 个月开始部分对抗重力,至影像学观察到骨愈合后才完全对抗重力锻炼。术后早期使用颈腕吊带保护至移植骨远端愈合。骨愈合后仍需保护,减少负重,避免发生骨折。
四、随访
术后的前 2 年,每 3 个月随访 1 次,术后第3~5 年,每 6 个月随访 1 次,其后每年随访 1 次。随访内容包括肿瘤学方面 ( 生存、复发、转移情况 )和功能评估 ( 并发症、肢体长度、活动度、功能评分等 )。每次随访均行 X 线检查,监测骨愈合状态,每半年至 1 年全身骨扫描检查,监测是否出现骨转移及根据移植骨放射性摄取水平判断移植骨存活情况。功能评分采用美国肌肉骨骼肿瘤学会评分系统( MSTS 评分 ),上肢评分包括:疼痛、功能、手部位置、手部活动、抬举能力和情绪接受度。
五、评估方法和统计学处理
按《公路圬工桥涵设计规范》JTG D61-2005第5.1.11条,计算跨径的1/1 000为30 mm,恒载与活载作用下主拱圈拱顶最大下挠0.925 mm,主拱圈竖向刚度满足规范要求。
结 果
本组 11 例均顺利完成手术。术中切除肱骨后缺损:12.5~21.5 cm,平均 ( 16.9±2.8 ) cm;手术时间:300~660 min,平均 ( 475±114 ) min;术中出血量:400~1000 ml;平均 ( 840±220 ) ml。3 例保留监测皮岛患者术后皮岛血运良好。
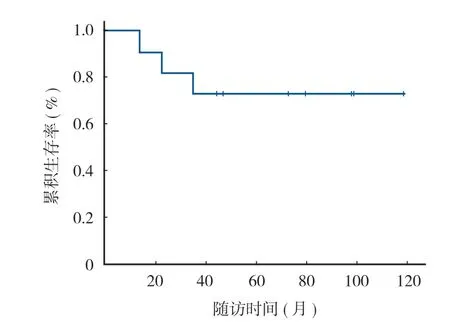
本组 11 例随访 13~118 个月,中位随访时间72 个月,平均 ( 66.0±35.4 ) 个月。随访期内 1 例Ewing 肉瘤,2 例骨肉瘤患者因多发转移分别于术后22 个月、13 个月、35 个月死亡,其余患者无瘤生存,总体 5 年生存率 72.7% ( 图 2 )。

本组患者未出现臂丛神经损伤、感染及伤口不愈合并发症。术后移植骨愈合时间:2.8~6.2 个月,平均 ( 3.9±1.2 ) 个月,骨扫描随访均可见移植骨正常放射性摄取。随访期内未出现移植骨骨折及内固定失效。骨骺闭合前,移植骨最多纵向生长 1~11 mm,中位值每年 1.5 mm,平均 ( 2.9±3.1 ) mm。未观察到移植骨肥大增粗表现。
本试验的加载制度参考美国钢结构抗震规定(AISC—341—05)[15]。加载过程是以层间位移角控制的,层间位移角为梁端位移与加载点至柱中心距离之比。加载循环表如表2所示。
使用钢板将腓骨与残余肱骨固定,腓骨与残余肱骨直径不一致,保持一侧皮质接触即可。在显微镜下,将膝下外侧动静脉与旋肱前 / 后动静脉吻合,将腓动静脉与肱深动静脉吻合,恢复腓骨供血。将残余肩袖及肩关节囊与上胫腓关节囊及股二头肌肌腱缝合重建肩关节稳定性 ( 图 1 )。
术中所有患者均仔细分离保护了腓总神经,但术后 2 例出现腓总神经麻痹,足下垂,予口服神经营养药物对症治疗,术后半年均自行恢复。所有患者术后均可正常行走。
随访期间所有患者均无肩关节脱位,患者肩关节外展 10°~40°,平均 ( 28.2±10.1 ) °;前屈 10°~65°,平均 ( 33.6±15.8 ) °;MSTS 评分 60%~70%,平均 65%,失分主要原因是手部无法上举,但患者对手术满意度均较高。
讨 论
采集带血管蒂自体腓骨头及骨干采用小腿外侧入路,小心分离并保护腓总神经,解剖并保留膝下外侧动静脉作为腓骨头供血血管,保留腓动静脉作为腓骨干供血血管。其中 3 例取腓骨同时保留了监测皮岛。腓骨采集长度由肿瘤切除长度决定,一般采集长度与切除长度相同。采集腓骨头时,尽量保留上胫腓关节囊及部分股二头肌肌腱。采集腓骨完成后,将残余股二头肌腱用缝线固定在胫骨上,维持膝关节外侧稳定性。
对于儿童肱骨近端恶性肿瘤患者,在选择重建方式时受到更多限制,而且年龄越小其所受影响越大
。首先,目前使用的肿瘤型假体是参照成人定制的,其肱骨头直径大无法置入肩胛盂;假体直径大,局部软组织覆盖差;骨内固定假体柄直径大,长度长,无法置入残余骨固定;如定制极小直径假体柄,远期假体折断风险明显升高。同理,对于同种异体骨使用也存在相似问题,目前能获取的同种异体骨主要来自成人,其直径远远超过儿童患者自身肱骨直径,术中难以稳定固定,易发生脱位。其次,儿童患者还面临生长及其造成的肢体不等长问题。为解决儿童患者肱骨近端肿瘤切除后重建困难问题,使用自体骨移植也是一种选择。有些报道中使用同侧锁骨重建肱骨近端骨缺损获得成功
,但锁骨长度有限,根据笔者的测量,一般儿童患者应用锁骨重建长度最大 120~130 mm,对于肿瘤范围较长患者不适用。也有作者报道了使用带血管蒂腓骨头骨骺移植重建方式,使用这种方式重建虽然具有手术时间较长、需较高显微手术技巧、需牺牲部分自体组织等缺点,但随着移植骨成活,会表现出较高的骨愈合率、低感染率、自身生长减少肢体不等长,具有较好的远期疗效
。
对于带血管蒂游离腓骨移植,受体血管可选择胫前动静脉
或者腓动静脉
。Taylor 等
与 Ejiri等
报道,单独使用胫前动静脉或者腓动静脉都可能造成移植骨近端或远端血供不足。因此,Ad-El等
推荐使用双蒂保证血供。本组患者肿瘤范围均较长,平均手术切除 17 cm,为保证移植腓骨血供良好,本组病例均采用双蒂方式,近端吻合膝下外侧动静脉,远端吻合腓动静脉。术后 3 例保留监测皮岛病例,皮岛血运良好;随访期间骨扫描显示,所有患者移植腓骨都有正常放射性摄取,表明移植腓骨成活。最终所有移植腓骨与肱骨残端均愈合,平均愈合时间 3.9 个月。虽然使用双蒂供血延长了手术时间,但对于移植骨远期血运及成活效果良好。
在随访期内,可以观察到移植腓骨纵向生长,约每年 1.5 mm,这一数据低于 Innocenti 等
与Medrykowski 等
报道的腓骨生长数据,但最终功能评估时,短肢对 MSTS 评分影响不大,患者也表示可以接受。Ghoneimy 等
与 Saleh 等
都曾报道,腓骨移植后会出现肥大增粗表现,笔者在下肢使用腓骨重建的病例中也观察到此现象,但本组病例仅观察到移植腓骨随年龄增长而正常长大,并未观察到腓骨肥大增粗。腓骨移植后肥大增粗主要是应力刺激造成
,本组患者都是年龄较小的儿童,患者无须负重工作;且为了避免骨折,术后要求患者减少患肢负重;患者术后肩关节活动差,患者主要使用腕部及手部功能,这些都导致移植骨所受应力不足以刺激骨质增生。同样在 de Boet 等
与Ejiri 等
报道中上肢病变经腓骨移植后移植骨肥大增粗出现率也很低。
本组带血管蒂自体腓骨头骨骺移植重建肱骨近端儿童患者术后 MSTS 评分仅为 65%,低于 Tsuda等
与 van de Sande 等
报道中使用肿瘤型假体重建及同种异体骨重建患者,扣分原因主要是因为术后肩关节活动受限,手部无法上举造成。对于儿童患者,局部肌肉薄弱,为保证肿瘤切除达到良好外科边界,本组患者手术中几乎将三角肌及肩袖完全切除,无法提供患者抬肩的动力,因此患者上肢外展仅能达到平均 29°,前屈 34°。但移植腓骨重建了上臂长度及肩关节稳定性,保留了上臂外旋及内旋功能,保留了良好的肘关节屈伸活动、前臂旋转功能,为精确控制肘关节及远端腕关节及手部功能提供了可能,故患者在手部功能得分均为满分,并且均表现出良好的接受情绪。
对于肱骨近端恶性肿瘤切除后,仍首选使用肿瘤型假体重建;对于切除肱骨近端肿瘤后残余肱骨无法固定肿瘤型假体的儿童患者,才选择使用带血管蒂腓骨头骨骺移植,这项手术对显微外科技术要求高,手术时间长,近 9 年来,我科有 11 例采用此方式治疗。这也是本组入选患者少、没有对照组的原因。同样,在目前现有类似报道中病例数也都较少
,如进行更多病例的详尽研究,可能需要多中心联合研究。
7个Ⅰ类海风锋个例合成的1 000 hPa垂直速度水平分布(图6),显示与海风锋的锋区配合,沿海岸近地面为垂直速度上升区(虚线负值区),苏北海州湾北部、苏南长江口、苏中沿岸分别有垂直上升中心,苏北最强,苏南次之,苏中的较弱。其中,苏北垂直速度最强中心可达-0.1 Pa·s-1,这可能与低层小高压底部的横向低槽区以及苏北连云港的山地地形有关,它们均有利于来自海上的气流向上爬升。此外苏南长江口地区的辐合中心,也与此处的气旋式环流(图5)有关。总体而言,江苏沿海地区地面为辐合上升运动区,形成了海风锋区域的对流活跃环境。
总之,带血管蒂自体腓骨头骨骺移植用于儿童肱骨近端肿瘤切除后骨缺损重建,愈合率高,远期并发症少,是能保持良好肘关节以远上肢功能的出色外科手术,通过更多病例积累和更长时间随访,会积累更多病例的信息,进一步验证这种有前途的外科技术的功能结果。
[1] Niu X, Xu H, Inwards CY, et al. Primary bone tumors:epidemiologic comparison of 9200 patients treated at Beijing Ji Shui Tan Hospital, Beijing, China, with 10 165 patients at mayo clinic, rochester, minnesota[J]. Arch Pathol Lab Med, 2015,139(9):1149-1155. DOI: 10.5858/arpa.2014-0432-OA.
[2] Guven MF, Aslan L, Botanlioglu H, et al. Functional outcome of reverse shoulder tumor prosthesis in the treatment of proximal humerus tumors[J]. J Shoulder Elbow Surg, 2016,25(1):e1-e6. DOI: 10.1016/j.jse.2015.06.012.
[3] van de Sande MA, Dijkstra PD, Taminiau AH. Proximal humerus reconstruction after tumour resection: biological versus endoprosthetic reconstruction[J]. Int Orthop, 2011,35(9):1375-1380. DOI: 10.1007/s00264-010-1152-z.
[4] Lu Y, Xiao X, Li M, et al. Use of vascularized fibular epiphyseal transfer with massive bone allograft for proximal humeral reconstruction in children with bone sarcoma[J]. Ann Surg Oncol, 2021, 28(12):7834-7841. DOI: 10.1245/s10434-021-10032-y.
[5] Calvert GT, Wright J, Agarwal J, et al. Is claviculo pro humeri of value for limb salvage of pediatric proximal humerus sarcomas[J]? Clin Orthop Relat Res, 2015, 473(3):877-882.DOI: 10.1007/s11999-014-3814-4.
[6] Semaya Ael S, Badawy E, Hasan M, et al. Management of posttraumatic bone defects of the tibia using vascularised fibular graft combined with Ilizarov external fixator[J]. Injury, 2016,47(4):969-975. DOI: 10.1016/j.injury.2016.01.033.
[7] Xu C, Orec R, Mathy JA. Both bone forearm infected nonunion: report of a one-bone free fibula flap salvage and literature review[J]. Hand (N Y), 2020, 15(4):NP51-NP56.DOI: 10.1177/1558944719857168.
[8] Errani C, Ceruso M, Donati DM, et al. Microsurgical reconstruction with vascularized fibula and massive bone allograft for bone tumors[J]. Eur J Orthop Surg Traumatol,2019, 29(2):307-311. DOI: 10.1007/s00590-018-2360-2.
[9] Ejiri S, Tajino T, Kawakami R, et al. Long-term follow-up of free vascularized fibular head graft for reconstruction of the proximal humerus after wide resection for bone sarcoma[J].Fukushima J Med Sci, 2015, 61(1):58-65. DOI: 10.5387/fms.2015-3.
[10] 徐海荣, 牛晓辉, 李远, 等. 北京积水潭医院原发骨肿瘤 9200例分析[J]. 骨科临床与研究杂志, 2016, 1(1):51-54,61. DOI:10.3969/j.issn.2096-269X.2016.01.010.
[11] Tsuda Y, Fujiwara T, Stevenson JD, et al. The long-term results of extendable endoprostheses of the humerus in children after the resection of a bone sarcoma[J]. Bone Joint J, 2020,102-B(1):64-71. DOI: 10.1302/0301-620X.102B12.BJJ-2020-0124.R1.
[12] Lee SY, Jeon DG, Cho WH, et al. Are pasteurized autografts durable for reconstructions after bone tumor resections[J]?Clin Orthop Relat Res, 2018, 476(9):1728-1737. DOI: 10.1007/s11999.0000000000000100.
[13] Outani H, Takenaka S, Hamada K, et al. A long-term follow-up study of extracorporeal irradiated autografts in limb salvage surgery for malignant bone and soft tissue tumors: a minimum follow-up of 10 years after surgery[J]. J Surg Oncol, 2020,121(8):1276-1282. DOI: 10.1002/jso.25918.
[14] Li Y, Yang Y, Huang Z, et al. Bone defect reconstruction with autologous bone inactivated with liquid nitrogen after resection of primary limb malignant tumors: an observational study[J].Medicine (Baltimore), 2020, 99(24):e20442. DOI: 10.1097/MD.0000000000020442.
[15] Ogink PT, Teunissen FR, Massier JR, et al. Allograft reconstruction of the humerus: complications and revision surgery[J]. J Surg Oncol, 2019, 119(3):329-335. DOI: 10.1002/jso.25309.
[16] Hopyan S. Reconstruction for bone tumours of the shoulder and humerus in children and adolescents[J]. J Child Orthop,2021, 15(4):358-365. DOI: 10.1302/1863-2548.15.210131.
[17] Barbier D, De Billy B, Gicquel P, et al. Is the clavicula pro humero technique of value for reconstruction after resection of the proximal humerus in children[J]? Clin Orthop Relat Res,2017, 475(10):2550-2561.
[18] Stevenson JD, Doxey R, Abudu A, et al. Vascularized fibular epiphyseal transfer for proximal humeral reconstruction in children with a primary sarcoma of bone[J]. Bone Joint J, 2018,100-B(4):535-541. DOI: 10.1302/0301-620X.100B4.BJJ-2017-0830.R1.
[19] Estrella EP, Wang EH. A comparison of vascularized free fibular flaps and nonvascularized fibular grafts for reconstruction of long bone defects after tumor resection[J].J Reconstr Microsurg, 2017, 33(3):194-205. DOI: 10.1055/s-0036-1594299.
[20] Taylor GI, Wilson KR, Rees MD, et al. The anterior tibial vessels and their role in epiphyseal and diaphyseal transfer of the fibula: experimental study and clinical applications[J].Br J Plast Surg, 1988, 41(5):451-469. DOI: 10.1016/0007-1226(88)90001-x.
[21] Abou-Foul AK, Fasanmade A, Prabhu S, et al. Anatomy of the vasculature of the lower leg and harvest of a fibular flap:a systematic review[J]. Br J Oral Maxillofac Surg, 2017,55(9):904-910. DOI: 10.1016/j.bjoms.2017.08.363.
[22] Ad-El DD, Paizer A, Pidhortz C. Bipedicled vascularized fibula flap for proximal humerus defect in a child[J]. Plast Reconstr Surg, 2001, 107(1):155-157. DOI: 10.1097/00006534-200101000-00024.
[23] Innocenti M, Delcroix L, Romano GF, et al. Vascularized epiphyseal transplant[J]. Orthop Clin North Am, 2007, 38(1):95-101. DOI: 10.1016/j.ocl.2006.10.003.
[24] Medrykowski F, Barbary S, Gibert N, et al. Vascularized proximal fibular epiphyseal transfer: two cases[J]. Orthop Traumatol Surg Res, 2012, 98(6):728-732. DOI: 10.1016/j.otsr.2012.05.009.
[25] Ghoneimy AME, Sherbiny ME, Kamal N. Use of vascularized fibular free flap in the reconstruction of the femur in pediatric and adolescent bone sarcomas: complications and functional outcome[J]. J Reconstr Microsurg, 2019, 35(2):156-162. DOI:10.1055/s-0038-1668142.
[26] Saleh R, Yurianto H, Pasallo P, et al. Good functional outcome evaluation of free vascularized fibular head graft (FVFHG) as treatment after resection of giant cell tumor (GCT) campanacci 3 at proximal humerus: a case report[J]. Int J Surg Case Rep,2019, 61:254-258. DOI: 10.1016/j.ijscr.2019.07.075.
[27] Wada T, Usui M, Nagoya S, et al. Resection arthrodesis of the knee with a vascularised fibular graft. Medium- to long-term results[J]. J Bone Joint Surg Br, 2000, 82(4):489-493. DOI:10.1302/0301-620x.82b4.10574.
[28] de Boer HH, Wood MB. Bone changes in the vascularised fibular graft[J]. J Bone Joint Surg Br, 1989, 71(3):374-378.DOI: 10.1302/0301-620X.71B3.2722923.
[29] Bachy M, Mascard E, Dana C, et al. Clinical and radiological results of vascularized fibular epiphyseal transfer after bone tumor resection in children[J]. Orthop Traumatol Surg Res,2020, 106(7):1319-1324. DOI: 10.1016/j.otsr.2020.03.037.
[30] Houdek MT, Wellings EP, Saifuddin H, et al. Composite-free vascularized fibular epiphyseal flap and proximal humeral allograft for proximal humerus reconstruction in a pediatric patient[J]. J Am Acad Orthop Surg Glob Res Rev, 2021,5(7):e21.00009. DOI: 10.5435/JAAOSGlobal-D-21-00009.

