槲皮素对胫骨平台骨折新西兰兔模型骨形态生成蛋白/Runt相关转录因子2信号通路的影响Δ
韩胜义,胡 培,孟 和,高 宇,郭子龙
(张家口市第一医院骨科,河北 张家口 075041)
胫骨平台骨折作为骨科常见骨折类型,主要由坠落和内、外翻性暴力撞击膝关节所致[1]。研究结果表明,胫骨平台作为前后交叉韧带、内外侧副韧带等多韧带附着点,主要由胫骨近侧干骺端及2个关节面组成[2]。胫骨平台骨折病情复杂,多伴有半月板、周围韧带等损伤,对膝关节功能造成严重影响,严重威胁患者的日常生活[3]。随着事故发生风险的增加,胫骨平台骨折发生率升高,骨愈合过程等生物力学成为研究焦点[4]。相关研究结果指出,骨形态生成蛋白(BMP)/Runt相关转录因子2(Runx2)信号通路通过调节骨分化、矿化,参与骨骼生长、修复、愈合及股骨形成等生理过程[5]。槲皮素作为植物界广泛存在的五羟基黄酮类化合物,其药用价值较高。槲皮素具有良好的抗炎、抗氧化、抗凋亡及抑制破骨细胞吸收等活性作用,但目前其多被应用于肿瘤领域,对软骨细胞影响的研究报道较少[6]。以上述内容为背景,本研究建立了胫骨平台骨折新西兰兔模型,探讨槲皮素对胫骨平台骨折BMP/Runx2信号通路的影响,现报告如下。
1 材料
1.1 实验动物
选取40只健康新西兰大白兔,由湖南太平生物科技有限公司提供。兔龄8~11个月,平均(9.5±1.2)个月;体重3 213~4 009 g,平均(3 611.0±338.3)g。保持饲养环境相对湿度40%~50%,温度(24.1±1.3)℃,12 h昼夜交替照明饲养1周。给予标准兔科动物饲料喂养,不限制饮食、饮水。本研究已获得我院伦理委员会批准,动物批准文号为WYZLL〔2020〕1479。
1.2 仪器
苏木精-伊红染色(HE染色)试剂盒(碧云天生物技术研究所,货号为C0105);DM750型显微镜(德国Leica公司),MultiskanTMFC型酶标仪[赛默飞世尔科技(中国)有限公司];骨钙素酶联免疫吸附试验(ELISA)试剂盒(江苏艾博因生物科技有限公司);炎症因子[肿瘤坏死因子α(TNF-α)、白细胞介素(IL)1β和IL-10]ELISA试剂盒(滁州仕诺达生物科技有限公司)。
1.3 药品与试剂
槲皮素(美国MedChemExpress公司,批号为HY-18085,纯度>98.0%);戊巴比妥钠(上海新亚药业有限公司);鼠抗BMP一抗(美国BD公司,货号为D163283);鼠抗Runx2二抗(美国Abcam公司,货号为ab23981)。
2 方法
2.1 建模及分组
随机选取10只新西兰大白兔不做处理作为正常组。对剩余30只新西兰大白兔通过骨缺损法建立胫骨3 mm骨缺损模型[7]。采用3%戊巴比妥钠30 mg/kg进行耳缘静脉注射麻醉,麻醉后固定大白兔四肢,选取后肢剪毛,脱毛,消毒,依次切开皮肤皮下组织关节囊,暴露胫骨平台。采用双层钢锯造成家兔胫骨平台骨折,骨折处宽度约3 mm,深度约为胫骨1/3。术毕缝合伤口,手术操作均在严格无菌条件下进行,术后给予常规抗炎抗感染治疗,见图1。术后分笼饲养,自由进食。通过X线检查证实造模成功。建模过程中死亡1只,成功29只,分为模型组9只,低、高剂量组各10只。

图1 胫骨平台骨折建模过程Fig 1 Modeling process of tibial plateau fracture
2.2 给药干预
对各组新西兰兔进行药物干预,参考人与动物体表面积等效剂量比值,计算新西兰兔给药剂量,以1/2等效剂量为低剂量,2倍为高剂量,对低、高剂量组新西兰兔分别按照100、200 mg/kg槲皮素灌胃,灌胃体积为20 mL/kg,1日1次,正常组、模型组新西兰兔给予等体积0.9%氯化钠溶液干预,1日1次,各组均连续干预7 d。
2.3 标本采集及HE染色
药物干预7 d后,抽取新西兰兔静脉血5 mL,离心处理20 min(转速2 500 r/min,离心半径10 cm),分离上清液,-70 ℃环境下待检。栓塞致死,取左胫骨标本(骨折断端及其周围骨痂组织约1 cm),置于4%甲醛溶液中固定,24 h后脱水处理,石蜡包埋,切成4 μm切片,依次经二甲苯、梯度乙醇水化后,苏木精浸染5 min,盐酸乙醇分色,流水冲洗,1%伊红染色2~3 min,脱水、透明、封片,光镜下(倍数200,视野0.75)进行观察。
2.4 观察指标
(1)血清骨钙素、炎症因子(TNF-α、IL-1β和IL-10)水平检测:采用双抗体夹心ELISA法测定,在酶标仪下测定具体数值,参照试剂盒说明书和仪器操作进行。(2)蛋白质印迹法测定各组新西兰兔骨痂组织中BMP、Runx2蛋白表达:取出待检新西兰兔骨痂组织加入RIPA裂解液裂解、匀浆,以BCA试剂盒测定总蛋白浓度,SDS-PAGE电泳、转膜后,5%脱脂牛奶封闭2 h,加入一抗(1∶400),过夜孵育。加入二抗(1∶5 000)孵育2 h,显影、定影、冲洗、晾干,扫描胶片,采用Image J软件分析BMP、Runx2表达,以β-actin为内参,目标蛋白水平=目标条带灰度值/β-actin条带灰度值。
2.5 统计学方法
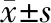
3 结果
3.1 四组新西兰兔骨痂组织病理图
正常组骨小梁密集、排列整齐有序;模型组骨小梁稀少,存在明显炎症反应;低剂量组骨小梁较少,结构稍稀疏;高剂量组骨小梁结构增多,配列较为整齐,见图2。

A.正常组;B.模型组;C.低剂量组;D.高剂量组A.normal group; B.model group; C.low-dose group; D.high-dose group图2 四组新西兰兔骨痂组织病理图(HE,×200)Fig 2 Pathologic figure of bone callus of four groups of New Zealand rabbits (HE,×200)
3.2 四组新西兰兔血清骨钙素水平比较
正常组、模型组、低剂量组和高剂量组新西兰兔血清骨钙素水平分别为(3.79±0.25)、(2.36±0.18)、(3.00±0.21)和(3.57±0.29)ng/mL。相比正常组,模型组、低剂量组和高剂量组新西兰兔血清骨钙素水平降低;相比模型组,低剂量组、高剂量组新西兰兔血清骨钙素水平较高;与低剂量组相比,高剂量组新西兰兔血清骨钙素水平升高,上述差异均有统计学意义(P<0.05)。
3.3 四组新西兰兔胫骨平台骨折炎症因子水平比较
相比正常组,模型组、低剂量组和高剂量组新西兰兔血清TNF-α、IL-1β和IL-10水平升高;相比模型组,低剂量组、高剂量组新西兰兔血清TNF-α、IL-1β和IL-10水平较低;相比低剂量组,高剂量组新西兰兔血清TNF-α、IL-1β和IL-10水平较低,上述差异均有统计学意义(P<0.05),见表1。

表1 四组新西兰兔血清TNF-α、IL-1β和IL-10水平比较Tab 1 Comparison of serum levels of TNF-α, IL-1β and IL-10 among four groups of New Zealand rabbits
3.4 四组新西兰兔骨痂组织中BMP、Runx2蛋白表达比较
相比正常组,模型组、低剂量组和高剂量组新西兰兔骨痂组织BMP、Runx2表达升高;相比模型组,低剂量组、高剂量组新西兰兔骨痂组织BMP、Runx2表达较高;相比低剂量组,高剂量组新西兰兔骨痂组织BMP、Runx2表达较高,上述差异均有统计学意义(P<0.05),见表2、图3。

表2 四组新西兰兔骨痂组织BMP、Runx2蛋白表达比较Tab 2 Comparison of BMP and Runx2 protein expression in bone callus tissues of four groups of New Zealand rabbits

A.正常组;B.模型组;C.低剂量组;D.高剂量组;与正常组相比,aP<0.05;与模型组相比,bP<0.05;与低剂量组相比,cP<0.05A.normal group; B.model group; C.low-dose group; D.high-dose group; vs. normal group, aP<0.05; vs. model group, bP<0.05;vs. low-dose group, cP<0.05图3 四组新西兰兔骨痂组织中BMP、Runx2蛋白表达比较Fig 3 Comparison of BMP and Runx2 protein expression in bone callus tissues of four groups of New Zealand rabbits
4 讨论
胫骨平台位于股骨与胫骨下段接触面,属于膝关节重要负荷结构。其骨折发生多因高能量创伤所致,因其损伤复杂多变,且极易造成周围韧带及半月板损伤,对患者膝关节功能及稳定性造成影响[8-9]。目前,手术治疗作为主要手段,在稳定关节面的同时会导致炎症反应发生风险增加,对预后造成威胁。降钙素、甲状旁腺素等化学药在骨折治疗方面具有一定的效果,但存在一定的不良反应,因此不适合长期使用[10-11]。
槲皮素属于黄酮类化合物,在金丝桃苷、芸香苷和槲皮苷中含量较高,可有效促进MC3T3-E1细胞的成骨细胞分化,对RAW264.7细胞中破骨细胞生成产生抑制[12]。相关动物实验结果表明,槲皮素可有效促进成骨细胞分化、增殖,并提高骨钙素、骨保护素等骨标志物及骨形态发生蛋白-2的表达[13]。有研究结果指出,槲皮素可阻止核因子κB(NF-κB)受体活化,NF-κB和细胞外调节蛋白激酶信号级联激活受到抑制进而消除破骨细胞生成及分化[14]。本研究结果显示,通过槲皮素对胫骨平台骨折新西兰兔进行干预,可提高血清骨钙素水平,与既往研究结果一致[13]。表明槲皮素可有效提高骨钙素水平,干预效果显著。
骨愈合过程属于高度复杂且有序的生物学修复过程,生物化学、生物物理因子和血液循环状态的调控及人体微量因子水平均对骨愈合过程造成影响[15]。相关研究结果显示,多条信号通路在骨形成控制中积极参与,常见通路包括Smad、BMP和Runx2通路[16]。相关资料表明,成骨细胞分化受BMP/Runx2等多种信号通路调控,且BMP/Runx2信号通路与骨形成具有密切关联[17-18]。Runx2作为成骨细胞分化关键转录调控因子,是BMP的下游靶点。Runx2可对成骨细胞特异性基因的表达产生直接调节作用,同时在骨形成的多个阶段中均发挥重要调控作用[19-20]。本研究结果发现,槲皮素可对骨痂组织中的BMP、Runx2 mRNA的表达产生促进效果。BMP属于转化生长因子超家族成员,是骨形成的重要蛋白质,可诱导骨髓间充质干细胞向成骨细胞分化,是骨形成的重要蛋白质,其缺失会导致自发性骨折。由此表明,槲皮素可显著提高骨愈合效果,BMP/Runx2信号通路参与其中。但临床中有关槲皮素对BMP/Runx2信号通路影响的相关研究较少,其实效性有待进一步研究证实。
综上所述,在胫骨平台骨折新西兰兔实验中,槲皮素可有效抑制炎症介质活性,为新西兰兔骨质生长提供良好的生物环境,加速骨愈合,并证实槲皮素作用机制与激活BMP/Runx2信号通路具有相关性,为胫骨平台骨折药物研究提供重要参考依据。但本研究样本量较小、观察时间有限,且未对不同药物使用剂量进行研究,需进一步增加样本量对其干预效果进行深入研究。

