甜菜夜蛾肽聚糖识别蛋白基因SePGRP-SA的克隆及功能鉴定
李亚子, 赵 丹, 郭晓昌, 吴 涵, 刘兆瑞, 郭 巍, 2,*
(1.河北农业大学植物保护学院, 河北保定 071001; 2.中国农业科学院研究生院, 北京 100081)
甜菜夜蛾Spodopteraexigua是一种重要的全球多食性害虫,其先天免疫系统在病原微生物入侵时会高效地产生免疫应答。昆虫体内先天性免疫缺陷(immune deficiency, IMD)和Toll信号通路是重要的肠道免疫防御机制(Medzhitov and Janeway, 2002; Hoffmann, 2003; Akiraetal., 2006; Takeuchi and Akira, 2009),当昆虫取食病原微生物后,肽聚糖识别蛋白(peptidoglycan recognition protein, PGRP)被激活,介导抗菌肽(antimicrobial peptides, AMPs)的产生,抵御病原微生物的侵染(Medzhitov and Janeway, 2002)。PGRP最早在家蚕Bombyxmori血淋巴中发现,分子量约为19 kD,是昆虫中已发现的重要模式识别受体类型之一(Yoshidaetal., 1996)。根据PGRP分子量大小,可将其分为短型PGRP(PGRP-S)、中型(PGRP-I)和长型PGRP(PGRP-L)3类(Dziarski and Gupta, 2006; 朱晓林, 2016; Houetal., 2019)。目前在家蚕、黑腹果蝇Drosophilamelanogaster和桔小实蝇Bactroceradorsalis等多种昆虫中报道了PGRP基因的功能(Yoshidaetal., 1996; Kimetal., 2003; 张迎新等, 2020),而甜菜夜蛾SePGRP-SA基因的生物学功能及其对病原微生物的免疫响应尚不清楚。
PGRP在识别外来病原微生物以及激活IMD和Toll信号通路中发挥着重要作用。因此,本研究以甜菜夜蛾为研究对象,克隆甜菜夜蛾SePGRP-SA的全长基因并进行序列分析;利用qRT-PCR方法对SePGRP-SA基因进行时空表达模式分析;通过RNAi技术沉默SePGRP-SA基因,研究对抗菌肽相关基因以及中肠细菌载量的影响,分析甜菜夜蛾对苏云金芽胞杆菌BacillusthuringiensisBt-GS57菌株敏感性的变化,进一步阐明PGRP在甜菜夜蛾免疫系统中的生物学功能,为实现害虫的绿色防控提供理论依据。
1 材料与方法
1.1 材料
供试甜菜夜蛾为河北农业大学昆虫生化与分子生物学实验室人工饲养(温度为27±1℃,相对湿度为75%±10%,光周期为14L∶10D),以人工饲料饲养(Hanetal., 2014; Breeschotenetal., 2019)。
Bt-GS57菌株、甜菜夜蛾幼虫肠道共生菌蜡样芽胞杆菌Bacilluscereus和肠球菌属Enterococcus细菌均由本实验室分离保存。
1.2 RNA的提取及cDNA合成
收集甜菜夜蛾卵、1-5龄幼虫、预蛹和蛹及4龄幼虫的中肠、马氏管、血淋巴、脂肪体、围食膜和表皮,各样品质量10~20 mg。利用TIANGEN RNAprep Pure动物组织总RNA提取试剂盒(TIANGEN,北京)提取总RNA。琼脂糖凝胶电泳和BioPhotometer D30分光光度计(Eppendorf,德国)检测RNA的质量和浓度。参照GoScriptTMReverse Transcription System (Promega,美国)说明书反转录合成cDNA。
1.3 SePGRP-SA全长基因的克隆
根据本实验室获得的甜菜夜蛾基因组数据获取SePGRP-SA全长序列,利用Primer Premier 6.0软件设计SePGRP-SA基因全长扩增引物SePGRP-SA-F/R(表1)。以甜菜夜蛾4龄幼虫中肠cDNA为模板,扩增SePGRP-SA基因。PCR反应体系(25 μL): cDNA模板2 μL, 上下游引物(10 mmol/L)各0.5 μL, 2×PrimeSTAR®Max Premix(TaKaRa, 大连)12.5 μL, ddH2O 9.5μL。PCR反应条件: 94℃ 3 min; 94℃ 30 s, 55℃ 30 s, 72℃ 40 s, 35个循环; 72℃ 10 min。PCR产物经0.8%琼脂糖凝胶电泳检测,并利用DNA凝胶回收试剂盒(TaKaRa,大连)纯化回收目的条带;将纯化的目的DNA片段与pEASY-Blunt Cloning载体(TransGen Biotech,北京)连接,连接产物转化至大肠杆菌EscherichiacoliDH5α感受态细胞(TaKaRa,大连),利用通用M13 F/R引物筛选阳性克隆,送至上海生工生物股份有限公司进行测序。
1.4 SePGRP-SA基因生物信息学分析
利用DNAMAN V6.0软件预测SePGRP-SA基因的开放阅读框以及蛋白分子量和等电点;使用SignalP 5.1Server(http: ∥www.cbs.dtu.dk/services/SignalP/)和TMHMM-2.0(http: ∥www.cbs.dtu.dk/services/TMHMM-2.0)分析信号肽和跨膜结构域;使用在线软件SMART(http: ∥smart.embl-heidelberg.de/smart)和ProtParam(http: ∥web.expasy.org/protparam)进行SePGRP-SA结构域分析;利用NetPhos 2.0预测SePGRP-SA的磷酸化位点;利用Clustal X将SePGRP-SA基因氨基酸序列与其他物种PGRP基因氨基酸序列进行同源比对,并利用MEGA 6软件的邻接(neighbor-joining, NJ)法构建系统发育树。
1.5 SePGRP-SA基因时空表达模式分析
采用qRT-PCR方法,检测甜菜夜蛾SePGRP-SA在不同发育阶段和4龄幼虫组织中的转录水平,所用引物序列见表1。qRT-PCR体系(20 μL): cDNA模板1 μL, 上下游引物(10 mmol/L)各1 μL, SYBR Mix 10 μL, ddH2O 7 μL。在荧光实时定量PCR仪(CFX96 Touch Real-Time PCR Detection System, BIO-RAD)上运行qRT-PCR,反应程序: 95℃ 30 s; 95℃ 5 s, 56℃ 30 s, 72℃ 30 s, 39个循环; 95℃ 1 min, 50℃ 1 min, 65~95℃,每5 s升温0.5℃,进行溶解曲线的扩增。每个样品进行3次技术重复。以甜菜夜蛾SeActin作为内参基因,引物序列见表1。采用2-ΔΔCt法分析基因表达量数据(Livaketal., 2001)。
1.6 SePGRP-SA基因的RNAi
以甜菜夜蛾中肠cDNA和增强型绿色荧光蛋白基因EGFP的质粒pGR107为模板,以PGRP-T7-ds1FF/PGRP-ds1FR, PGRP-T7-ds1RF/PGRP-ds1RR, T7-dsEGFPFF/dsEGFPFR以及T7-dsEGFPRF/dsEGFPRR为引物进行PCR扩增获得合成dsRNA的正反向模板,引物信息见表1。以T7 RiboMAXTMExpress RNAi System试剂盒(Promega,美国)体外转录合成甜菜夜蛾SePGRP-SA基因和EGFP基因的双链RNA(分别为dsSePGRP-SA和dsEGFP)。分别注射2 μL dsSePGRP-SA(5 μg/μL)和dsEGFP(5 μg/μL) 至4龄甜菜夜蛾幼虫体内,以注射dsEGFP和ddH2O分别为阴性对照和空白对照,每个处理设3次生物学重复,每个生物学重复10头幼虫,注射后正常饲养。注射dsRNA 72 h后,收取甜菜夜蛾中肠,并提取总RNA,反转录合成cDNA,利用qRT-PCR技术(同1.5节)检测SePGRP-SA基因沉默效率和抗菌肽相关基因Cecropin,Attacin和Defensin的相对表达情况。
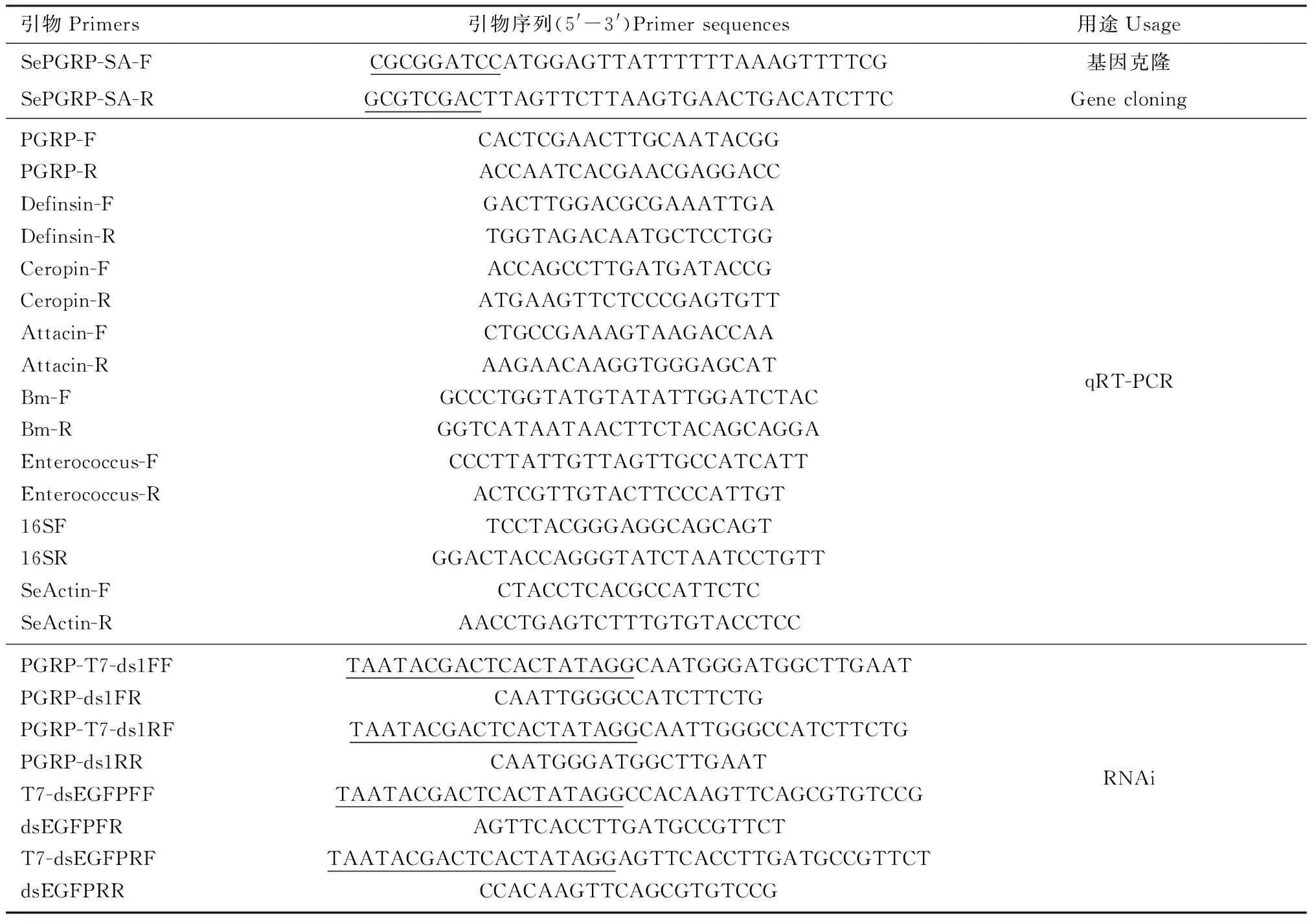
表1 本研究所用引物Table 1 Primers used in this study
1.7 SePGRP-SA基因沉默后中肠细菌载量的检测
收集1.6节注射dsRNA 72 h后的甜菜夜蛾幼虫中肠(含内容物),利用血液/细胞/组织基因组DNA提取试剂盒(TIAGEN公司)提取中肠总DNA。以16SF/16SR为引物(表1)(Weietal., 2017),qRT-PCR检测SePGRP-SA基因沉默后中肠细菌16S rRNA基因的表达量,分析中肠细菌载量的变化,同时以Enterococcus-F/Enterococcus-R和Bm-F/Bm-R为引物(Queipo-Ortunoetal., 2012; 李聪, 2019)(表1), qRT-PCR检测肠球菌属16S rRNA基因和蜡样芽胞杆菌DNA旋转酶B亚基基因gyrB的的表达量,分析中肠肠球菌属载量及蜡样芽胞杆菌载量的变化,qRT-PCR反应体系和反应程序同1.5节。
1.8 通过RNAi沉默SePGRP-SA后甜菜夜蛾幼虫对Bt-GS57敏感性的变化检测
将对甜菜夜蛾高杀虫活性的Bt-GS57菌株接种于LB液体培养基,30℃ 220 r/min过夜培养。第2天按1∶100(v/v)的比例接种于1/2 LB液体培养基,30℃ 200 r/min培养45 h,收集胞晶混合物,稀释至4 mg/mL,-80℃冰箱冻存备用。
收集1.6节注射dsSePGRP-SA, dsEGFP(阴性对照)和ddH2O(空白对照)的甜菜夜蛾4龄幼虫,于24 h后置于含300 μL Bt-GS57胞晶混合物(4 mg/mL)的人工饲料(Zhangetal., 2017) 中0, 24, 48, 72, 96和120 h,分别统计ddH2O, dsEGFP, dsSePGRP-SA, ddH2O+Bt-GS57, dsEGFP+Bt-GS57和dsSePGRP-SA+Bt-GS57处理组5 d内幼虫的校正死亡率,每个处理设3次生物学重复,每个生物学重复15头幼虫。计算公式:校正死亡率(%)=(处理组幼虫死亡率-对照组幼虫死亡率)/(1-对照组幼虫死亡率)×100%。
1.9 饲喂Bt-GS57菌株后甜菜夜蛾4龄幼虫SePGRP-SA和抗菌肽相关基因表达变化检测
取300 μL Bt-GS57菌株胞晶混合物(4 mg/mL)均匀涂布饲料表面,对照组为不含Bt-GS57的人工饲料。将4龄第1天甜菜夜蛾幼虫饥饿处理12 h后,置于饲料上。每个处理进行3次生物学重复,每个重复15头幼虫。于饲喂0, 24, 48和72 h后分别提取中肠组织、RNA及合成cDNA(方法同1.2节)。利用qRT-PCR技术(同1.5节)检测SePGRP-SA及抗菌肽相关基因Cecropin,Attacin和Defensin在Bt-GS57诱导后的表达变化。
1.10 数据分析
采用SPSS22.0软件进行统计分析,利用单因素方差分析(ANOVA)及最小显著差法(LSD)分析SePGRP-SA基因的时空表达模式和SePGRP-SA基因沉默后对甜菜夜蛾中肠抗菌肽相关基因和中肠细菌载量影响的差异显著性;Bt-GS57对甜菜夜蛾SePGRP-SA及抗菌肽相关基因表达量的影响采用 Student氏独立样本t检验分析差异显著性。
2 结果
2.1 SePGRP-SA基因的克隆和序列
PCR扩增获得甜菜夜蛾SePGRP-SAcDNA(GenBank登录号: MW265930),其开放阅读框长576 bp,编码191个氨基酸,预测蛋白分子量为21.59 kD,等电点为8.00,具有PGRP保守结构域(第21-163位氨基酸)和Ami2结构域(第32-169位氨基酸),含有信号肽序列(第1-19位氨基酸),为分泌型蛋白;NetPhos 2.0软件分析结果显示,SePGRP-SA包含4个Ser、1个Thr和1个Tyr磷酸化位点(图1)。通过NCBI Blast分析比对可知甜菜夜蛾SePGRP-SA氨基酸序列与斜纹夜蛾SpodopteralituraSlPGRP的亲缘关系最近,氨基酸序列一致性最高,为91.1%。
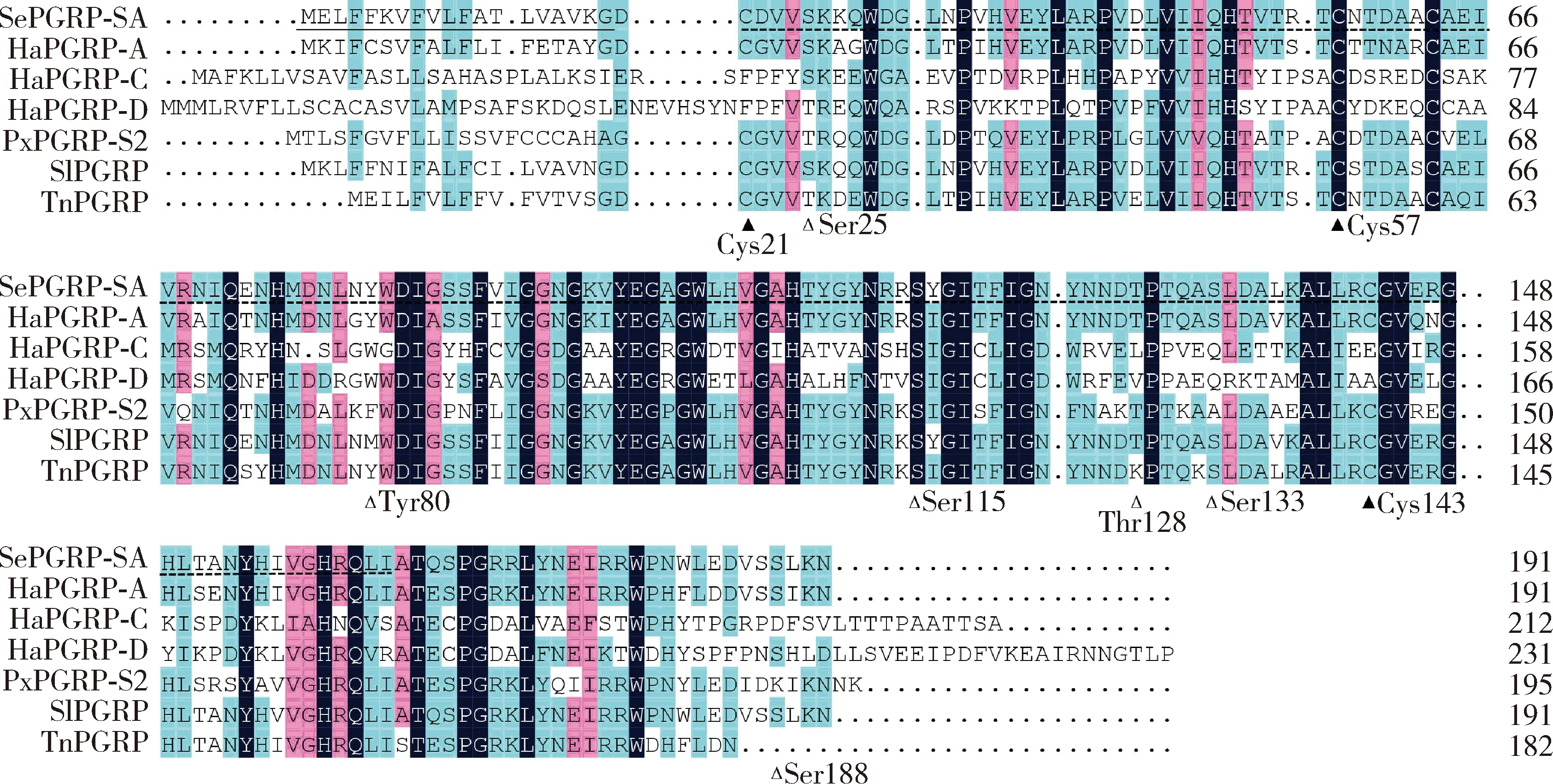
图1 甜菜夜蛾SePGRP-SA和其他鳞翅目昆虫PGRP氨基酸序列比对Fig.1 Amino acid sequence alignment of SePGRP-SA of Spodoptera exigua with PGRP proteins from other lepidopteran insectsPGRP蛋白来源物种及其GenBank登录号Origin species of PGRP proteins and their GenBank accession numbers: SlPGRP: 斜纹夜蛾Spodoptera litura, XP_022825445.1; HaPGRP-A: 棉铃虫Helicoverpa armigera, KF954940.1; HaPGRP-C: 棉铃虫Helicoverpa armigera, JX082167.1; HaPGRP-D: 棉铃虫Helicoverpa armigera, KF985962.1; PxPGRP-S2: 小菜蛾Plutella xylostella, MG570190; TnPGRP: 粉纹夜蛾Trichoplusia ni, O76537.1.黑色实线标注的为SePGRP-SA的信号肽序列, 短虚线标注为PGRP的结构域, 空心三角标注的为SePGRP的磷酸化位点, 实心三角标注的为SePGRP的保守的半胱氨酸残基。The signal peptide sequence of SePGRP-SA protein is marked with black solid line, the PGRP domain is labeled with short dashed line, the phosphorylation site of SePGRP-SA is marked with hollow triangle and the conserved cysteine of SePGRP-SA is marked with solid triangle.
2.2 SePGRP-SA系统进化分析
甜菜夜蛾SePGRP-SA与其他昆虫PGRP的序列比对结果显示,SePGRP-SA与斜纹夜蛾SpodopteralituraSlPGRP、粉纹夜蛾TrichoplusianiTnPGRP、棉铃虫HelicoverpaarmigeraHaPGRP-A及HaPGRP的相似度最高,表明这几种昆虫的PGRP序列同源性较高。SePGRP-SA基因编码的氨基酸序列与功能已知昆虫PGRP的相应氨基酸序列进化分析结果显示,甜菜夜蛾SePGRP-SA氨基酸序列与斜纹夜蛾SlPGRP聚在同一分支上,表明两者的亲缘关系较近(图2)。

图2 邻接法构建的基于氨基酸序列的甜菜夜蛾与其他昆虫PGRPs系统发育树Fig.2 Phylogenetic tree of PGRPs of Spodoptera exiguaand other insects constructed by neighbor-joiningmethod based on amino acid sequencePGRPs来源物种及GenBank登录号Origin species of PGRPs and their GenBank accession numbers: PxPGRP-S2: 小菜蛾Plutella xylostella, MG570190; ApPGRP-A: 柞蚕Antherea pernyi, AME17978.1; ApPGRP-B: 柞蚕Antherea pernyi, AME17979.1; ApPGRP-C: 柞蚕Antherea pernyi, AME17980.2; BmPGRP-S1: 家蚕Bombyx mori, NM_001043371.1; BmPGRP-S2: 家蚕Bombyx mori, KF906541.1; BmPGRP-S5: 家蚕Bombyx mori, NM_001043393.1; BmPGRP: 家蚕Bombyx mori, XP_028043866.1; DmPGRP-SC2: 黑腹果蝇Drosophilia melanogaster, NP_610410.1; HaPGRP-A: 棉铃虫Helicoverpa armigera, KF954940.1; HaPGRP-C: 棉铃虫Helicoverpa armigera, JX082167.1; HaPGRP-D: 棉铃虫Helicoverpa armigera, KF985962.1; HaPGRP: 棉铃虫Helicoverpa armigera, XP_021192951.1; MsPGRP-1A: 烟草天蛾Manduca sexta, AF413068.1; MsPGRP-1B: 烟草天蛾Manduca sexta, AF413061.1; MsPGRP-2: Manduca sexta, GQ293365.1; SlPGRP: 斜纹夜蛾Spodoptera litura, XP_022825445.1; TnPGRP: 粉纹夜蛾Trichoplusia ni, O76537.1; PmPGRP: 金凤蝶Papilio machaon, XP_014370321.1; PxPGRP: 柑橘凤蝶Papilio xuthus, XP_013170473.1; OfPGRP: 亚洲玉米螟Ostrinia furnacalis, XP_028160362.1.
2.3 SePGRP-SA基因表达模式
发育表达谱结果显示,SePGRP-SA在甜菜夜蛾各发育阶段均有表达,在4-5龄幼虫、预蛹和蛹中高表达,显著高于在卵和其他龄期幼虫,其中5龄幼虫的表达量是卵期的971.5倍,蛹期的表达量是卵期的1 898.6倍(图3: A);从4龄幼虫开始,SePGRP-SA的相对表达量呈逐渐上升趋势(P<0.05)。组织表达谱结果表明,SePGRP-SA在4龄甜菜夜蛾各个组织中均有所表达,血淋巴中的相对表达量最高,其次是围食膜、马氏管和中肠中的,血淋巴中SePGRP-SA表达量是脂肪体中的65.1倍,围食膜中SePGRP-SA的表达量是脂肪体中的16.7倍(图3: B)。

图3 SePGRP-SA在甜菜夜蛾不同发育阶段(A)及4龄幼虫不同组织(B)中的表达谱Fig.3 Expression profiles of SePGRP-SA in different developmental stages (A)and different tissues of the 4th instar larvae (B) of Spodoptera exiguaEg: 卵Egg; 1st-5th: 分别为1-5龄幼虫1st-5th instar larvae, respectively; Pre: 预蛹Prepupa; Pu: 蛹Pupa; MG: 中肠Midgut; MT: 马氏管Malpighian tubules; HE: 血淋巴Hemolymph; FB: 脂肪体Fat body; PM: 围食膜Peritrophic membrane; EP: 表皮Epidermis.图中数据为3次独立生物学重复的平均值±标准误;柱上不同小写字母表示不同组间基因表达量差异显著(P<0.05, LSD).图4和5同。Data in the figure are mean±SE of three independent experiments.Different lowercase letters above bars indicate significant differences in the gene expression level among different groups (P<0.05, LSD).The same for Figs.4 and 5.
2.4 SePGRP-SA基因沉默效果及沉默SePGRP-SA对甜菜夜蛾4龄幼虫抗菌肽相关基因表达量的影响
注射dsEGFP(阴性对照)的甜菜夜蛾4龄幼虫SePGRP-SA和抗菌肽相关基因表达量与注射ddH2O(空白对照)的相比无明显变化;注射dsSePGRP-SA72 h后,SePGRP-SA基因表达量与对照比显著下调了95.26%(图4: A)(P<0.05),实现了SePGRP-SA基因的沉默。此时,抗菌肽相关基因的表达量显著下调(P<0.05),其中Ceropin的表达量下调了55.64%,Attacin的表达量下调了97.00%,Defensin的表达量下调了83.95%(图4: B-D),表明甜菜夜蛾幼虫SePGRP-SA参与调控抗菌肽相关基因的表达。

图4 通过RNAi沉默SePGRP-SA对甜菜夜蛾4龄幼虫中肠抗菌肽相关基因的表达的影响Fig.4 Effects of silencing SePGRP-SA by RNAi on the expression of antimicrobial peptide-related genesin the midgut of the 4th instar larvae of Spodoptera exiguaA: SePGRP-SA; B: Ceropin; C: Attacin; D: Defensin.dsEGFP: 阴性对照Negative control; ddH2O: 空白对照Blank control.RNAi 72 h后测定基因表达量。The expression levels of genes were detected at 72 h after RNAi.
2.5 SePGRP-SA基因沉默对甜菜夜蛾4龄幼虫中肠细菌载量的影响
与空白对照组(ddH2O)相比,dsEGFP处理组甜菜夜蛾4龄幼虫中肠的细菌载量、肠球菌属载量和蜡样芽胞杆菌载量没有明显变化(图5)。注射dsSePGRP-SA72 h后,幼虫中肠细菌载量、肠球菌属载量和蜡样芽胞杆菌载量分别是对照组的1 424.15, 2 266.29和2 361.24倍(图5: A-C)(P<0.05),推测甜菜夜蛾SePGRP-SA基因在维持中肠菌群稳态中起重要作用。

图5 通过RNAi沉默SePGRP-SA对甜菜夜蛾4龄幼虫中肠细菌载量的影响Fig.5 Effects of silencing SePGRP-SA by RNAi on the bacterial load in the midgut of the 4th instar larvae of Spodoptera exiguaA: 细菌16S rRNA基因16S rRNA gene of bacteria; B: 肠球菌属16S rRNA基因16S rRNA gene of Enterococcus; C: 蜡样芽胞杆菌gyrB基因gyrB gene of Bacillus cereus.dsEGFP: 阴性对照Negative control; ddH2O: 空白对照Blank control.RNAi 72 h后测定中肠细菌载量。The bacterial load in the midgut was detected at 72 h after RNAi.
2.6 SePGRP-SA基因沉默后甜菜夜蛾幼虫对Bt-GS57敏感性的变化
注射dsEGFP后,Bt-GS57引起的甜菜夜蛾幼虫72 h和120 h(已发育到5龄)的校正死亡率与空白对照(ddH2O)比无显著差异(P>0.05),72 h校正死亡率为50.00%,120 h校正死亡率为53.33%;注射dsSePGRP-SA后,Bt-GS57引起的幼虫72 h校正死亡率为73.33%,120 h校正死亡率为96.67%(图6)。表明SePGRP-SA基因沉默后,甜菜夜蛾对Bt-GS57的敏感性显著增加,推测4龄幼虫SePGRP-SA基因在防御Bt侵染中有重要作用。

图6 通过RNAi沉默SePGRP-SA后甜菜夜蛾幼虫对苏云金芽胞杆菌Bt-GS57的敏感性Fig.6 Sensitivity of Spodoptera exigua larvae to Bacillusthuringiensis Bt-GS57 after silencingSePGRP-SA by RNAidsEGFP: 阴性对照Negative control; ddH2O: 空白对照Blank control.注射dsSePGRP-SA, dsEGFP (阴性对照)和ddH2O (空白对照)的甜菜夜蛾4龄幼虫24 h后, 置于含300 μL Bt-GS57胞晶混合物 (4 mg/mL)的无菌饲料中, 统计甜菜夜蛾幼虫在取食(Bt-GS57侵染)0, 24, 48, 72, 96和120 h的校正死亡率。折线图上不同小写字母表示120 h时甜菜夜蛾幼虫的校正死亡率差异显著 (P<0.05, LSD)。At 24 h post injection of dsSePGRP-SA, dsEGFP (negative control) and ddH2O (blank control), the 4th instar larvae of S. exigua were placed in axenic diet containing 300 μL of Bt-GS57 cell mixture (4 mg/mL).The corrected mortality rates of S. exigua larvae were counted at 0, 24, 48, 72, 96 and 120 h after feeding (Bt-GS57 infection).Different lowercase letters on line graph indicate significant differences in the corrected mortality of S. exigua larvae at 120 h (P<0.05, LSD).
2.7 Bt-GS57对甜菜夜蛾4龄幼虫SePGRP-SA及抗菌肽相关基因表达量的影响
qRT-PCR结果(图7)显示,4龄幼虫SePGRP-SA的表达量在取食(Bt-GS57侵染)24和48 h极显著高于对照组(ddH2O)(P<0.01)。在Bt-GS57侵染24 h时,SePGRP-SA的表达水平较对照组上升4倍,48 h时表达量最高,较对照组上升9倍(图7: A)。取食Bt-GS57后抗菌肽相关基因Ceropin,Attacin和Defensin在24和48 h时的表达量极显著高于对照组(P<0.01)(图7: B-D),与SePGRP-SA基因的变化趋势一致。研究结果显示甜菜夜蛾SePGRP-SA参与识别Bt,并调控中肠抗菌肽相关基因的表达。

图7 苏云金芽胞杆菌Bt-GS57对甜菜夜蛾4龄幼虫中肠SePGRP-SA及相关抗菌肽基因表达量的影响Fig.7 Effects of Bacillus thuringiensis Bt-GS57 on the expression levels of SePGRP-SA and antimicrobialpeptide-related genes in the midgut of the 4th instar larvae of Spodoptera exiguaA: SePGRP-SA; B: Ceropin; C: Attacin; D: Defensin.ddH2O: 空白对照Blank control.甜菜夜蛾4龄幼虫饥饿处理12 h后, 置于含300 μL Bt-GS57胞晶混合物(4 mg/mL)的无菌饲料中。qRT-PCR测定甜菜夜蛾幼虫在取食(Bt-GS57侵染)0, 24, 48和72 h时, 幼虫中肠中SePGRP-SA及抗菌肽基因(Ceropin, Attacin, Defensin)的相对表达量。图中数据为3次独立生物学重复的平均值±标准误;柱上双星号表示差异极显著(P<0.01, Student氏t检验)。After starvation treatment for 12 h, the 4th instar larvae of S. exigua were placed in axenic diet containing 300 μL of Bt-GS57 cell mixture (4 mg/mL).The expression levels of SePGRP-SA and AMP genes (Ceropin, Attacin, Defensin) in the midgut of S. exigua larvae at 0, 24, 48 and 72 h after feeding (Bt-GS57 infection) were assayed by qRT-PCR.Data in the figure are mean±SE of three independent experiments.The double asterisk above bars indicates extremely significant difference (P<0.01, Student’s t-test).
3 讨论
肽聚糖识别蛋白PGRP是识别外来微生物的重要模式识别受体之一(Kamareddineetal., 2018; Keshavarzetal., 2020),在昆虫的先天免疫中发挥着重要的识别和免疫功能(Wangetal., 2019)。本研究克隆得到了甜菜夜蛾SePGRP-SA全长cDNA,系统进化树分析可知SePGRP-SA与斜纹夜蛾SlPGRP亲缘关系最高(图2),且在不同物种间比较保守,暗示着其功能的保守性。通过对SePGRP-SA表达模式分析,SePGRP-SA从卵期到蛹期均有表达(图3: A),表明其参与甜菜夜蛾全部生活史。SePGRP-SA在4龄幼虫血淋巴中高表达(图3: B),表明SePGRP-SA可能在甜菜夜蛾肠道免疫中发挥了重要作用。
已有研究证明,PGRP-SA和PGRP-SD通过识别革兰氏阳性细菌Lys型肽聚糖(peptidoglycan, PGN)后,激活Toll信号通路,产生AMPs,来防御病原微生物的侵染(Micheletal., 2001; Aggrawal and Silverman, 2007)。沉默PGRP基因后的小菜蛾,其下游抗菌肽基因Defensin,Cecropin,Moricin-2和Lysozyme的相对丰度降低,加入Bt后,小菜蛾存活率显著降低(Dawadietal., 2018)。本研究中甜菜夜蛾SePGRP-SA基因沉默后,下游抗菌肽相关基因Defensin,Cecropin和Attacin的表达下调(图4),显著增加了甜菜夜蛾对Bt-GS57菌株的敏感性(图6)。推测SePGRP-SA基因沉默后,甜菜夜蛾中肠细菌16S rRNA基因的相对表达量显著上调,细菌总量显著上升,中肠优势菌属肠球菌16S rRNA基因及条件致病菌蜡样芽胞杆菌的gyrB基因相对表达量也显著增加(图5),导致肠道微生物失调。Bt-GS57侵染甜菜夜蛾后,引起SePGRP-SA和抗菌肽相关基因表达量升高(图7),表明SePGRP-SA和抗菌肽相关基因相互作用以抵御病原微生物的侵染。本研究通过对SePGRP-SA基因的鉴定及序列分析,利用RNAi技术明确了SePGRP-SA基因在甜菜夜蛾肠道免疫调控中的重要作用,初步探索了Bt对肠道免疫基因的影响,为更好地利用Bt防治甜菜夜蛾等害虫提供了分子手段。

