猪呼吸道病原综合诊断
李 昊,周可磊,陈世云,周 军,马艳君,罗 凤
(1.西昌学院,四川 西昌 615013;2.四川省凉山彝族自治州农业农村局,四川 西昌; 3. 四川省西昌市农业农村局,四川 西昌;4.四川博策检查技术有限公司,四川 成都)
呼吸系统疾病、消化系统疾病和繁殖障碍性疾病是危害养猪业健康发展的最常见的三类疾病,其中猪呼吸道类疾病发生最为普遍,发病率30 % ~ 80 %,死亡率在5 % ~ 30 %,呼吸道疾病可发生在猪的各个日龄段[1]。随着我国养猪集约化程度的提高、气候的剧变以及环境中病原菌耐药性的增强,进一步加重了猪场猪呼吸道疾病发生[2-3]。在猪呼吸系统疾病发生过程中,免疫抑制性病毒如猪圆环病毒2型(Porcine circovirus type 2,PCV-2)、猪伪狂犬病毒(Pseudorabies virus,PRV)、猪瘟病毒(Classical swine fever virus,CSFV)和猪繁殖与呼吸综合征病毒(Porcine respiratory and reproductive syndrome virus, PRRSV)的感染或者潜伏感染是重要的病因之一,该类病毒能够抑制机体免疫,导致机体免疫力下降,为其他细菌性病原的的感染提供有利条件[4]。
猪圆环病毒病是由PCV-2引起的猪的一种免疫抑制的传染病,其临诊主要特征为消瘦、黄疸、体质下降、呼吸困难、腹泻、母猪繁殖障碍、内脏器官及皮肤的广泛病理变化[5]。目前认为,PCV-2可以感染猪的一生,不同生产阶段的猪感染后临床表现不同,但是对成年猪感染后一般呈亚临床状态,并成为重要传染源之一[6]。猪巴氏杆菌病(Swine pasteurellosis)又称猪肺疫,是由多杀性巴氏杆菌(Pm)引起猪的出血性败血症,是一种急性、热性传染病。急性型呈出血性败血症,呼吸极度困难[5]。慢性型多见于流行后期,主要呈现慢性肺炎或慢性胃肠炎症。时发腹泻,呈进行型营养不良,极度消瘦最后衰竭致死,给养猪业带来极大危害[7]。
2021年3月,四川省西昌市某育肥猪场发生以呼吸道障碍为特征的疫病,发病率高达35 %,死亡率约为8 %。为了准确诊断引起本次猪呼吸道疾病的病原以及筛选出有效药物,本试验进行了病原的分子检测、细菌分离鉴定与药敏试验,筛选出了针对该致病菌的敏感药物,并有针对性地提出了治疗和防控措施,为发病猪场疾病的诊断和制定有效的防治措施提供了参考。
1 材料和方法
1.1 材料
1.1.1 样本从发病场无菌采集3头疑似呼吸系统疾病症状的病死猪肺组织、淋巴结和扁桃体样品放入冰盒,由四川博策检查技术有限公司进行检测。
1.1.2 主要试剂和仪器总核酸提取试剂盒购自台湾瑞基海洋生物科技有限公司,胰蛋白胨大豆琼脂,抗菌药物药敏纸片及微量生化反应管购自杭州微生物试剂有限公司;反转录试剂盒、2XTaq PCR Master Mix、DNA分子量标准DL2000购自宝生物工程(大连)有限公司。
用到的主要仪器有:全自动核酸提取仪(金瑞鸿捷(厦门)生物科技有限公司)、ABI PCR仪(赛默飞世尔(上海)仪器有限公司)、君意凝胶成像仪(北京君意东方电泳设备有限公司)、恒温培养箱(上海跃进医疗器械有限公司)、高压灭菌锅(驰通仪器(上海)有限公司)。
1.2 方法
1.2.1 细菌和病毒的PCR/RT-PCR鉴定将3头病死猪(分别编号1、2、3)对应编号的肺脏、淋巴结和扁桃体等组织进行等体积混合,加入灭菌生理盐水进行研磨,反复冻融3次,8 000 r/min 离心2 min。取上清液200 μl进行核酸提取,根据总核酸提取试剂盒进行核酸提取,运用常规PCR和RT-PCR方法进行检测,其中,采用16 S通用引物扩增的产物送至生物公司测序。所用引物均由上海生工生物科技有限公司合成,详细序列见表1。

表1 引物序列信息
1.2.2 细菌分离和生化鉴定选取肺组织病变严重部位并置于超净台中,用酒精棉对其表面消毒,用无菌手术剪取深部组织并涂布于含有5 %新生牛血清的TSA平板上,接种环划线,置于37 ℃ 恒温箱中培养12~48 h后进行肉眼观察,挑取优势单菌落接种于含有5 % 新生牛血清的TSB液体培养基中,在160 r/min、37 ℃ 摇床中进行纯化培养。分别勾取纯培养物无菌接种于生化试验培养基中,37 ℃ 培养24~48 h后判定结果。
1.2.3 细菌药敏实验将纯化成功的菌种采用灭菌生理盐水进行清洗,稀释后并与麦氏比浊管比浊后选取浓度为3×108个活菌/ml,吸取0.1 ml菌液均匀涂布在整个血清琼脂培养基上,在超净工作台中干燥3~5 min后贴上杭州微生物试剂有限公司的药敏纸片(青霉素、阿莫西林、氨苄西林、头孢氨苄、头孢哌酮、头孢曲松、新霉素、丁胺卡那、氟苯尼考、硫酸新霉素、庆大霉素、链霉素、恩诺沙星、环丙沙星、强力霉素、诺氟沙星),于37 ℃ 培养18~24 h后根据说明书的判定标准确定药敏结果。
2 结果与分析
2.1 病猪病理剖检变化
发病猪群精神沉郁、体温升高、呼吸困难、口鼻流白色泡沫。剖检发现气管内有大量泡沫黏液(图1A),肺脏充血、出血、淤血(图1B)。

图1 病猪病理剖检变化
2.2 细菌和病毒的PCR/RT-PCR鉴定
病原分子检测结果表明3头猪均呈PCV-2阳性,而PRRSV、PRV和CSFV呈阴性,结果见图2;表明发病猪群主要为PCV-2感染。
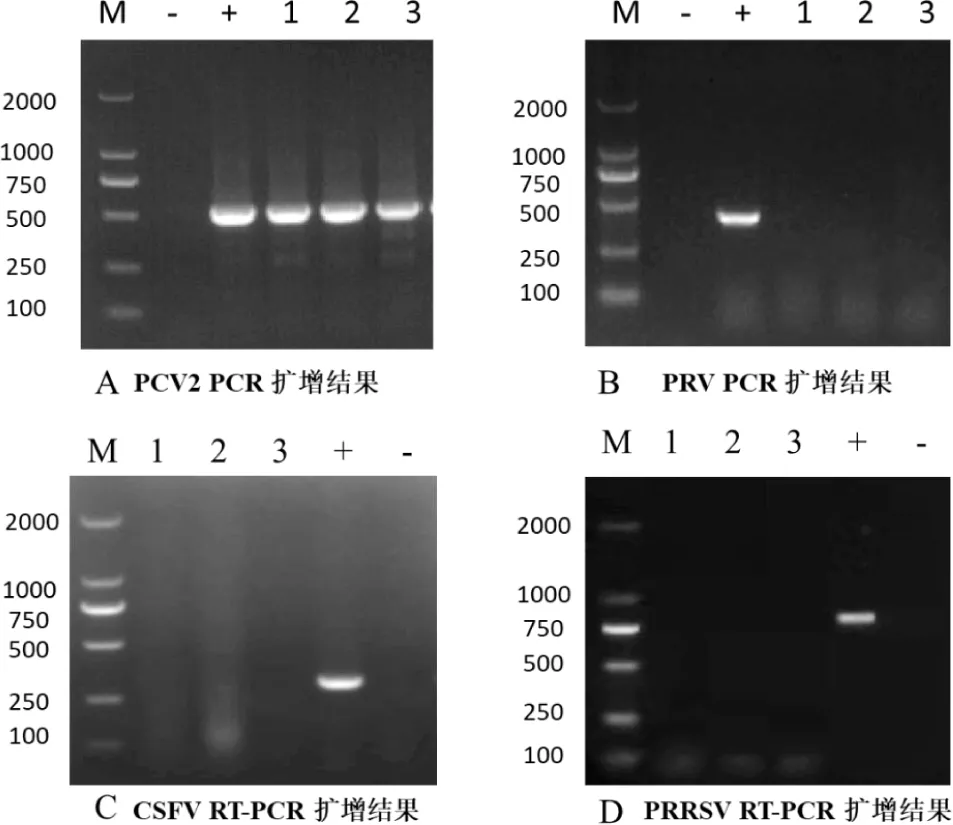
图2 病原PCR/RT-PCR检测结果
2.3 细菌的分离鉴定
肉眼观察菌落呈灰白色、光滑、湿润的菌落;挑取单菌落进行革兰氏及瑞氏染色,革兰氏染色呈阴性细小杆菌,瑞氏染色呈两极浓染的细菌。在麦康凯琼脂平板上不生长,生化试验结果为葡萄糖、蔗糖、果糖阳性,乳糖、阿拉伯糖、吲哚阴性,硝酸盐还原试验阳性,甲基红、石蕊、枸橼酸盐利用试验阴性,初步鉴定为多杀性巴氏杆菌。为了进一步确定病原,用16S通用引物检测细菌,结果扩增到1465bp目的片段,将该片段纯化后进行测序,测序结果与NCBI Blast序列比对分析,该分离菌为巴氏杆菌。

图3 16S rRNA PCR检测结果
以上结果表明导致本场本次发病的病原为PCV-2和巴氏杆菌混合感染。
2.4 分离菌药敏试验
如表2所示,分离菌株对头孢曲松、诺氟沙星、环病沙星、丁胺卡那等13种药物表现出了不同程度的敏感性,其中高敏药物10种,中敏药物3种,耐药药物3种(青霉素、阿莫西林和氟苯尼考)。

表2 分离菌株对16种药物的敏感性
3 讨论
目前我国许多养猪场呼吸道疾病病原复杂,临床生产中多以混合感染和继发感染为主[8]。引起猪呼吸道疾病原发性病原主要有PCV-2、PRRSV、PRV、CSFV、胸膜肺炎放线杆菌和猪肺炎支原体等,继发性病原主要有巴氏杆菌、副猪嗜血杆菌和猪链球菌等,尤其是PCV-2和PRRSV感染肺泡巨噬细胞,可引起严重免疫抑制,造成呼吸系统抵抗力下降,导致猪继发感染等[9]。此外猪场滥用抗生素导致许多细菌产生耐药性,致使发病后抗菌药物治疗效果不佳甚至无效果,造成严重经济损失[9]。
猪群携带圆环病原是PCV感染的必要条件,在饲养管理不善、通风不良、温湿度不适、免疫接种应激、不同来源和日龄的猪群混养等原因可综合导致猪群出现明显的临床症状病带来较大的经济损失。PCV感染引起免疫抑制,造成呼吸系统抵抗力下降,进而导致猪群易继发巴氏杆菌感染[10]。猪场可采取以下措施防控圆环病毒感染猪群:分区饲养,全进全出;加强疫苗的免疫,选择针对该场现有毒株的高抗原含量疫苗,制定合理的疫苗免疫程序;加强生物安全措施,避免交叉感染[11]。
巴氏杆菌广泛存在于正常猪的上呼吸道、扁桃体等器官和组织中,因而猪群巴氏杆菌的带菌率与猪群是否发生猪巴氏杆菌病并无直接关系[12]。一般认为动物在发病前已经带菌,当各种诱因使机体抵抗力降低时,病原菌即可乘虚侵入体内,经淋巴液进入血流,发生内源性感染[5]。目前,临床上控制猪巴氏杆菌病最有效、最快速的方法是使用抗菌药物进行治疗,但是随着抗菌药物大量、盲目的滥用,细菌的耐药性亦越来越严重,给食品安全和人类健康造成潜在的威胁。王久红等[13]研究表明,猪巴氏杆菌分离株对对大部分抗生素敏感,尤其是恩诺沙星、环丙沙星等沙星类抗生素,而链霉素、庆大霉素等药物对其抑制效果不明显,仅对林可霉素产生耐药性。胡星星等[14]研究表明,猪巴氏杆菌部分分离株对强力霉素、青霉素类、磺胺类、氨基糖苷类药物的耐药率相对较高,而对对氧氟沙星、多粘菌素B、头孢类和阿莫西林相对敏感。本研究中的分离菌株对多种药物高度敏感,为发病猪场筛选出了治疗性药物,但是本研究中的分离菌株已对3种药物产生了不同程度的耐药性。综合以上研究结果可以看出,猪巴氏杆菌在不同地域分离株对不同药物均已产生了一定的耐药性,其整体耐药性的发展趋势不容乐观,应加强重视。
猪场呼吸道疾病是威胁猪群健康和导致经济严重损失的主要疾病,本案例对猪出现明显的呼吸道等症状的病原进行检测,为PCV-2和巴氏杆菌混合感染所致,在此结果基础上,采取了将发病猪隔离,避免疫情扩散,紧急免疫。猪场使用高抗原含量的PCV-2疫苗进行紧急免疫,需注意一猪一针头。同时建议使用头孢曲松等高度敏感类药物进行肌肉注射,连续治疗3~5 d,观察患病猪的恢复情况或用恩诺沙星连续拌料5 d,停药7 d后使用环丙沙星连续拌料5 d,均按说明书剂量使用,或用用恩诺沙星饮水连续给药5 d,用于保健和预防。给药前猪群停水2 h,再让猪群自由饮用。同时加强环境消毒和饲养管理,实行全进全出生产模式,禁止混群,对发病猪及时隔离,并对病死猪进行无害化处理。加强消毒,每批次猪群转移后充分消毒并空栏7 d。加大空气流通,降低猪舍内氨气含量,改善栏舍空气质量。加强对饲养人员的管理,避免串栏,在进入猪舍前一定要消毒。通过以上措施,快速控制了疫情,降低了猪群的死亡率,为猪场挽回了损失。
现阶段,非洲猪瘟给我国养猪业造成了极大的损失,猪场应提高生物安全防控意识,及时隔离发病猪只,并做好消毒工作,在防控非洲猪瘟的同时,加强对PRRSV、PCV-2和PRV等病毒性病原的防控,净化这些疫病,提高猪场效益。本案例通过实验室诊断和猪场兽医的临床诊断结合,做出了合理的综合诊断。并根据检测结果,制定了一系列针对性的治疗及防控措施,通过连续跟踪回访,显示该措施切实可行,为猪场圆环病毒和巴氏杆菌病的诊断和防控提供了基本原则和数据上的支持。

