植物源抗冻蛋白对面筋蛋白性质影响研究进展
张艳杰,王金慧,艾志录,范会平*
1(河南农业大学 食品科学技术学院, 河南 郑州,450002)2(农业农村部大宗粮食加工重点实验室, 河南 郑州,450002)3(国家速冻米面制品加工技术研发专业中心, 河南 郑州,450002)
抗冻蛋白(antifreeze proteins, AFPs)又称热滞蛋白或是冰结构蛋白,可以抑制冰晶的生长,非依数性降低水溶液的冰点,但不改变溶液熔点,其在动植物、真菌和细菌中广泛存在[1]。植物源抗冻蛋白是植物在外界环境发生改变时植物本身为了使细胞免受迫害而产生的一种功能性蛋白。不同植物体内的抗冻蛋白的分布是不同的,但是它们都具有一定的抗冻活性。GB 2760—2011指出AFPs可以作为一类新型的食品添加剂运用到冷冻食品中,植物源AFPs逐渐成为研究热点[2]。
AFPs具有热滞活性、能修饰冰晶形态及抑制冰晶再结晶3个重要特征[3]。而植物源AFPs抑制冰晶再结晶的能力最强[4],因此植物源AFPs似乎更适合添加到冷冻食品中,通过抑制冰晶重结晶,减轻食品在零点以下附近波动产生的机械损伤,从而减轻其在冻藏或冻融过程中受到的机械损伤。本文从植物源AFPs的来源、特性以及对面筋蛋白性质的影响进行阐述。
1 植物源抗冻蛋白的概述
1.1 植物源抗冻蛋白的来源
迄今为止,可以检测到含有抗冻蛋白的植物已有60多种[5],其中有近20种已经被纯化出来。经过研究统计发现,植物源抗冻蛋白的热滞活性大多是<1 ℃,如苜蓿抗冻蛋白的热滞活性为0.52~0.54 ℃,胡萝卜抗冻蛋白的热滞活性为0.35~0.65 ℃。某些植物源抗冻蛋白还有其他的性质,如属于PR-10家族的樟子松的细胞中存在糖基化现象,可维持稳定性;沙冬青抗冻蛋白中存在过敏原等。本文对不同植物源抗冻蛋白植物类型、来源、性质及同源性蛋白进行了整理,如表1所示。植物源抗冻蛋白具有一定的热滞活性,多数是在0.1~1.0 ℃,云杉和女贞的抗冻蛋白的热滞活性较高,分别为2.19、2 ℃;桃中发现的抗冻蛋白的热滞活性较低,只有0.06 ℃。抗冻蛋白虽然在来源上相似,但是同源性不明显。

表1 植物源抗冻蛋白的来源、性质及同源性蛋白Table 1 Sources, properties and homologous proteins of plant antifreeze proteins

续表1
1.2 抗冻蛋白的特性
1.2.1 热滞活性
像蔗糖、NaCl等一般溶液的冰点和固液两相蒸气压平衡时的温度相等同,这时熔点及冰点是相同的。抗冻蛋白对物料的结冰和熔化过程的影响是不一样的,主要影响结冰过程,导致冰点比熔点低,这种差值称为热滞差值,抗冻蛋白能引起溶液的冰、熔点间差值的作用称为热滞活性,如图1所示。在一定范围中,抗冻蛋白的热滞活性可以使得生物体的细胞处于不冻的状态,从而避免冰晶在形成过程中对细胞膜的破坏。
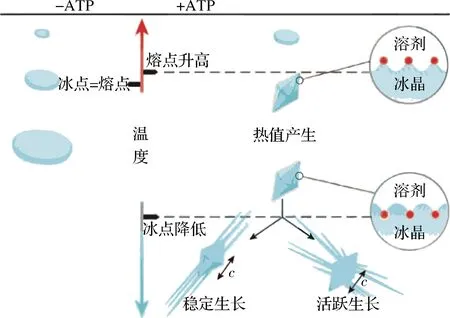
图1 抗冻蛋白热滞活性示意图[30]Fig.1 Schematic diagram of thermal hysteresis activity of antifreeze proteins[30]
1.2.2 修饰冰晶形态
抗冻蛋白能够和冰晶直接作用,不仅能抑制冰晶的生长,还能改变冰晶形态,减弱冰晶对细胞膜造成的机械损伤。根据热滞活性的高低,可将抗冻蛋白分为高、中热滞活性抗冻蛋白。不同热滞活性的抗冻蛋白和冰晶的结合位点不一样,中热滞活性的抗冻蛋白结合在冰晶的棱柱面或者是棱锥面上,高热滞活性的抗冻蛋白则是结合在冰晶的棱锥面之外、棱柱面之外和基面上,从而形成不同形态的冰晶。高热滞活性的抗冻蛋白和中热滞活性的抗冻蛋白形成的冰晶形态分别是似圆盘形状和六棱锥形状[31-34]。其示意图如图2所示。
1.2.3 抑制重结晶
在冰点温度下,含水物料中的小冰晶会逐渐聚集成大冰晶,而大冰晶在一定程度上对物料组织的破坏程度也较大。温度的波动会加剧冰晶的重结晶现象,使得已经形成的冰晶在生长上重新分配,导致冰晶数量减少,颗粒增大,细胞组织的破坏加剧,导致生物体受到致病伤害。添加抗冻蛋白对冰晶的再结晶有抑制作用,使得物料中的冰晶较小且分布均匀[35]。有报道称植物源抗冻蛋白具有较强抑制冰晶重结晶能力[4]。
1.2.4 原生质体的过冷状态
添加抗冻蛋白可通过调节原生质体过冷状态、降低物料过冷点及增加冰晶成核率,来形成大量的小冰晶[36]。
2 植物源抗冻蛋白对面筋蛋白性质的影响
为了方便面团的运输和储藏,常将其预制成半成品并进行冷冻储藏,对冷冻面团进行解冻后,即可进行后续的加工熟制环节[37]。冷冻面团很大程度上解决了传统面团加工储藏中货架期短和易老化的难题,
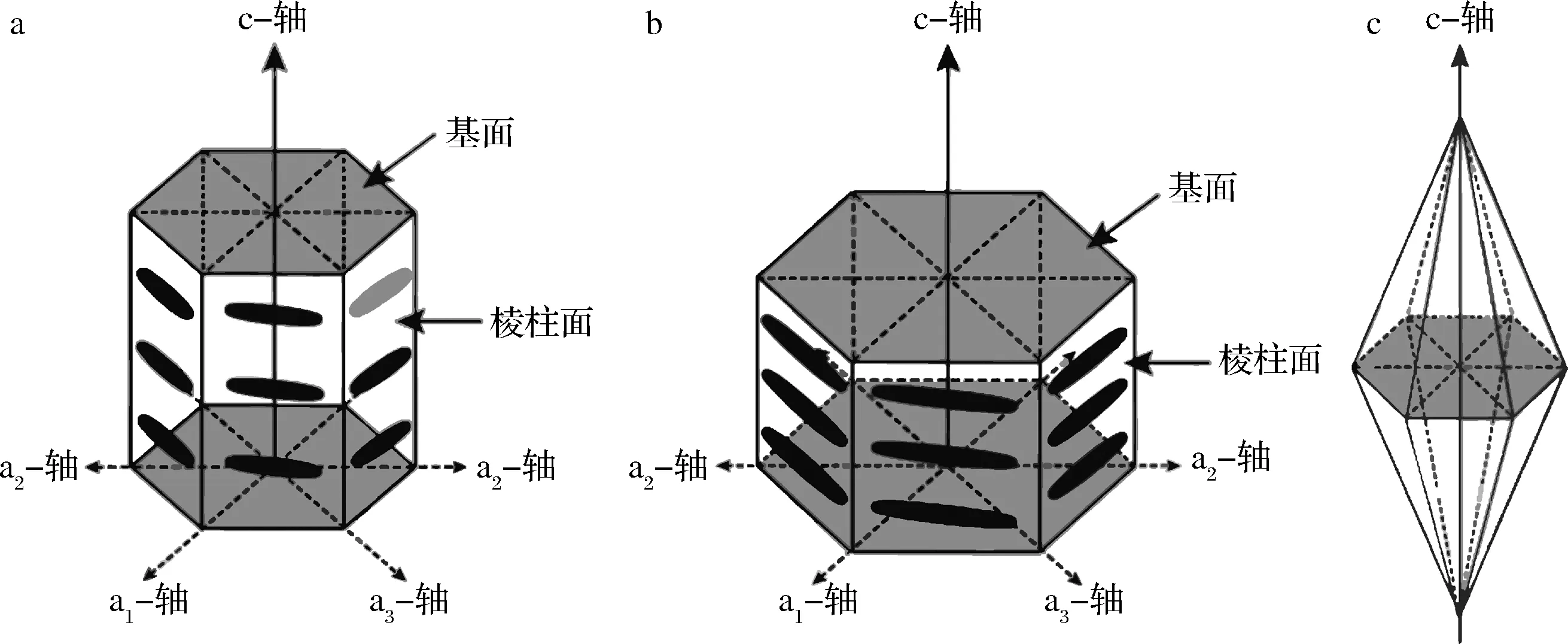
a-未添加抗冻蛋白;b-添加高热滞活性抗冻蛋白;c-添加中热滞活性抗冻蛋白[31-34]图2 冰晶形态示意图Fig.2 Diagram of ice crystal morphology
市场对冷冻面团的需求不断增加。面团经过冷冻后抗冻性差、酵母的持气能力降低[38],面团容易出现萎缩、硬化、变色以及开裂等现象。面筋蛋白是冷冻面团的重要组分之一,影响着冷冻面团的品质发展。植物源抗冻蛋白作为一种冷冻保护剂,可添加到面筋蛋白中,用以改善面团在冷冻储藏中品质的劣变。
2.1 植物源抗冻蛋白对面筋蛋白结构性质影响
2.1.1 植物源抗冻蛋白对面筋蛋白二硫键含量的影响
二硫键是由2个巯基氧化反应生成的—S—S—键,对形成和维持蛋白质分子结构起到重要的作用,二硫键的存在加速了氨基酸残基之间的结合,肽键之间相互靠拢,疏水性氨基酸残基会围绕着二硫键形成疏水中心,使得蛋白质的高级结构更加稳定[39]。
石媛媛[40]研究发现随着冻藏时间延长,面筋蛋白中二硫键含量呈下降趋势,可能是面筋蛋白在冻藏过程中二硫键被破坏,但是添加抗冻蛋白组和对照组相比,下降趋势降低,这和抗冻蛋白保护二硫键,维持面筋蛋白特性有关。同样,冻融处理过程中,二硫键含量变化与冻藏处理趋势一致,但变化幅度远高于冻藏,这与冻融处理对面筋蛋白破坏更加严重有关。杨震[41]研究发现与新鲜的面团相比,冻融循环后自由巯基含量显著性增加,这可能是因为冻融过程中温度的波动引起冰晶重结晶和水分迁移,加速了分子间相互作用,引起二硫键弱化和断裂,自由巯基含量上升。而添加黑麦菜抗冻蛋白面团的自由巯基含量比对照组显著降低,说明黑麦菜抗冻蛋白抑制重结晶的特性减缓了蛋白分子的物理破坏,延缓了自由巯基含量增加的趋势。
2.1.2 植物源抗冻蛋白对面筋蛋白微观结构的影响
新鲜面筋蛋白有三维网络结构,孔洞致密均匀,随着冻藏时间延长和冻融次数增加,面筋蛋白致密的空间网络结构会受到破坏,出现不连续、开裂及孔洞的增加,主要原因是在冻藏和冻融过程中面筋蛋白脱水,使得冰晶数量增加和重结晶[42]。冷冻干燥过程是冰晶在原位上直接升华,孔洞的大小在一定程度上可用来表征冻藏和冻融过程中冰晶聚集和大小情况。
张艳杰[18]研究冻结处理的面筋蛋白微观结构时,发现对照组的面筋蛋白网络疏松,孔洞大、不均匀,添加燕麦抗冻蛋白的面筋蛋白网络结构较紧密,孔洞相对小且均匀。在冻藏中水分发生结晶及重结晶形成大冰晶对面筋蛋白造成不可逆转的破坏,冰晶融化或是升华后面筋蛋白网络结构中会出现大孔洞。说明燕麦抗冻蛋白可修饰冰晶形态,抑制冰晶重结晶,预防出现大冰晶。为期一个月的冻藏过程中,添加燕麦抗冻蛋白会使孔洞变少变小,降低面筋蛋白被破坏的程度,说明燕麦抗冻蛋白在一定程度上可以保护面筋蛋白在冻融及冻藏过程中免受机械损伤。
2.1.3 植物源抗冻蛋白对面筋蛋白相对分子质量的影响
小麦淀粉中蛋白质含量在12%左右,但其对面筋蛋白性质及面制品加工和食用意义非凡。在凝胶电泳中,蛋白质亚基的迁移速度和蛋白质亚基的相对分子质量呈负相关,即相对分子质量越大,迁移速度越慢[43]。其中面筋蛋白中的高分子亚基对面制品的加工品质具有一定的影响。
石媛媛[40]研究发现在冻藏和冻融中,面筋蛋白在100 kDa上下出现3条比较清晰的条带,这部分属于高分子亚基,30~70kDa之间图谱颜色较深,含量高,分子质量小,属于低分子亚基和醇溶蛋白,且电容条带数目和迁移率之间不存在明显变化,说明面筋蛋白冻藏和冻融中对面筋蛋白的蛋白质亚基之间没有显著影响,且添加抗冻蛋白后也不会对面筋蛋白亚基产生影响。杨震[41]研究发现,无论是空白还是添加黑麦菜抗冻蛋白组冻融前后亚基和迁移率均没有明显变化,这说明冻藏环境对面筋蛋白的蛋白质亚基没有显著影响。
2.2 植物源抗冻蛋白对面筋蛋白功能性质的影响
2.2.1 植物源抗冻蛋白对面筋蛋白持水率的影响
面筋蛋白的持水率是面筋蛋白重要功能性质之一,是指其吸收水并保留在组织中的能力,这部分水包括物理截留水、自由水和结合水,其中对食品体系贡献最大的是物理截留水,影响着蛋白质和食品体系中水分的相互作用。两者之间的相互结合,决定与维持着蛋白质结构,甚至是物理化学性质[44]。
曲敏等[45]研究发现在-18和-40 ℃低温条件下,添加不同浓度苜蓿冰结构蛋白的冷冻面筋蛋白和空白组相比,持水率均是上升,但是在-18 ℃的条件下面筋蛋白的持水率上升幅度较小,在-40 ℃超低温环境下苜蓿冰结构蛋白对面筋蛋白持水率的影响效果显著。在-40 ℃超低温下,随着冷冻时间延长,冻藏和冻融后湿面筋蛋白持水率均下降且冻融比冻藏下降幅度大,说明冻藏及冻融后,对面筋蛋白的破坏作用显著。添加不同浓度苜蓿冰结构蛋白,面筋蛋白持水率出现不同程度的下降趋势,总体以1%苜蓿冰结构蛋白添加量最佳。所以,添加苜蓿冰结构蛋白对冷冻湿面筋蛋白持水性有一定的保护作用,且不同浓度苜蓿冰结构蛋白的添加量及冷冻温度对面筋蛋白的持水率均有显著影响。
2.2.2 植物源抗冻蛋白对面筋蛋白乳化性和乳化稳定性的影响
面筋蛋白的乳化性和乳化稳定性是面筋蛋白重要的功能性质之一。面筋蛋白乳化性质和体系中的溶解度相关性很强,其次是蛋白质表面分布的亲水基团和疏水基团等,这主要是因为在油水界面上蛋白膜的稳定性取决于蛋白质同水油之间的相互作用。
张艳杰等[46]研究发现,小麦面筋蛋白冻融后乳化性变差,主要是小麦面筋蛋白在冻融处理后变性,溶解度降低,导致乳化性降低;变性后的小麦面筋蛋白亲水-亲油平衡性增强,导致乳化稳定性增强。和对照组相比,添加燕麦抗冻蛋白的面筋蛋白乳化性显著提高,主要是燕麦抗冻蛋白可以抑制冰晶再结晶,使体系溶解度提高,乳化性得到改善,而添加燕麦抗冻蛋白会抑制面筋蛋白的变性,导致乳化稳定性下降。
2.2.3 植物源抗冻蛋白对面筋蛋白二级结构的影响
面筋蛋白二级结构可以分为α-螺旋、β-折叠、β-转角和无规则卷曲。α-螺旋和β-折叠通过氢键形成稳定的二级结构,增加了蛋白质的刚性和弹性,和面团的硬度和弹性有密切的关系;同时α-螺旋还可以参与形成疏水相互作用;无规则卷曲和β-转角构型会使肽链发生转变时阻力比较小,其中β-转角大多分布在蛋白质分子表面,赋予蛋白质较高的柔性和自由度,这和面团的黏性和延伸性有关[47-48]。
石媛媛[40]研究发现冻藏和冻融后,面筋蛋白二级结构中的β-转角减少、β-折叠增多,冻融循环后,α-螺旋构型有所下降。添加抗冻蛋白后,二级结构的变化幅度减小,说明添加抗冻蛋白对面团中的氢键破裂有减缓作用,可保护蛋白质的二级结构。杨震[41]研究发现,面筋蛋白二级结构以β-折叠为主,占比50%左右,其次是α-螺旋、β-转角。在冻藏过程中,面筋蛋白二级结构发生了显著变化,α-螺旋显著下降,β-折叠显著增加,β-转角无显著变化。添加黑麦菜抗冻蛋白冻藏后α-螺旋构型减少幅度变小,β-折叠增加幅度同样变小,主要是黑麦菜抗冻蛋白抑制了冰晶的形成和重结晶,从而减缓在冻藏中蛋白质分子二级结构变化。
2.2.4 植物源抗冻蛋白对面筋蛋白水分分布的影响
面筋蛋白中的水分可分为结合水、不易流动水和自由水,在核磁共振分析仪上通过弛豫时间T2来表示,如图3所示。弛豫时间T2和水的流动性有很大关联,T21在面团中的占比为20%左右,与蛋白质结合最为紧密;T22是和面团中的淀粉和其他可溶性的物质相结合的那部分水,为不易流动水或者弱结合水,占比在70%以上;T23是自由流动的水,称为自由水,占比在6%左右[49-50]。

图3 弛豫时间T2分布示意图[51]Fig.3 Schematic diagram of relaxation time T2 distribution[51]
贾春利[52]研究发现在冻藏条件下,空白组湿面筋蛋白体系中的T21和T22会显著增大,添加热稳定抗冻蛋白后,T21和T22仍随着冻藏时间的延长而不断增加,但是增加的幅度有所降低,说明在冻藏过程中和蛋白质分子结合紧密的那部分水分会逐渐减少,转变为弱结合水或者是游离水,面筋蛋白分子发生脱水。
2.2.5 植物源抗冻蛋白对面筋蛋白旋转流变的影响
面筋蛋白旋转流变是由弹性模量、黏性模量、黏性模量与弹性模量的比值这3部分组成。弹性模量是发生形变恢复原始形状的能力,表征物料的弹性;黏性模量是损耗变形的能力,表征物料黏性;正切值反映物料的黏弹性,并且正切值还可表征物料的状态,正切值>1时,物料具有类似于流体的状态,正切值<1时,物料具有类似于固态的状态。
杨震[41]研究发现在频率0.1~40 Hz添加黑麦菜抗冻蛋白组和空白组弹性模量和黏性模量均和频率成正相关且弹性模量始终大于黏性模量。新鲜面团冻融后弹性模量和黏性模量均下降,添加黑麦菜抗冻蛋白后,两者均高于空白组,说明黑麦菜抗冻蛋白能有效保护面团,减缓冰晶生长对面团的机械破坏和面团弱化。
2.3 植物源抗冻蛋白对面筋蛋白热力学性质的影响
2.3.1 植物源抗冻蛋白对面筋蛋白冻融特性的影响
纯水在冰点温度时仍可以保持液态而不结冰,在低于冰点温度后,样品还没有出现冻结的现象称之为过冷现象,这是冻融特性的表征之一。
张艳杰[18]研究发现不同冻藏周期下对照组面筋蛋白熔融曲线的温度波动较添加燕麦抗冻蛋白组明显。对各个曲线进行积分得面筋蛋白相关熔融参数,表明随着冻藏时间的延长,对照组熔融过程中起始温度Tm,δ均会显著性的提高,而添加燕麦抗冻蛋白组整体会比对照组向高温迁移的幅度小。冻融曲线向高温区移动这一现象代表着水分会从不易冻结的水向可冻结水的方向转变[53],所以对照组的面筋蛋白熔融特性的起始温度向高温区发生位移的现象,说明水分流动性发生了较大的变化,容易发生冰晶的重结晶,形成大冰晶。随冻藏期延长,对照组和添加燕麦抗冻蛋白组的Tm,δ会逐渐减小,且经过4周冻藏后,2组Tm,δ没有显著性差异。但经过冻藏后,2个组的熔融焓和Fw均升高,因为冻藏过程中形成冰晶及重结晶破坏面筋蛋白网络结构,引起疏水性基团的暴露,使一部分结合水分离开,增加水分流动性。即使添加燕麦抗冻蛋白并不能完全遏制住熔融焓和Fw升高,但在一定程度上起到了延缓作用。
2.3.2 植物源抗冻蛋白对面筋蛋白可冻结水的影响
冷冻面筋蛋白的品质与体系中可冻结水含量相关。在冻结过程中,可冻结水形成冰晶,冰晶在融化过程会产生熔融焓,可间接反应面团中可冻结水的含量。
曲敏等[45]研究发现随着冷冻时间延长,在冻藏和冻融过程中,面筋蛋白的可冻结水含量均逐渐增加。添加不同浓度的苜蓿冰结构蛋白后,可冻结水含量上升趋势得到不同程度减缓,以添加0.5%的苜蓿冰结构蛋白对缓解面筋蛋白在冻藏及冻融中可冻结水的效果最好。说明在冻藏和冻融过程中,湿面筋蛋白中的水分会发生结晶,部分的弱结合水会因为和高分子物质之间结合不紧密而发生迁移,导致小冰晶聚集形成大冰晶,破坏网络结构,引起水分流失,增加可冻结水的含量。添加苜蓿冰结构蛋白使得面筋蛋白中的可冻结水含量上升,这主要是因为苜蓿冰结构蛋白可以降低溶液的凝固点,抑制在冻结过程中冰晶的生长及再结晶,从而减少冰晶对网络结构的破坏,阻止面筋蛋白中水分的解离。
3 结论与展望
将植物源抗冻蛋白运用到面筋蛋白中,可有效地抑制面筋蛋白结构、功能和热力学性质的劣变。植物源抗冻蛋白不同于其他蛋白的特征是抑制冰晶重结晶的能力强。添加植物源抗冻蛋白后,其和体系中的冰晶直接结合,抑制重结晶,降低冰晶对面筋蛋白网络结构的破坏程度。
目前大多数报道都是将面筋蛋白作为一个整体来研究。面筋蛋白中含有一些其他的关键成分,比如麦谷蛋白,其作为面筋蛋白的重要组成成分,可以赋予面团持水性、黏弹性等,对面筋蛋白加工及后期的焙烤起着决定性作用。可以尝试将植物源抗冻蛋白添加到面筋蛋白中,再提取其关键成分并进一步研究,来深入探究植物源抗冻蛋白对面筋蛋白品质的影响机理,为植物源抗冻蛋白改良冷冻食品品质提供理论参考。

