桑叶黄酮的双水相萃取及其抗氧化活性研究
于建丽,王汝华,孟琬星,梁增澜,3,宋璇,孔宇,陆旸,尹吉泰,李超,
(1.天津科技大学食品科学与工程学院,天津 300457;2.天津市食品研究所有限公司,天津 301609;3.北京国贸东孚工程科技有限公司,北京 100032;4.天津食品集团有限公司,天津 300074)
桑科植物桑(Morus alba L.)在中国各地被广泛种植,且产量较高。2002年桑叶被中国卫生部批准为药食同源食品[1]。桑叶中含有丰富的营养物质,如多糖、蛋白质、黄酮类,生物碱类等[2]。其中黄酮类化合物是桑叶的重要活性成分,并在其食疗功效中起着关键作用[3]。桑叶黄酮(mulberry leaves flavone,MLF)具有抗氧化[4]、降糖降脂[1]、抑菌[5]等功效,是极具潜力的功能性食品产品添加剂。
目前,桑叶乙醇-水提取物中黄酮类化合物的提取率较高,但成分复杂,分离难度较大,多采用有机溶剂萃取法配合大孔吸附树脂柱层析法进行分离纯化。有机溶剂萃取法虽然对于不同极性的物质分离效果明显,但有机溶剂残留会阻碍活性物质的应用[6]。而双水相(aqueous two-phase system,ATPS)萃取技术则是利用亲水有机溶剂与离子液体在水溶液中分相,根据被分离物在两相中溶解度的差异进行分离,并能够保持良好的生物活性[7]。因其具有分相清晰、绿色环保、操作简便、萃取率高等优点[8],近年来双水相萃取在天然产物分离方面被广泛研究应用[9]。
因此,本研究探究乙醇-无机盐双水相体系对桑叶黄酮的分离纯化效果及其对体外抗氧化活性的影响,以期为桑叶黄酮作为抗氧化剂添加剂应用于食品领域提供参考。
1 材料与方法
1.1 材料与试剂
桑叶:采摘自天津蓟州山区。
九水合硝酸铝、硫酸钾、硫酸铵、氢氧化钠、无水乙醇(均为分析纯):天津市江天化工技术股份有限公司;磷酸氢二钾、无水碳酸钠、硫酸亚铁、铁氰化钾(均为分析纯):天津市化学试剂一厂;亚硝酸钠、氯化钠、三氯乙酸、氯化铁(均为分析纯):天津市光复科技发展有限公司;AB-8大孔吸附树脂、还原型辅酶Ⅰ二钠(NADH-Na2)、氯化硝基四氮唑蓝(nitroblue-tetrazolium,NBT)、吩嗪硫酸甲酯(phenazine methyl sulfate,PMS)、芦丁标准品(≥98%):北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhydrazine,DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid,ABTS):上海阿拉丁生化科技股份有限公司;其他试剂均为分析纯。
1.2 仪器与设备
KQ2200v超声波处理器:江苏昆山超声仪器有限公司;IKA RV 8旋转蒸发仪:瓦恩默电器股份有限公司;UV-5100B紫外可见分光光度计:上海元析仪器有限公司;TGL-21高速冷冻离心机:四川蜀科仪器有限公司;Multiskan FC酶标仪:赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 桑叶黄酮粗提物的制备
新鲜桑叶50℃温度烘干4 h,干燥粉碎,过60目筛。根据前期提取工艺优化试验结果,选择84%乙醇溶液、料液比1∶8(g/mL)、提取温度50℃、提取时间30 min/次,超声辅助提取3次,离心合并上清液,得到桑叶黄酮粗提物(mulberry flavone extract,MFE)。
1.3.2 总黄酮的测定
参照孙雪皎等[10]的黄酮检测方法,以芦丁为标准品,制作标准曲线,方程为 y=1.1288x-0.0042(R2=0.9995)。
1.3.3 双水相成相研究
选择无水乙醇为有机相,氯化钠、碳酸钠、磷酸氢二钾、硫酸钾和硫酸铵作为试验无机盐,采用浊点滴定法[11]绘制双水相系图。
1.3.4 双水相萃取单因素试验
根据双水相系图,乙醇质量分数分别选择25%、30%、35%、40%、45%,硫酸铵质量分数分别选择5%、10%、15%、20%、25%,MFE 添加量分别选择 2、4、6、8、10 mg/mL进行单因素试验。室温25℃下,溶解混匀,3 000 r/min离心10 min,分液,计算相比R、分配系数K、萃取率Y,计算公式如下。
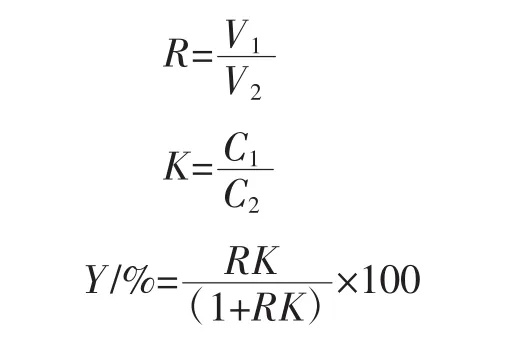
式中:V1、V2分别为上、下相的体积,mL;C1、C2分别为上下相的总黄酮浓度,mg/mL。
1.3.5 双水相萃取响应面试验
根据单因素试验结果,采用Box-Behnken响应面试验对萃取工艺条件进一步优化。分别选定乙醇质量分数、硫酸铵质量分数、MFE添加量作为响应面的3个因素,以桑叶黄酮萃取率Y为响应值,设计响应面试验,并对结果进行回归分析和优化,各因素与水平见表1。

表1 Box-Behnken响应面设计Table 1 Box-Behnken response surface design
1.3.6 大孔吸附树脂纯化
使用AB-8大孔吸附树脂分别对未经过萃取的MFE和经过双水相萃取后的萃取物进行分离纯化。将样品配制成一定浓度的溶液,按5 mg总黄酮/g树脂的上样量上样,保持3 mL/min的流速,用3倍柱体积(column volume,CV)的超纯水冲洗,随后用2 CV的10%乙醇水溶液除去杂质,最后用3 CV的80%乙醇水溶液进行洗脱。收集洗脱液,减压浓缩,冻干得到固体MLF1和MLF2。
1.3.7 桑叶黄酮的抗氧化活性测定
参考石玉平等[12]、陈青青等[13]、ALARA O R 等[14]、万聆[15]的方法,检测 MLF1 和 MLF2 对于·OH、ABTS+·、DPPH·、O2-·的清除能力,以芦丁做阳性对照,并计算其半数抑制浓度(IC50)。
1.3.8 数据处理
所有试验进行3次平行测定,试验结果以平均值±标准差表示。图表绘制使用Origin 2019b,采用IBM SPSS 26.0对数据进行统计分析,采用单因素方差分析,P<0.05表示差异性显著。
2 结果与分析
2.1 桑叶黄酮分离萃取双水相体系的确定
分相试验表明,氯化钠无法与乙醇形成双水相体系,其余无机盐均可与乙醇形成双水相溶液,结果如图1所示。
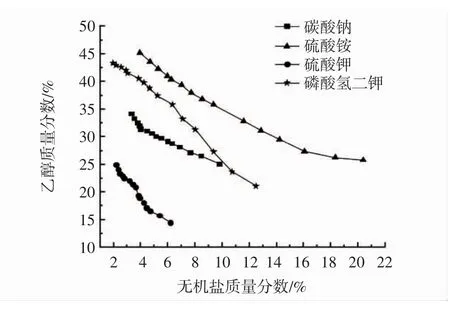
图1 4种不同无机盐的双水相系图Fig.1 Aqueous two-phase systems with four different inorganic salt
由图1可知,4种无机盐分相范围大小排序为硫酸铵>磷酸氢二钾>碳酸钠>硫酸钾。乙醇-硫酸钾体系中,硫酸钾容易析出,分相时乙醇、无机盐质量分数均较小,不利于黄酮类物质的萃取。硫酸铵在乙醇中溶解度较低,与乙醇争夺水分子能力较强,可达到很好的分离效果[16]。
此外,由于部分黄酮类化合物难溶于水,易溶于弱碱性溶液和乙醇、乙酸乙酯、乙醚等有机溶剂,而磷酸氢二钾与碳酸钠均为强碱弱酸盐,溶液呈弱碱性,使得上下相黄酮几乎平均分布,不利于黄酮类化合物在上相中富集[17-18]。因此,本研究选择乙醇-硫酸铵双水相体系进行萃取分离,根据在双水相系图中乙醇质量分数范围25.80%~45.15%,硫酸铵质量分数范围3.96%~20.38%,进行单因素试验。
2.2 双水相体系单因素试验
乙醇质量分数、硫酸铵质量分数、MFE添加量对桑叶黄酮萃取率Y的影响,结果如图2~图4所示。
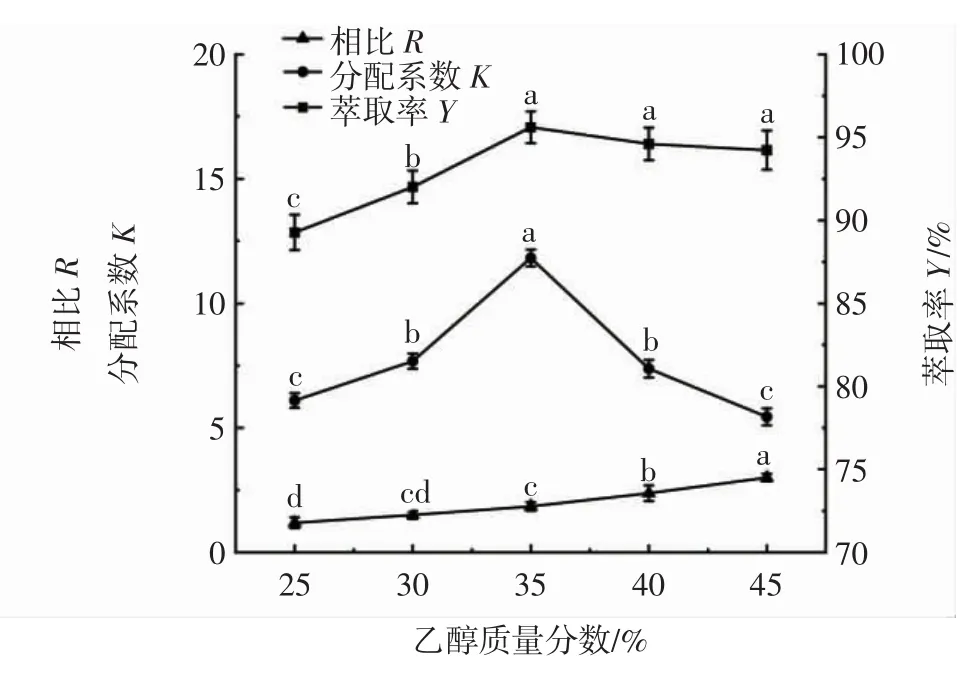
图2 乙醇质量分数对萃取率的影响Fig.2 Effect of ethanol mass fraction on extraction rate
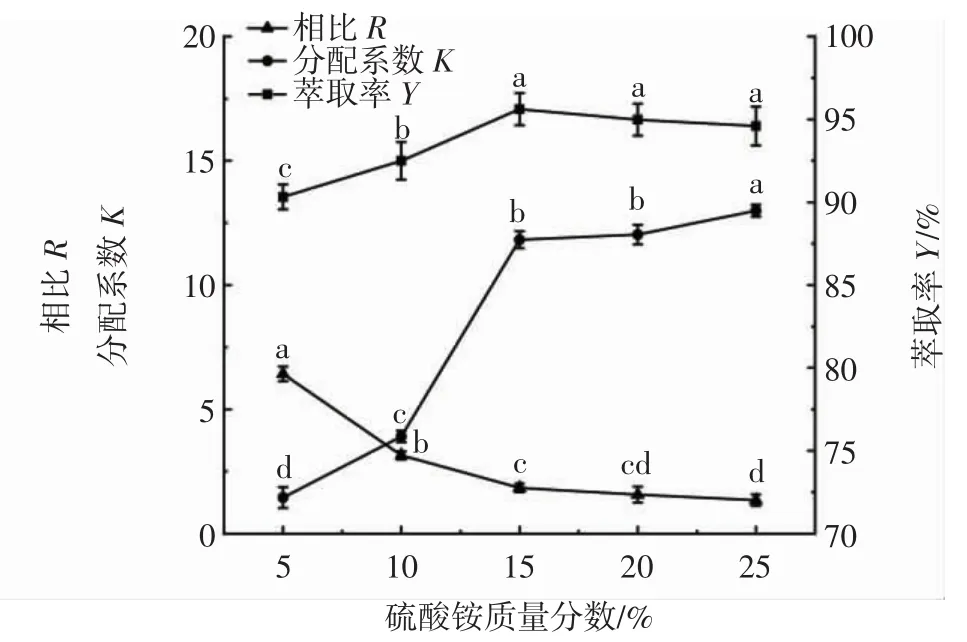
图3 硫酸铵质量分数对萃取率的影响Fig.3 Effect of ammonium sulfate mass fraction on the extraction rate
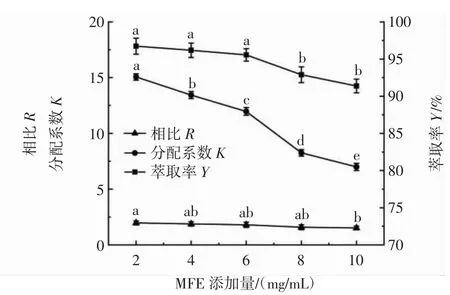
图4 MFE添加量对萃取率的影响Fig.4 Effect of the amount of MFE added on the extraction rate
由图2可知,随着乙醇质量分数的增大,相比R逐渐增大,分配系数K先增大后减小。乙醇质量分数25%~35%时,萃取率Y差异显著(P<0.05),在乙醇质量分数为35%时达到最大值,随后略有减小,无显著性差异。可能是由于乙醇对水分子的竞争能力增强,使两相更容易分开[19],上相体积随乙醇质量分数的增加而增加,而且黄酮具有醇溶性,这有助于黄酮类物质在上相富集。然而,过高的乙醇浓度会导致盐析出,还会引起小分子杂质溶出,降低桑叶黄酮的溶解量[20]。因此,选择乙醇质量分数35%进行后续试验。
由图3可知,相比R随硫酸铵质量分数的增大而减小,这是因为下相中硫酸铵结合水的能力增强,下相体积增加。分配系数K随硫酸铵质量分数的增大先上升后趋于平缓,萃取率Y随硫酸铵质量分数的增大先增大后略有减小。硫酸铵质量分数为5%~15%时,相比R、分配系数K和萃取率Y差异显著(P<0.05)。硫酸铵质量分数为15%时,萃取率Y达到最大(95.61±0.97)%,此时下相溶液基本饱和,黄酮在上相中溶解较多,达到良好的分配效果。过饱和后会有硫酸铵析出,目标物略有减少。因此,选择硫酸铵质量分数15%进行后续试验。
由图4可知,随着MFE添加量的增大,萃取率Y和分配系数K逐渐减小。相比R基本不变且无明显差异。MFE添加量为2 mg/mL~6 mg/mL时,萃取率Y无显著性差异。但当MFE添加量≥8 mg/mL时,萃取率Y明显下降,这是由于添加量过大,黄酮溶解度达到饱和。因此,为达到较高的萃取率并节约成本,选择MFE添加量6 mg/mL进行后续试验。
2.3 双水相体系响应面试验
2.3.1 响应面试验结果及方差分析
本试验采用拟合二次多项式回归模型的Box-Behnken响应面法设计试验,以桑叶黄酮萃取率Y为响应值,对乙醇-硫酸铵双水相萃取工艺进行优化,响应面试验结果和模型方差分析结果如表2和表3所示。
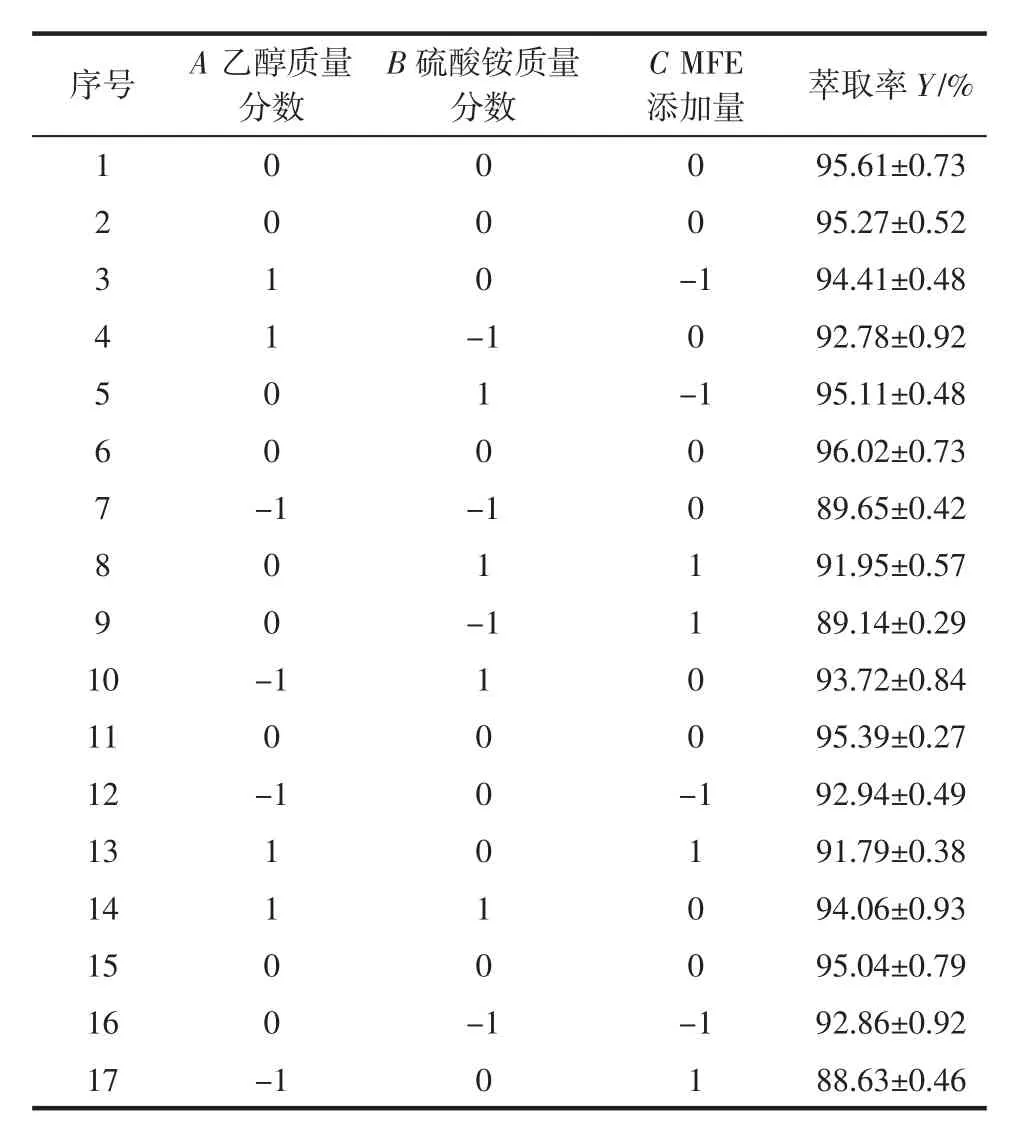
表2 响应面试验结果Table 2 Response surface experimental results
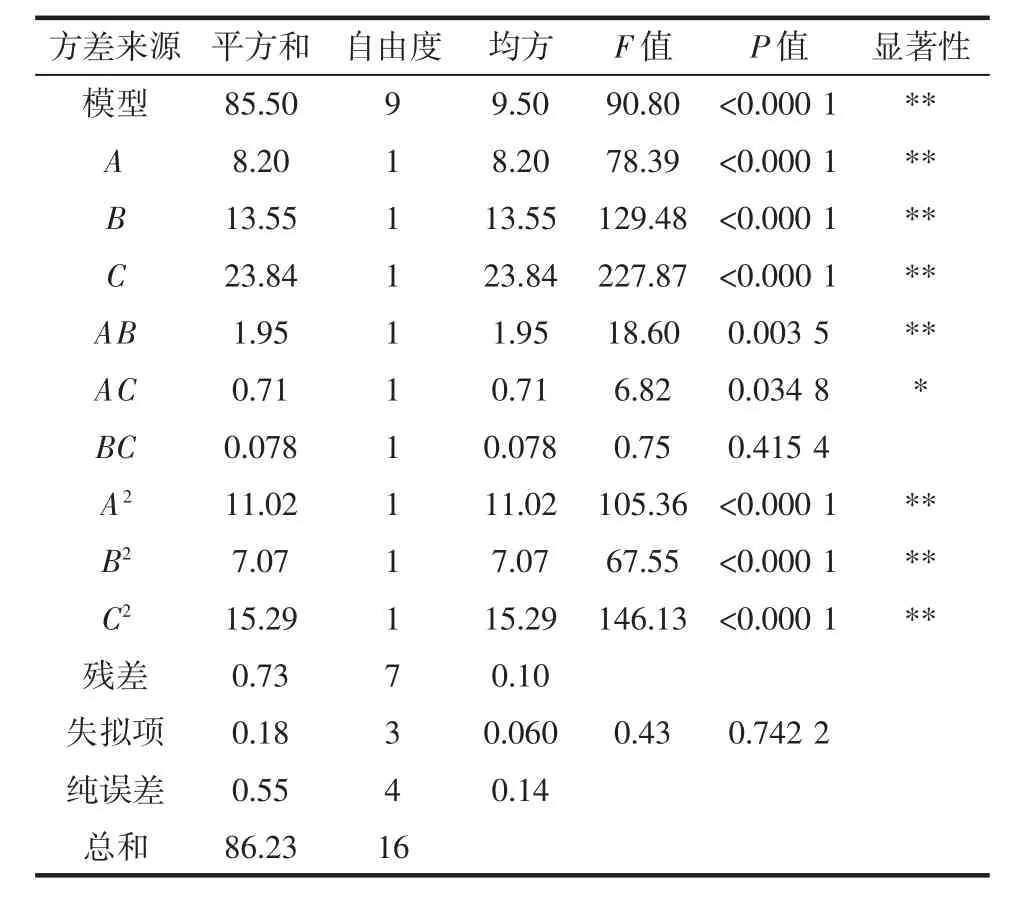
表3 响应面二次回归模型方差分析Table 3 Analysis of variance of response surface quadratic regression model
由表3可知,模型的拟合度达到极显著水平,失拟项不显著,所选的二次回归模型合理,能够预测桑叶黄酮萃取率Y。回归模型R2=0.991 5,说明模型与实际试验拟合情况良好。试验中3个因素对桑叶黄酮萃取率Y影响均为极显著,影响大小依次为C>B>A,即MFE添加量>硫酸铵质量分数>乙醇质量分数。响应值与各因素间多元回归拟合方程为Y=95.47+1.01A+1.30B-1.73C-0.70AB+0.42AC+0.14BC-1.62A2-1.30B2-1.91C2。
2.3.2 响应面分析及验证试验
响应面分析及验证试验结果如图5所示。
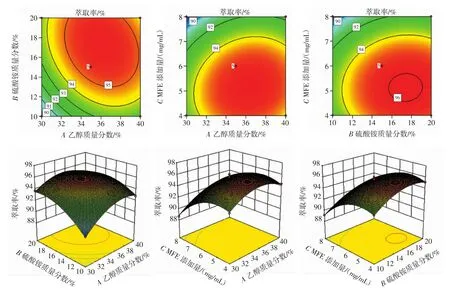
图5 各因素交互作用响应面和等高线图Fig.5 Surface plots and contour plots for the interactions of various factors
由图5可知,交互项AB的等高线变化密集,变化范围大,3D图对角走势陡峭,交互作用极显著;交互项AC的等高线变化较密,变化范围较大,3D图对角走势较陡,交互作用显著;但交互项BC交互作用不显著,与方差分析结果一致。研究表明,萃取率Y受3种因素综合影响,不是简单的线性关系。
根据试验结果得出推荐工艺参数为乙醇质量分数35.82%,硫酸铵质量分数17.18%,MFE添加量5.16 mg/mL,预测萃取率Y为96.19%。为便于操作,选择在乙醇质量分数36%、硫酸铵质量分数17%、MFE添加量5 mg/mL的条件下进行3次验证试验,桑叶黄酮萃取率Y 可达(95.74±0.58)%,此时相比 R=1.84±0.17,分配系数K=11.82±0.34,达到预测值的99.53%,说明该试验选用的模型与实际拟合良好。
2.4 纯化结果
经过纯化后,MLF1的纯度达到(61.48±0.54)%,MLF2 纯度达到(80.32±0.18)%,相较于苏伟等[21]、王珂[22]单一大孔吸附法纯化桑叶黄酮,纯度提高了接近一倍。
2.5 桑叶黄酮抗氧化活性结果
2.5.1 ·OH清除率的测定
MLF1、MLF2和芦丁对·OH清除率的影响如图6所示。
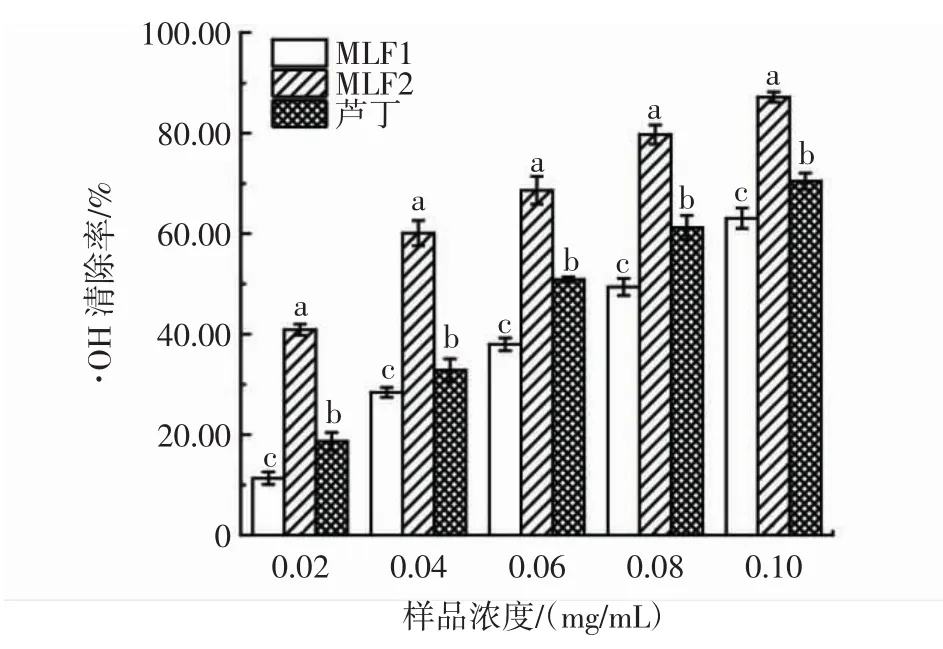
图6 MLF1、MLF2、芦丁对·OH清除率的影响Fig.6 Effects of MLF1,MLF2 and rutin on·OH scavenging rate
由图6可知,浓度为0.02 mg/mL~0.10 mg/mL时,MLF1、MLF2和芦丁对·OH清除率的影响随样品浓度增大而增大,存在剂量依赖效应。根据半数抑制浓度比较,·OH清除能力从大到小依次为MLF2(IC50=0.028 mg/mL)>芦丁(IC50=0.059 mg/mL)>MLF1(IC50=0.077 mg/mL),各组内均存在显著性差异。这是由于MLF2中存在多种黄酮类物质,如芦丁、槲皮素、桑色素、异槲皮苷、金丝桃苷等[23-25],共同作用下对·OH清除能力优于芦丁单体。抗氧化活性与总黄酮纯度存在正相关性[26],而MLF1纯度较低,清除能力较差。在0.10 mg/mL浓度下,MLF2对·OH清除率可达(87.18±1.00)%。
2.5.2 ABTS+·清除率的测定
MLF1、MLF2和芦丁对ABTS+·清除率的影响如图7所示。
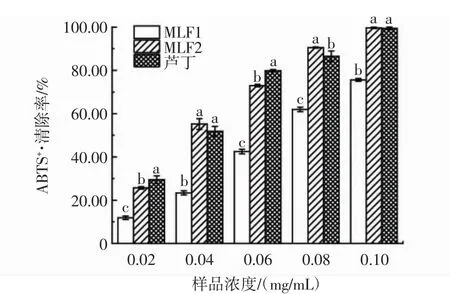
图7 MLF1、MLF2和芦丁对ABTS+·清除率的影响Fig.7 Effects of MLF1,MLF2 and rutin on ABTS+·scavenging rate
由图7可知,在0.02 mg/mL~0.10 mg/mL的浓度范围内,MLF1、MLF2和芦丁对ABTS+·清除率的影响随样品浓度增加而增大,存在剂量依赖效应。根据半数抑制浓度比较,ABTS+·的清除能力从大到小依次为芦丁(IC50=0.033 mg/mL)>MLF2(IC50=0.034 mg/mL)>MLF1(IC50=0.064 mg/mL),MLF1清除率与其余两组差异显著。MLF2对于ABTS+·的清除能力相对较好。在0.10mg/mL浓度下,MLF2的ABTS+·清除率可达(99.70±0.31)%,与桑叶乙酸乙酯萃取物的结果基本一致[27]。这是因为MLF2总黄酮纯度较高,黄酮类化合物的B环3位酚羟基结构可以有效增强抗氧化活性[28]。
2.5.3 DPPH·清除率的测定
MLF1、MLF2和芦丁对DPPH·清除率的影响如图8所示。
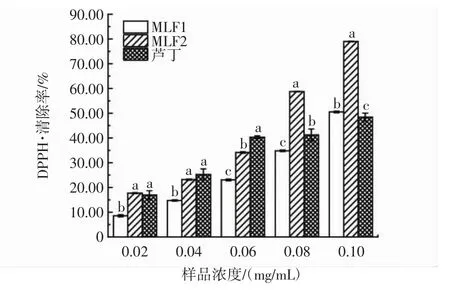
图8 MLF1、MLF2、芦丁对DPPH·清除率的影响Fig.8 Effects of MLF1,MLF2 and rutin on DPPH·scavenging rate
由图8可知,在0.02 mg/mL~0.10 mg/mL的浓度范围内,MLF1、MLF2和芦丁对DPPH·清除率的影响随样品浓度增加而增加,存在剂量依赖效应。随着浓度的增加,MLF2的清除率逐渐高于MLF1和芦丁。样品浓度≥0.80 mg/mL时,MLF2清除率与其余两组差异显著,这是由于MLF2中多种黄酮的协同作用逐渐显著[29]。根据半数抑制浓度比较,DPPH·的清除能力从大到小依次为 MLF2(IC50=0.066 mg/mL)>芦丁(IC50=0.107mg/mL)>MLF1(IC50=0.112 mg/mL)。在 0.10mg/mL浓度下,MLF2的清除率可达(78.99±0.14)%,说明双水相萃取可显著提升DPPH·清除能力。
2.5.4 O2-·清除率的测定
MLF1、MLF2和芦丁对于O2-·清除率的影响如图9所示。
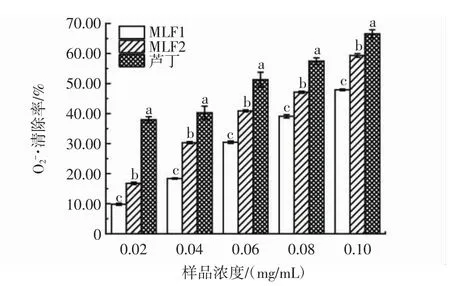
图9 MLF1、MLF2、芦丁对O2-·的清除率的影响Fig.9 Effects of MLF1,MLF2 and rutin on O2-·scavenging rate
由图9可知,在0.02 mg/mL~0.10 mg/mL的浓度范围内,MLF1、MLF2和芦丁对O2-·清除率的影响随样品浓度增加而增加,存在剂量依赖效应。根据半数抑制浓度比较,清除O2-·的能力从大到小依次为芦丁(IC50=0.050 mg/mL)>MLF2(IC50=0.080 mg/mL)>MLF1(IC50=0.109mg/mL),各组内均存在显著性差异。MLF2对O2-·有一定的清除能力,相较于芦丁略差,各浓度下均显著低于芦丁。0.10 mg/mL浓度下,MLF2的O2-·清除率可达(59.39±0.60)%。这可能是因为除多种黄酮的协同作用外,还可能因为羟基数量较多,在特定反应体系中分子间形成氢键,出现复杂的拮抗作用[29],减弱了MLF2对于O2-·的清除能力。
3 讨论与结论
本研究旨在选择绿色安全、便于量产的纯化方法,得到较高纯度的桑叶黄酮,并对其体外抗氧化活性进行分析。试验结果表明,双水相萃取系统的最佳工艺参数为乙醇质量分数36%、硫酸铵质量分数17%、MFE添加量5 mg/mL,进一步纯化后得到MLF2,其纯度达到(80.32±0.18)%。此外,MLF2抗氧化能力显著高于MLF1,初步证明经双水相萃取得到的桑叶黄酮具有良好的抗氧化活性,说明在纯化过程中有效去除了很多对反应体系产生影响的杂质。上述试验结果可为桑叶黄酮的分离纯化以及活性研究提供参考,具有一定的理论研究及工业应用价值。

