不同上覆水氟浓度对湖泊沉积物氟释放与微生物群落的影响*
朱 翔,徐志鹏,2,罗一单,2,彭福全,庞晴晴,谢 磊,3,马玉珅,2,汪龙眠
(1:生态环境部南京环境科学研究所,南京 210042) (2:河海大学环境学院,南京 210098) (3:南京信息工程大学环境科学与工程学院,南京 211800)
水体中氟化物污染已经成为全球性环境问题,中国作为世界上氟化物污染较为严重的国家之一,形势不容乐观[1-2]. 刘璇等[3]研究吉林西部湖泊F-浓度结果显示:F-浓度最低为3.10 mg/L,最高达到32.56 mg/L,远超我国地表水Ⅲ类标准(1 mg/L). 宁夏地区也报道了F-浓度高的现象. 宁夏清水河上游地下水F-浓度范围为0.83~2.51 mg /L,平均值为1.47 mg /L[4]. Tian等[5]在研究宁夏沙湖时发现,2019年沙湖地表水F-浓度为0.95~1.40 mg/L,周边35%的采样点中地下水F-浓度超过1 mg/L.
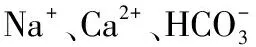
针对现有研究的不足,为明确湖泊上覆水F-浓度变化对沉积物F-释放的地球化学与微生物影响机制,本文模拟沙湖沉积物-水系统,以上覆水F-浓度为主要控制因子,分析上覆水与孔隙水中F-浓度、pH和主要离子的变化规律,研究上覆水F-浓度变化条件下沉积物优势菌属相对丰度的变化,分析沉积物优势菌属与F-及其他主要离子浓度的相互作用,从地球化学与微生物两个方面探究不同上覆水F-浓度背景下沙湖沉积物-水系统内F-释放和迁移的机理,为沙湖及其他高氟湖泊防治提供理论支持.
1 材料与方法
1.1 研究区域概况
沙湖(38°45′N,106°18′E)位于宁夏回族自治区石嘴山市,地处贺兰山麓,沙湖的表面积为13.96 km2,平均深度为2.2 m[19]. 沙湖地区属于干旱和半干旱的大陆性气候,蒸发强烈. 降雨主要集中在夏季的7-9月,平均年降水量为172.5 mm,而年平均蒸发量却达到1755.1 mm[20],年平均温度为9.5℃,昼夜温差一般可达12~15℃. 2011-2018年沙湖氟离子浓度先增加后降低,并在2015年达到峰值1.59 mg/L[21].
沙湖的岩性主要为黏土砂、细砂和砂质黏土,由石英(40%~70%)、斜长石(15%~25%)、钠长石(5%)、伊利石(2.5%~6%)、亚氯酸盐(3%~5.5%)、方解石和白云石(2.2%~15.5%)以及少量的石膏(0.2%)和角闪石(0.3%)[22]组成.
1.2 样品采集与处理
采样时间为2020年11月,采集沙湖沉积物样品和水样. 采样点位(38°49′N,106°21′E)远离河道、闸口、旅游区以及可能的污染源头且沉积物中微生物种类丰富,共采集水样25 kg,泥样10 kg. 采样选择风小、水面稳定时进行.

1.3 实验设计
实验装置为10根形状相同的聚氯乙烯(PVC)圆柱,圆筒直径为9 cm,高度为60 cm. 实验开始前,在圆柱底部铺设20 cm高的原始湖泊沉积物. 根据监测的水质指标,在实验室配制模拟原水,以模拟上覆水(为避免原水中微生物、藻类等因素的干扰,更精确地计算沉积物中氟离子的释放量,使用配制模拟原水.),上覆水高30 cm. 配置水质指标所需试剂及剂量(括号中数值为试剂投加量,按10 L配置水量计算)为:NaOH(3.5 mg)、C6H12O6(243.7 mg)、KH2PO4(0.9 mg)、NaNO3(4.5 mg)、NH4Cl(5.1 mg)、NaF(15.3 mg)、NaCl(2991.3 mg)、KCl(153.3 mg)、CaCl2(871.4 mg)、MgSO4(3090.0 mg)、NaHCO3(1323.3 mg)、MgCl2(156.6 mg)、CaSO4(357.0 mg).
为研究不同浓度的上覆水F-对沉积物-水体系中氟化物迁移的影响,以原上覆水中F-为1倍浓度(0.69 mg/L),设计了不同浓度梯度,分别为以原水浓度为1倍浓度(0.69 mg/L),设置0.5倍组(0.35 mg/L)、1倍组(0.69 mg/L)、2倍组(1.38 mg/L)和4倍组(2.76 mg/L)4个F-浓度梯度组. 另外,为研究微生物对氟化物迁移的影响,在1倍浓度组中增设1倍灭菌组(0.69 mg/L),共设置5个实验组,上述各组均设1个平行组.
在实验室环境预培养3天后,在实验第1、2、3、5、7、10、15、20、25、30天分别收集80 mL上覆水和50 mL孔隙水,共计200个水样并测量各指标. 其中孔隙水利用Rhizosphere土壤溶液取样器[23](Rhizon SMS,荷兰)采集,每次取完水样后,将准备好的上覆水模拟水沿柱壁缓慢补充各圆筒至原来高度.
1.4 分析方法
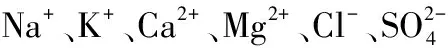
1.4.2 湖泊沉积物中微生物群落分析 1) 微生物样品收集:实验结束后采集实验组10组沉积物样品(每组包含1个平行样),10组实验组的沉积物均收集自沉积物-水界面下5~10 cm处. 实验结束后立即将10组实验组和1组初始沉积物样品(共11组)保存在-80℃环境中.
2) DNA提取与Illumina高通量测序:称取沉积物样品0.25 g,使用OMEGA Soil DNA Kit (D5625-01) (Omega Bio-Tek,美国)提取总基因组DNA样本,具体步骤按照制造商的说明. 在进一步分析之前保存在 -20℃ 环境中. 分别使用NanoDropND-1000分光光度计(ThermoFisherScientific,美国)和1.2%琼脂糖凝胶电泳检测提取DNA的数量和质量.
使用正向引物338F(5′-ACTCCTACGGGAGAGGCAGCA-3′)和反向引物806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16SrRNA基因V3-V4区进行PCR扩增. PCR扩增子用Vazyme VAHTSTM DNA Clean Beads(Vazyme,南京,中国)纯化,并使用Quant-iT PicoGreen dsDNA Assay Kit(Invitrogen,美国)进行定量. 进行单独的定量步骤后,将等量的扩增子合并,并使用上海派森诺生物科技股份有限公司(中国上海)的IllluminaMiSeq平台和MiSeqReagent Kit v3的双端2×250 bp测序[28-30].
3)微生物群落结构分析:通过层次聚类和冗余分析(redundancy analysis,RDA)挖掘样品间的物种组成差异和环境因子的相关性[31-32].
1.5 数据处理与分析
根据实验结果和质量守恒定定律计算沉积物中F-的累次释放量和单次释放量,计算公式见式(1)~(2):
Mi=(C1i·V1+C2i·V2)-(C10·V1+C20·V2)
(1)
式中,Mi为第i次实验测试结果沉积物F-的累次释放量,mg;C10为初始上覆水中F-浓度,mg/L;C20为初始孔隙水中F-浓度,mg/L;C1i为第i次实验此时结果上覆水中F-浓度,mg/L;C2i为第i次实验此时结果孔隙水中F-浓度,mg/L;V1为容器中上覆水体积,L;V2为容器中孔隙水体积,L;i为实验测试次数,当i=10时,计算结果则为释放总量,否则为累次释放量.
mi=Mi-Mi-1
(2)
式中,mi为第i次实验测试结果沉积物F-的单次释放量,mg;Mi为第i次累次释放量,mg;Mi-1为第i-1次累次释放量,mg;i为实验测试次数.
水质数据变化通过Origin 2018软件绘制,上覆水中各阴阳离子与F-间的相关性(Pearson相关性分析)以及上覆水F-与pH间的相关性(一元线性回归分析)利用Excel 2010、SPSS 22.0软件计算. 采用R语言进行方差分析,采用UPGMA算法对微生物群落进行Beta多样性层次聚类分析,基于97%相似水平的OUT对主要菌属的相对丰度和环境因子的相关性开展RDA分析,利用PHREEQC 2.16计算饱和指数[5].

图1 不同实验组上覆水和孔隙水F-浓度变化Fig.1 F- concentration changes of overlying water and pore water in different groups
2 结果与分析
2.1 上覆水和孔隙水F-浓度变化

图2 各实验组沉积物释放F-总量Fig.2 Total amount of F- released by sediments in each group
根据图1所示,初始时0.5倍、1倍、1倍灭菌、2倍、4倍浓度组上覆水F-浓度分别为0.35、0.69、0.69、1.38 和2.76 mg/L,随实验进行,各组上覆水和孔隙水F-浓度发生了不同程度变化,除了4倍浓度组F-浓度有所下降(实验结束时为2.51 mg/L),其余4组的上覆水F-浓度均有小幅度的上升. 另外1倍灭菌组中上覆水及孔隙水F-浓度均要稍低于同倍非灭菌组,说明微生物活动会影响F-的迁移.
2.2 湖泊沉积物F-释放量
如图2所示,沉积物释放F-的总量由高到低依次为0.5倍、1倍、1倍灭菌、2倍和4倍组. 其中2倍组和4倍组沉积物由释放F-转为吸附F-. 相比于1倍灭菌组,1倍组中沉积物F-释放量更高. 根据实验数据,沉积物总氟含量为41.49 mg. 各实验组释放F-含量占总量的比例分别为0.85%(0.5倍组)、0.69%(1倍组)、0.19%(1倍灭菌组)、-0.35%(2倍组)以及-1.45%(4倍组)(负号代表吸附).
2.3 微生物群落变化
从初始沉积物及各实验组共11个样品的层次聚类图(图3)可以看出,左侧各组的相似关系总体可以分为灭菌组和非灭菌组两大类,证明灭菌会对沉积物中微生物群落产生很大影响. 由图3可知,除Thiobacillus外,实验前后沉积物主要菌属组成有较大差异. 初始沉积物中Paenisporosarcina相对丰度较高,但实验后各浓度组该菌属相对丰度接近0,表明上覆水F-浓度一定程度上抑制了Paenisporosarcina的代谢和生长;Clostridium_sensu_stricto_13和Fusibacter在各浓度组占比与初始沉积物相比都有不同程度的增加. 灭菌组和其他非灭菌组沉积物中菌落在属水平组成上表现出极大差异. 灭菌组菌属以Sedimentibacter和Exiguobacterium为绝对主导,而非灭菌组中Thiobacillus占绝对支配,但随F-浓度增加,其相对丰度逐渐降低. 非灭菌组中不同浓度组沉积物菌落整体组成差异不大,仅1_1中Clostridium_sensu_stricto_1,2_1、4_1和4_2中Fusibacter相对丰度较高,其中Fusibacter表现出良好耐高浓度氟的属性.
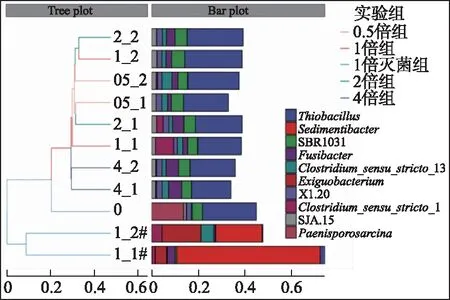
图3 基于属水平各实验组相对丰度的层次聚类分析 (0为处理前的样品编号,05_1、05_2、1_1、1_2、1_1#、1_2#、2_1、2_2、4_1和4_2为处理后的样品编号, “_”前面数字表示上覆水F-浓度倍数,后面数字表示平行样编号,#表示灭菌组,下同)Fig.3 The hierarchical cluster analysis based on the relative abundance of different groups at the genus level
2.4 水体化学特征对湖泊沉积物F-释放的影响
2.4.1 pH对湖泊沉积物F-释放的影响 实验数据显示,上覆水pH平均值为7.25,并且在各浓度条件下均无显著差异;0.5倍组孔隙水pH值(平均值为7.1)显著低于其他组,其余4组无显著差异,且平均值为7.4.
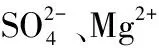
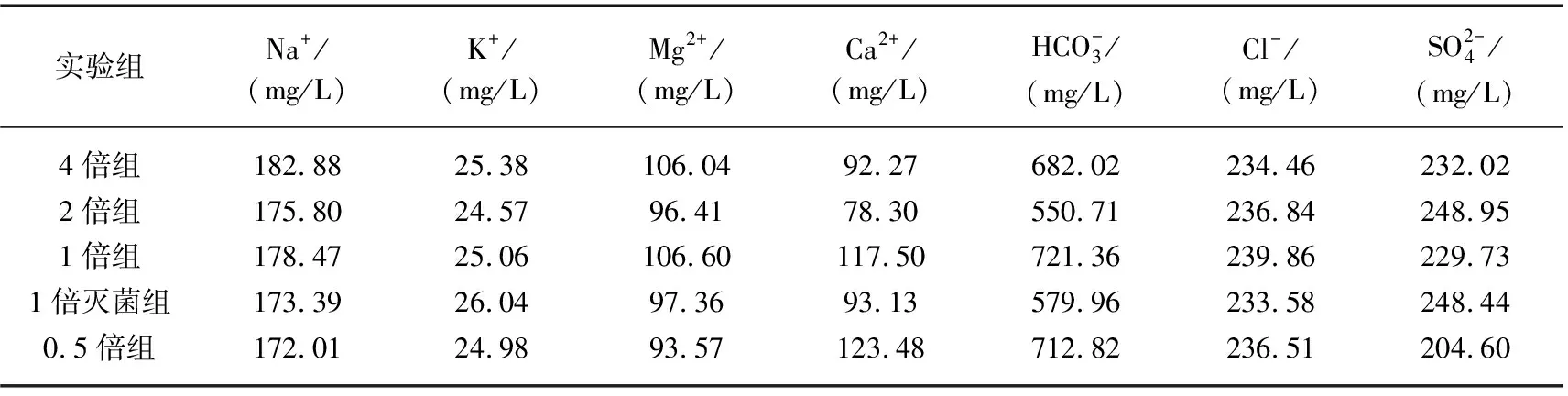
表1 各实验组上覆水中离子浓度平均值

表2 各实验组上覆水中F-与离子浓度的Pearson相关性分析
3 讨论
3.1 不同上覆水F-浓度背景下环境因子与湖泊沉积物中微生物群落的相互作用
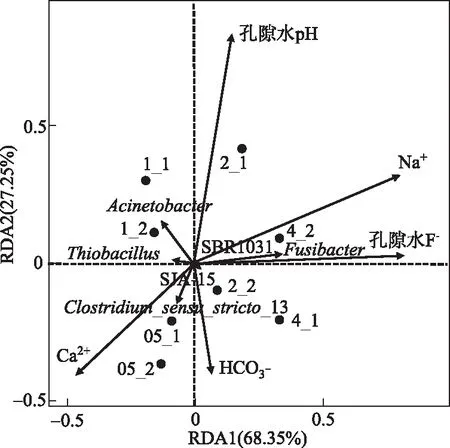
图4 孔隙水中主要菌属相对丰度与 环境因子的RDA分析 Fig.4 RDA analysis of main bacteria and environmental factors of pore water


3.2 不同上覆水F-浓度下pH对湖泊沉积物F-释放的影响
3.3 上覆水中主要离子与F-浓度的相关关系


图5 各实验组沉积物中CaCO3和CaF2的饱和指数Fig.5 Saturation indixes of calciteand fluorite in sediments of each group
各实验组沉积物表现出98%的CaCO3饱和指数>0和所有萤石CaF2饱和指数<0,表明本实验沉积物-水体系更容易发生含钙矿石的沉淀和含氟矿石的溶解. 各浓度组之间相比,4倍浓度组CaF2饱和指数最高(-0.89~-0.58),0.5倍浓度组CaF2饱和指数最低(-2.63~-1.81),因为上覆水较高的F-浓度会抑制CaF2等含氟矿物的溶解.

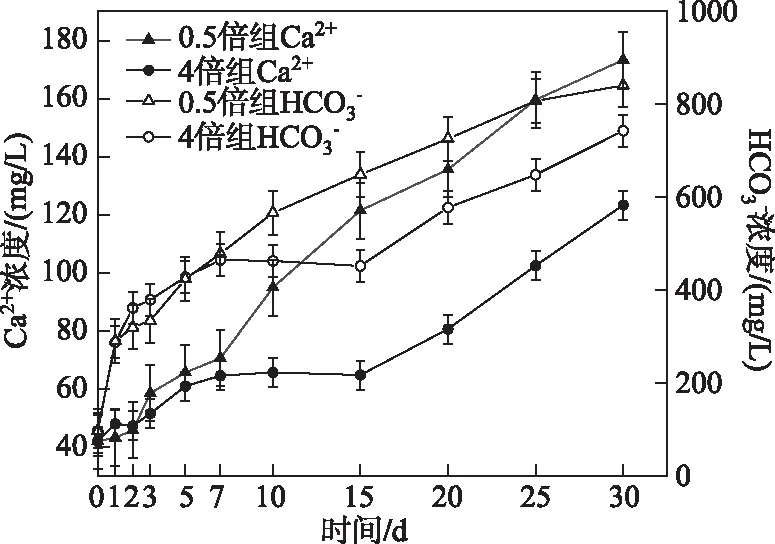
图6 0.5倍和4倍实验组上覆水Ca2+和浓度变化Fig.6 The changes of Ca2+ and concentrations of two groups (0.5 and 4 times)

图7 不同实验组间上覆水与孔隙水F-浓度差Fig.7 The F- concentration gradient between overlying water and pore water of each group

4 结论
1)不同F-浓度背景下,沉积物F-的释放量由大到小依次为0.5倍组、1倍组、1倍灭菌组、2倍组和4倍组,沉积物F-的释放量随上覆水F-浓度的增加而呈下降的趋势,其中2倍和4倍组的沉积物由释放F-转变为吸附F-. 对比灭菌组和非灭菌组,灭菌组F-的释放量更小.
2)初始组中Paenisporosarcina相对丰度较高,但实验后各浓度组该菌属相对丰度接近0,灭菌组菌属以Sedimentibacter和Exiguobacterium为主要菌属,而非灭菌组中Thiobacillus占绝对支配. 非灭菌组中,随着F-浓度增加,Thiobacillus的相对丰度逐渐降低,而Fusibacter的相对丰度逐渐升高.
3)除了0.5倍组,其余各组沉积物F-释放量均与上覆水pH呈显著正相关,其中4倍浓度组呈极显著相关. pH越大,沉积物中F-释放增量越大.

5)通过模拟沙湖沉积物-水系统,探究不同上覆水F-浓度背景下沙湖沉积物中F-释放和迁移机理,为沙湖及其他含氟地表水防治提供理论支持.

