儿童急性淋巴细胞白血病ABCB1、ABCC4和SLCO1B1多态性与大剂量MTX血药浓度及不良反应的相关性
田晓怡,刘 颖,姚 瑶,顾秀丽,李爱华,郑胡镛,宋文琪*
(国家儿童医学中心 首都医科大学附属北京儿童医院 1.检验中心;2.血液病中心 儿童血液病与肿瘤分子分型 北京市重点实验室 儿科学国家重点学科 儿科重大疾病研究教育部重点实验室,北京 100045)
甲氨蝶呤(methotrexate, MTX)是一种抗肿瘤药,可造成 DNA 合成障碍,对增殖旺盛的细胞具有较强的杀伤作用,从而抑制肿瘤细胞的增殖。大剂量甲氨蝶呤(high dose-MTX, HD-MTX)在儿童急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)巩固治疗及髓外白血病的防治中得到广泛应用。MTX在个体间药代动力学差异大,用药后血药浓度超过规定的安全范围称为排泄延迟。有些患儿会因药物在体内排泄延迟而引起不同程度的药物不良反应(adverse events,AEs),包括骨髓抑制、肝肾毒性、黏膜炎以及胃肠道反应等。
三磷酸腺苷结合盒转运体(ATP-binding cassette transporters, ABC)和溶质载体有机阴离子转运体(solute carrier organic anion transporter, SLCO)家族编码的蛋白定位于细胞膜和多种亚细胞器膜上,是参与药物外排的关键蛋白。编码这些蛋白的基因的遗传变异与MTX血浆药物浓度,药物治疗反应和不良反应密切相关[1]。本研究对巩固治疗阶段接受HD-MTX规范化学治疗(简称化疗)的ALL患儿进行了ABCB1,ABCC4和SLCO1B1基因多态性的检测,分析其与MTX血药浓度以及不良反应的相关性,将有助于指导临床个体化用药,避免药物不良反应的发生。
1 材料与方法
1.1 病例
选取2018年1月至2019年12月于首都医科大学附属北京儿童医院住院且规范治疗的ALL患儿,均经骨髓细胞学检查确诊。所有患儿经诱导缓解治疗和早期强化治疗后处于完全缓解状态,开始在巩固治疗阶段给予HD-MTX化学治疗,化疗前经血常规,尿常规,生化肝肾功能检查均正常,没有化疗禁忌及感染征象。排除未接受完整规范治疗的患者,以及排除严重心、肺、肝肾功能不全者。本研究通过首都医科大学附属北京儿童医院医学研究伦理委员会审查(审批号:2018-k-4),监护人签署知情同意书。
依据中国儿童白血病协作组(Chinese Children’s Leukemia Group, CCLG)ALL 2008方案,低危组患儿采用MTX 2.0 g/m2,中危组患儿采用MTX 5.0 g/m2。监测45 h MTX血药浓度,根据MTX稳态浓度及排泄情况进行四氢叶酸钙解救,如果血浆MTX浓度大于0.25 μmol/L则继续解救并每24 h监测血浆MTX浓度,直到浓度低于0.25 μmol/L时,可停止亚叶酸钙解救。化疗过程中及化疗后,参考美国国立癌症研究所常见不良事件评价标准5.0版(CTCAE v5.0)[2]观察并记录有无骨髓抑制、脏器功能损害(肝、肾、心脏及神经系统等)、口腔或肛周黏膜损伤、发热、呕吐、腹泻等胃肠道反应相关的药物不良反应。
1.2 方法
1.2.1 MTX血浆药物浓度的检测:HD-MTX用药后45 h采集患儿静脉血2 mL加入EDTA二钾(K2EDTA)抗凝管,在相对离心力(relative centrifugal force, RCF)≥10 000×g离心10 min后,收集上层血浆进行血药浓度的检测。通过化学发光微粒子免疫分析(chemiluminescent microparticle immunoassay, CMIA)检测技术,使用甲氨蝶呤(MTX)测定试剂盒(雅培公司)在Architect i2000系统上定量检测人血浆中的MTX的浓度。
1.2.2 延伸连接的多重探针扩增(multiplex extend-ed ligation-dependent probe amplification,MELPA)技术检测基因型:通过核酸飞行质谱(MALDI-TOF MS)[3]对血细胞中ABCB1 rs1045642、ABCC4 rs7317112和SLCO1B1 rs11045879和rs10841753这4个单核苷酸多态性(SNP)位点进行检测。采用患者的血细胞制备干纸血片,用无菌干净的打孔器打直径为5 mm干纸血片2片置于离心管中,加入3×裂解液50 μL,20 mg/mL蛋白酶K 2 μL,连接探针混合液1.5 μL,捕获探针混合液1.5 μL,反向引物(10 μmol/L)3 μL,去离子水 92 μL,置于空气浴摇床56 ℃ 30 min振荡,转移100 μL至96孔捕获板98 ℃热变性5 min后55 ℃过夜孵育。洗板后,每孔加入50 μL连接延伸混合液,包括10×NEB buffer 2 5 μL,10 mol/L dNTP 0.5 μL,100×BSA 0.5 μL,T4 DNA ligase 0.5 μL,T4 DNA polymerase 0.5 μL,去离子水43 μL。12 ℃孵育15 min后,25 ℃孵育1 h,吸弃液体,再加入25 μL通用引物PCR反应体系,包括正反向引物(10 μmol/L)10 μL,10 mmol/L dNTP 1.25 μL,10×Easy Taq缓冲液2.5 μL,Easy Taq DNA聚合酶0.5 μL,反应在PCR仪上95 ℃ 2 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 60 s进行45个循环后,72 ℃ 5 min延伸反应。采用iPLEX Gold试剂盒(Agena Bioscience公司)进行虾碱性磷酸酶反应,去除上述PCR产物中未反应的dNTP;随后进行单碱基延伸反应,具体步骤按照试剂说明书操作。采用树脂试剂盒(Agena Bioscience公司)纯化单碱基延伸产物后,点样至芯片,通过核酸飞行质谱进行检测与分析。本实验中所使用的通用引物,捕获探针和连接探针以及单碱基延伸引物如下表所示(表1)。
1.3 统计学分析
应用SPSS 26.0进行统计学分析。计数资料用例(%)表示,采用χ2检验分析MTX排泄延迟和各个SNP基因型之间的相关性。采用拟合优度χ2检验判断基因型分布是否符合Hardy-Weinberg定律。

表1 MELPA方法测基因多态性所用探针以及引物Table 1 Probes and primers in MELPA assay for gene polymorphisms analysis
2 结果
2.1 一般情况
巩固治疗阶段接受HD-MTX化疗的275例ALL患儿中,男性163例(占59.3%),女性112例(占40.7%);初诊时年龄范围在1~15岁,平均(4.6±2.8)岁,年龄<10岁的有253例(占92%),≥10岁的有22例(占8%);诊断时外周血白细胞计数<50×109/L的有245 例(占89.1%),≥ 50×109/L的有30例(占10.9%);参照儿童急性淋巴细胞白血病诊疗建议的危险度分层:低危组患儿103例(占37.5%),中危组患儿172例(占62.5%)。
HD-MTX化疗期间,药物不良反应发生频率最高的为骨髓抑制86例(占31.3%),其次为肝功能损伤57例(占20.7%),口腔黏膜炎和肛周黏膜炎依次为35例(占12.7%)和21例(占7.6%),胃肠道反应和心肌损害发生频率较低,分别为12例(占4.4%)和9例(3.3%)。
2.2 基因多态性与MTX排泄的关系
ABCB1、ABCC4和SLCO1B1各SNP位点基因型分布均符合Hardy-Weinberg定律,说明入选样本具有群体代表性。275例中共有242例在第1次HD-MTX静脉滴注后45 h血药浓度大于0.25 μmol/L,排泄延迟发生率为88.0%。ABCB1 rs1045642位点,ABCC4 rs7317112位点,SLCO1B1 rs11045879位点和rs10841753位点各基因型患儿之间MTX排泄延迟发生率见表2。ABCC4 rs7317112 AA/AG基因型与GG基因型患儿MTX排泄延迟发生率分别为89.5%和64.7%,连续性校正χ2检验显示rs7317112 位点AA/AG基因型患儿发生MTX排泄延迟的风险显著增加(P<0.01)(表2)。SLCO1B1 rs11045879位点 TT和TC基因型与CC基因型患儿MTX排泄延迟发生率分别为90.4%和76.1%,χ2检验显示rs11045879 TT和TC基因型患儿发生MTX排泄延迟的风险显著增加(P<0.01)(表2)。ABCB1 rs1045642位点和SLCO1B1 rs10841753位点各基因型患儿之间MTX排泄延迟未见差异。
2.3 基因多态性与MTX药物不良反应的关系
ABCB1 rs1045642位点,ABCC4 rs7317112位点,SLCO1B1的rs11045879位点和rs10841753位点不同基因型患儿所有不良反应发生率(包括肝功能损害、胃肠道反应、口腔黏膜炎、肛周黏膜炎、骨髓抑制和心肌损害)组间比较均无差异(表3)。
3 讨论
大剂量MTX可以透过血脑屏障和血睾屏障,减少ALL患儿髓外白血病的复发,对提高患儿总体生存率起到关键作用,但HD-MTX在增加细胞毒作用提高抗肿瘤疗效的同时,过高的浓度也会导致骨髓抑制、黏膜损伤以及肝脏、胃肠道、心肌等重要脏器的损伤,因此,需要密切监测血药浓度,根据血药浓度,及时合理地进行甲酰四氢叶酸钙解救。国内外研究发现个体间药物代谢差异很大,一些药物代谢相关的基因多态性与药物排泄密切相关。本研究重点分析与MTX药物外排密切相关的3个基因ABCB1、ABCC4和SLCO1B1的多态性, 在中国儿童ALL患者中分析其与血药浓度和药物不良反应的相关性。

表2 ALL患儿基因多态性与45 h MTX血药浓度的相关性Table 2 Association between gene polymorphisms and 45 hours MTX concentration in children with ALL
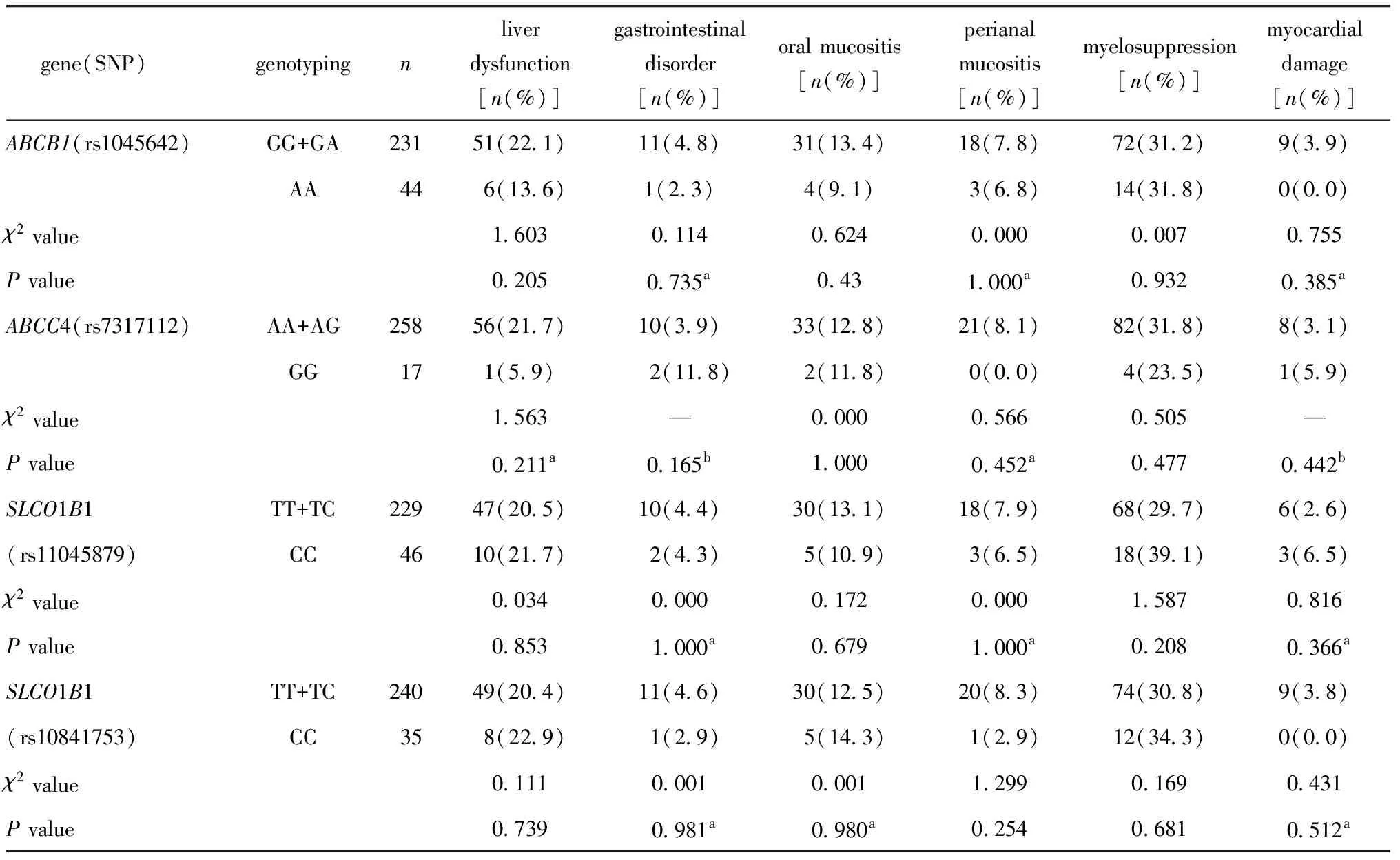
表3 ALL患儿基因多态性与MTX药物不良反应(AEs)的相关性Table 3 Association between gene polymorphisms and MTX-induced adverse effects(AEs) in children with ALL
ABC基因家族编码的跨膜蛋白广泛存在于各种细胞膜表面,可将碳水化合物、细胞内代谢物或药物等物质转运出细胞膜。这些基因的多态性会导致蛋白的改变,进而转运功能的改变,影响药物浓度。ABCB1和ABCC4在MTX的外排中起重要作用,其基因多态性影响药物的有效性和安全性[4]。近年来,关于ABCB1rs1045642位点(即ABCB1C3435T)分型与MTX在体内排泄和药物不良反应相关性的研究结果也不尽相同。血液系统恶性肿瘤成年患者中未发现ABCB1rs1045642位点多态性与排泄延迟相关,但发现与HD-MTX化疗后肝功能损伤相关[5]。ALL患儿中发现ABCB1C3435T位点基因多态性与HD-MTX化疗开始后48 h血药浓度之间有相关性,突变型TT型血药浓度更高;而与MTX化疗产生的各种不良反应不相关[6]。有研究在ALL患儿中未发现ABCB1rs1045642变异与MTX排泄延迟的相关性[7],与MTX 72 h血浆药物浓度也无关[8]。中国ALL患儿中发现ABCB1rs1045642位点多态性与HD-MTX导致的口腔黏膜炎发生率并不相关[9]。同样地,本研究基于较大队列的ALL儿童患者虽然观察到rs1045642位点AA基因型较GG+GA基因型的MTX排泄延迟率较高,但也并未发现其与45 h血浆药物浓度相关,且不同基因型间MTX药物不良反应发生率也无统计学差异。有研究在80例ALL患儿中发现ABCC4rs7317112位点AA野生型黏膜炎发生率较高[10]。本研究未观察到ABCC4rs7317112位点不同基因型间各种不良反应存在统计学差异;然而,本研究发现GG基因型药物排泄比AA/AG型快,AA/AG基因型是发生MTX排泄延迟的危险因素。黏膜炎等不良反应的发生是由于HD-MTX化疗引起细胞内叶酸水平耗尽导致细胞死亡,与患者饮食中的叶酸摄入和体内叶酸水平等密切相关,并不与MTX排泄延迟直接相关[10],这也与本研究中观察到的现象是一致的。
SLCO1B1编码的OATP1B1位于细胞膜上,对MTX泵出细胞发挥了重要的作用。有研究人员在115例西班牙B-ALL患儿中发现MTX 72 h血浆药物浓度与SLCO1B1rs11045879位点的基因型相关[8]。先前的研究在70例ALL患儿中未观察到SLCO1B1rs11045879位点多态性与患儿体内MTX血药浓度相关,与各不良反应发生率均不相关[11]。本研究发现SLCO1B1rs11045879位点CC型与TT型/TC型相比药物排泄较快;但未见基因多态性与各不良反应发生率相关。这可能由于不同的研究入组患者的种族、采取的治疗方案、血药浓度监测时间点不同,将来需要更大样本量的进一步验证。同时,本研究发现SLCO1B1rs11045879位点和rs10841753位点的多态性与HD-MTX导致的各种不良反应发生率并不相关,这也与先前的研究一致[9]。
综上所述,本研究结果初步提示,ABCC4rs7317112位点和SLCO1B1rs11045879位点多态性与儿童ALL HD-MTX化疗后45 h药物排泄延迟相关;而与HD-MTX化疗所产生的各种不良反应不相关。下一步需要更大样本量,纳入分析更多基因SNP位点来进一步验证,为临床个体化用药提供更加可靠的依据。

