儿科营养筛查-评估工具在消化科患儿中的应用
王之欣 陆丽娜 王金玲 颜伟慧 蔡 威,2,3 王 莹,2
1.上海交通大学医学院附属新华医院小儿消化营养科;2.上海市小儿消化与营养重点实验室;3.上海市儿科医学研究所(上海 200092)
对我国住院儿童进行营养状况分析,是儿科医务工作者共同关注的问题,但目前尚缺乏统一、规范、有效的营养状况分析工具。自2000 年起,国外专家们逐步推出了各类营养筛查工具,包括儿科营养风险评分工具(Pediatric Nutritional Risk Score,PNRS)、儿科主观全面营养评估(Subjective Global Nutritional Assessment,SGNA)、儿科营养不良筛查工具(Screening Tool for The Assessment of Malnutrition in Pediatrics,STAMP)、营养状况和生长发育风险筛查工具(STRONGkids)、简易营养筛查工具(Simple Pediatric Nutrition Screening Tool,PNST)等[1-5]。然而,上述营养筛查工具各有其优缺点,一些工具因其繁琐的饮食调查、既往史问询等,费时费力,不能满足临床快速筛查的需求;而操作较为简便的工具(如STAMP等)又因其收集信息不完整导致营养状况的准确性受到限制。营养不良应当包含营养不足和营养过剩两个方面,而上述筛查工具并未考虑营养过剩的问题。中国儿童疾病谱与研发筛查工具国家疾病谱不完全相同[6],因此在判断疾病风险方面上述工具可能存在部分不足。国际上,尚无公认的营养筛查或营养评估工具。
基于上述问题,自2013年起,中华医学会肠外肠内营养学分会儿科学组制定了临床操作快捷方便的营养筛查工具,适合我国疾病谱,即改良儿科营养筛查工具[7],但尚未构建起一个规范、完整的营养管理流程。在此基础上,自2018年起,肠外肠内营养学分会开发了一项致力于住院患儿营养状况分析的工具——“儿科营养筛查”APP,完善了改良儿科营养筛查工具临床实践中遇到的问题,并加入了营养评估的部分。采用此工具,对小儿消化营养科住院儿童营养状况进行分析,了解营养不良风险发生率及不同营养状况下临床结局及生化指标差异,为合理营养干预提供依据。
1 对象与方法
1.1 研究对象
选取2018年3月至2020年10月上海交通大学医学院附属新华医院入住小儿消化营养科的患儿为调查对象。纳入标准:(1)新入院患儿,年龄在1 月龄~16岁;(2)住院天数≥3天。排除标准:(1)无法配合测量身高体质量的患儿;(2)存在明显水肿,确诊腹腔积液、胸腔积液患儿。
1.2 儿科营养筛查-评估工具
营养状况的评定应当包括营养筛查与评估两部分。本研究采用“儿科营养筛查”APP,该APP 的功能主要分为营养筛查以及营养评估两个模块。
1.2.1 营养筛查
营养筛查即通过简易而快速的方法判断患儿是否存在营养不良风险。通过“儿科营养筛查”APP,由护士在入院后24 h内填入患儿诊断,身高体质量头围(1 月龄~2 岁),饮食摄入情况等信息后完成。疾病风险得分、饮食摄入得分和体格检查得分3 项相加的总分≥2分则认为存在营养不良风险,见表1。疾病风险部分根据ICD-10 疾病编码下的疾病诊断进行风险评估,所有诊断对应的风险得分事先已录入APP。体格测量部分根据患儿的年龄别体质量Z值,年龄别身高Z 值,身高别体质量Z 值,年龄别体质量指数(BMI)Z值(5岁以上患儿),所有Z值根据标准,评分后取最高分计入最后得分,评价标准采用WHO生长曲线标准和中国肥胖工作组标准。

表1 营养不良风险的评定标准 [n (%)]
1.2.2 营养评估
营养评估即通过疾病史、喂养/饮食史、用药史、营养相关体格检查结果(如身高体质量)、实验室检验结果等全面定义患儿营养状况[8]。“儿科营养筛查”APP采用了儿童主观整体营养评估(SGNA),由专业的营养师或受过相关培训的营养从业人员完成,SGNA评价具体标准参考《营养筛查与评估》[9]。此法包括营养相关病史和体格检查两部分。营养相关病史包括体格测量后对当前身高和体质量的综合评估(结合父母身高),既往病史、膳食调查、胃肠道症状、疾病应激状态,生理功能以及皮脂肌肉消耗程度,有无水肿等多方面的评估。营养评估结果分为营养状况正常、中度营养不良、重度营养不良3种。
1.3 临床结局和实验室指标
本研究分析了不同营养状况下临床结局和生化指标是否存在差异。临床结局包括所有入组患儿的住院天数、住院费用、感染发生率。满足下述条件之一即可定义为感染:(1)住院期间新出现的体温连续2天38 ℃以上,伴临床相关症状(如呼吸道症状或消化道、泌尿道症状);(2)实验室检查白细胞、CRP或降钙素原明显增高;(3)感染部位病原菌培养阳性;(4)若入院时已有感染,出现其他部位新发感染或原有感染病灶培养出新的病原体[10]。收集患儿入院24 h内采集的静脉血生化指标,包括前白蛋白、总蛋白、白蛋白、血红蛋白水平,以及维生素A、D水平。
1.4 统计学分析
采用SPSS 24.0 统计软件对数据进行分析。营养筛查结果分为营养不良风险和无营养不良风险两组。营养筛查确定为存在营养不良风险的患儿,将进行下一步完整详细的营养评估。营养评估结果分为营养状况正常、中度营养不良、重度营养不良三组。其中计量资料符合正态分布的,以均数±标准差表示,组间比较采用t检验和单因素方差分析;不符合正态分布的,以M(P25~P75)表示,组间比较采用非参数检验。计数资料以百分比或率表示,采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
共入院患儿845例,符合纳入标准657例,因无法配合测量身高体质量或存在胸腹水排除33例,最终入组624例。其中男368例,女256例,年龄分布5岁4月(1月~16岁)。其中0~1岁158例(不含1岁),1~3岁95例,>3岁371例。入选的病种包括短肠综合征221例、急性胰腺炎9例、慢性腹泻36例、急性消化道出血52例、炎症性肠病41例及其他265例(如腹痛、呕吐等)。
2.2 营养筛查结果
624例患儿中共有351例存在营养不良风险,发生率56.25%,性别与营养不良风险无关;小年龄组患儿营养不良风险发生率更高。不同疾病种类的营养不良风险发生率分析中,短肠综合征、急性胰腺炎、慢性腹泻为高营养不良风险的3大病种,无营养不良风险组与营养不良风险组比较见表2。
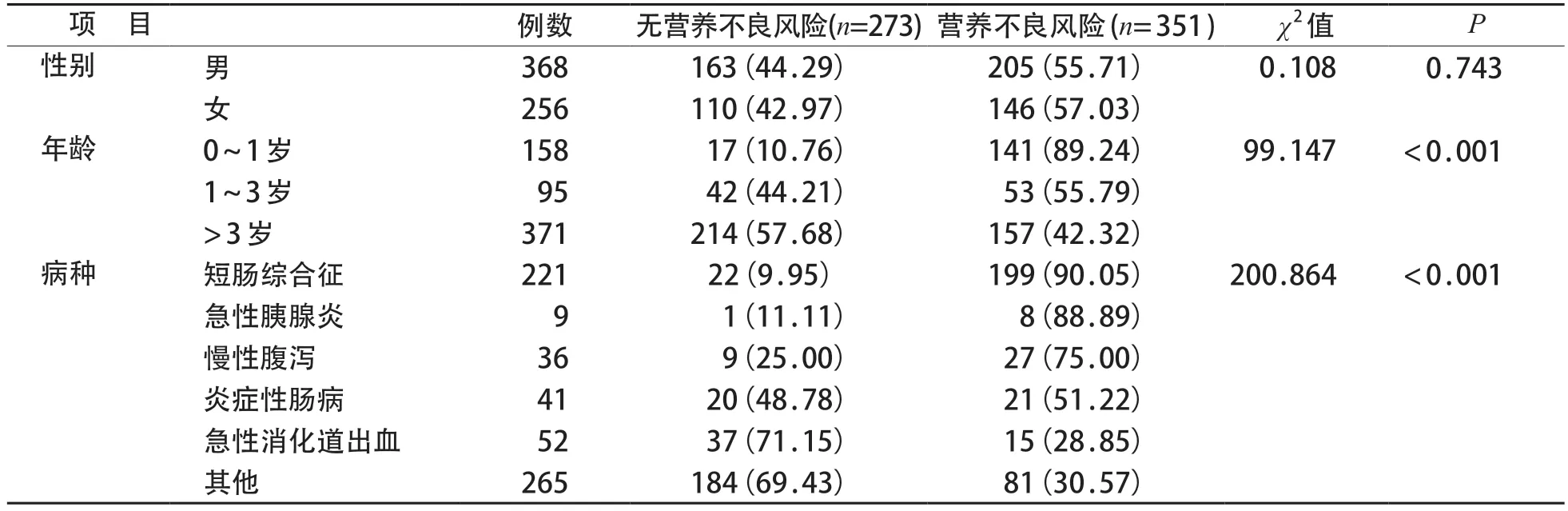
表2 两组营养筛查性别、年龄、病种结果比较
不同营养不良风险组患儿的营养相关实验室指标(包括前白蛋白、总蛋白、白蛋白、血红蛋白、维生素A、D等)以及临床结局(住院天数、住院费用、感染发生率),见表3。对比无营养不良风险组,营养不良风险组住院天数延长,住院费用增加,感染发生率增高,总蛋白、白蛋白、血红蛋白、维生素D 水平降低(P均<0.05)。

表3 两组营养筛查不同营养风险下生化指标以及临床结局的比较
2.3 营养评估结果
筛查出营养不良风险患儿351例,其中64例患儿因住院天数短未完成营养评估,共完成营养评估患儿287例。中度营养不良103例(35.89%),重度营养不良47例(16.37%)。性别与营养评估结果无关;小年龄组患儿重度营养不良发生率更高,见表4。

表4 营养评估性别、年龄3组结果比较[n (%)]
正常、中度营养不良和重度营养不良三组患儿的营养相关实验室指标(包括前白蛋白、总蛋白、白蛋白、血红蛋白、维生素A、D等)以及临床结局(住院天数、住院费用、感染发生率),见表5,重度营养不良组患儿的住院天数、住院费用、感染发生率最高,总蛋白、白蛋白水平最低(P均<0.05)。
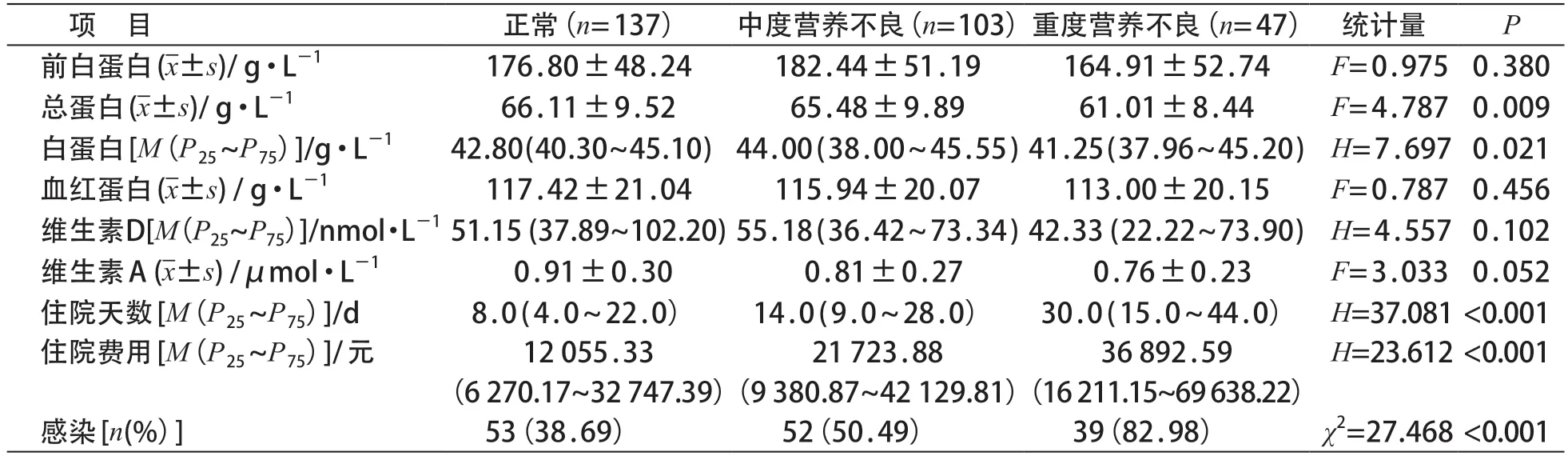
表5 营养评估不同营养状况下生化指标以及临床结局的差异
3 讨论
住院儿童的营养状况应当受到重视,儿童人群因其较高的新陈代谢需要,更易发生且更易快速发生营养不良,对疾病的预后及其生长发育产生影响。目前住院儿童的营养不良发生率仍较高,营养状况与临床结局存在相关性,甚至影响儿童远期发育,如智能发育、认知功能等等造成严重后果[11]。早期发现住院儿童营养不良并进行早期干预有助于缩短住院天数以及减少并发症发生,同时有效的降低住院费用[12]。
相比于其他国外营养筛查工具,“儿科营养筛查”APP真正满足了营养状况评定要求,在临床快速筛查基础上加入了营养评估。营养评估使用的是儿科主观全面营养评估(SGNA)方法,其前身为主观全面评价法(SGA),可靠性已在中国成年住院患者中被证实[13],SGNA 自身也在研究中被证明有着良好的灵敏感和特异度,与营养状况的体格测量结果及综合营养评估结果存在较好的一致性[14]。
本研究对上海交通大学医学院附属新华医院小儿消化营养科3年共624例患儿数据进行分析,得出营养不良风险发生率在56.25%,其中中度营养不良和重度营养不良的发生率各为35.89%和16.37%。国内也有相关研究,南京医科大学附属儿童医院使用STRONGkids 的营养风险筛查中,93.73%的消化科住院患儿处于中高风险[15],而在成都市妇女儿童中心医院使用STAMP 的营养筛查中,中高风险的消化科住院患儿占了96.00%[16]。上述医院的营养筛查中患儿年龄偏小,小年龄组分别占了55.0%和72.2%,而本研究中仅有25.3%,这可能是营养筛查结果差异的原因。同时,国外有研究证明STRONGkids具有较高的灵敏度89%,和较低的特异度35%,STAMP 评价结果与STRONGkids 相似[17],也可能其筛查风险较高的原因之一[18]。总体而言,消化科患儿营养不良风险发生率普遍较高,需要引起临床重视。
小年龄组的住院患儿营养不良风险发生率高,中重度营养不良率也高于年龄较大组别患儿,这与其他研究结果一致[19-20]。0~1岁患儿由于年龄小,能量需求高,自身储备小,更容易受到疾病的影响从而发生营养不良,因此,对于婴幼儿住院患者应该更关注营养情况。不同疾病营养不良风险差异有统计学意义(P<0.05),短肠综合征患儿营养不良风险最高,为90.05%,急性胰腺炎患儿风险为88.89%,慢性腹泻患儿风险为75.00%,炎症性肠病患儿风险为51.22%。短肠综合征患儿的肠道吸收功能不能满足生长发育需要,营养不良风险发生率最高。慢性腹泻与炎症性肠病都导致了肠道黏膜受损,且病程长,长期的肠道吸收不足从而导致较高的营养不良风险,许明霞等[21]的研究也提示了类似结果。急性胰腺炎病程中存在炎症细胞因子的级联反应和蛋白质分解代谢的增高,治疗又导致了长时间的摄入不足,可能为高营养不良风险的原因[22]。胰腺炎过去被认为在儿童中罕见,临床上是否早期给予营养支持目前存在争议,部分研究认为尽早开放肠内营养可能为较优选择[23],但尚需要更多的研究数据支持。
营养状况与患儿临床结局存在明显相关性。对比无营养不良风险组,营养不良风险组住院天数明显延长,住院费用增加,感染发生率更高。营养评估结果提示重度营养不良组患儿住院天数、住院费用、感染发生率高于其他两组,差异均存在统计学意义。多项研究[15-16,18,24]在使用STAMP 和STRONGkids以及PNST 等筛查工具的研究中,营养不良风险患儿住院天数与费用明显增长,感染发生率增加,CRP和白细胞水平明显高于营养正常组。可见,营养状况是影响临床结局的重要因素,合理及时的营养干预可能能够改善患儿的临床结局。
营养状况与患儿总蛋白、白蛋白、血红蛋白、维生素D 水平也存在明显相关性。对比无营养不良风险组,营养不良风险组总蛋白、白蛋白、血红蛋白、维生素D 水平明显降低。营养评估结果也提示总蛋白、白蛋白水平在重度营养不良组明显降低,营养筛查和评估结果存在较好的一致性。国外研究也证明了营养不良风险患者的贫血发生率更高[24]。白蛋白的半衰期长,传统观点认为其是一个可靠的营养不良相关指标。在一项纳入60例心脏移植受者研究中,血清白蛋白被发现比体质量指数(BMI)和主观全面评估(SGA)更能预测潜在的营养不良[25]。但白蛋白、前白蛋白等主要在肝脏合成,影响因素众多,除了蛋白质能量营养不良因素外还包括肝脏合成功能受损、炎症状态、甲状腺功能等因素[26],将其作为营养不良的实验室诊断指标,国际上存在较大争议,不过目前的共识仍肯定其辅助判断的意义[27]。目前儿童的光照时间广泛不足,需要肠道额外补充维生素D,消化系统疾病患儿肠道吸收脂质能力下降,这可能是维生素D的缺乏的原因之一。一项meta分析提示维生素D的缺乏与脓毒症相关[28],营养不良导致感染发生率增高,也可能造成维生素D 缺乏。同为脂溶性维生素,儿童维生素D 的每日需求量明显大于维生素A[29],可能是维生素A 差异无统计学意义的原因。
住院儿童的营养管理目前尚未有通用、规范、完整的流程,中华医学会肠外肠内营养学分会儿科学组致力于开发儿科营养筛查-评估工具,构建营养诊疗流程,希望能推动临床营养筛查评估的开展,为营养支持提供合理依据,本研究为单中心单病区,尚需要多中心多病区的大样本数据进一步提供更多循证依据。

