幼年皮肌炎的药物治疗进展
孙艳茹综述 刘 力审校
天津大学儿童医院 综合内科(天津 300074)
JDM是幼年特发性炎性肌病中最常见的临床表型,平均发病年龄约为7岁,首次出现症状和确诊之间的平均时间为6个月[1]。JDM发病率较低,约2~4/百万儿童,欧美研究好发于女孩,男女比例估计为1:2~5,而亚洲研究显示男女发病率相当[2]。治疗主要是激素联合免疫抑制剂,初始治疗多采用一线药物,对于难治性、甲氨蝶呤反应不佳、初始治疗效果不好或药物副作用明显者,可采用激素联合二线药物或者三线药物[3],近年来也有在难治性患者中选用生物制剂的病例。而临床实践中,药物治疗的效果并不理想,因此是否可根据肌炎特异性抗体的不同实现个体化治疗,仍是需要进一步研究的重点。
1 一线药物
1.1 糖皮质激素 临床多采取口服泼尼松1~2 mg·kg-1·d-1(最大量60 mg/d),大剂量冲击治疗(10~30 mg·kg-1·d-1,最大量1 g/d)常用于危重症及严重肌无力[3]。儿童国际风湿病试验组织提出的关于初次诊断JDM患儿糖皮质激素减量/停药的循证建议[4]中指出,在接受3次糖皮质激素冲击治疗后,如果核心组测量值(Core Set Measures,CSM)降低>50%,在病程的前两个月糖皮质激素可从2 mg·kg-1·d-1减至1 mg·kg-1·d-1,随后4个月内可从1 mg·kg-1·d-1减至0.2 mg·kg-1·d-1,如果CSM进一步降低了8%~68%,则在随后的18个月内可以减停。因此JDM患儿可能需要长期服用糖皮质激素,而长期服用糖皮质激素副作用甚多,如体重增加、骨质疏松症、糖尿病、高血压、库欣综合征、感染风险增加等[5]。因此,在治疗中要尽可能的降低糖皮质激素的剂量和使用时间。
1.2 甲氨蝶呤(Methotrexate,MTX)可抑制中性粒细胞及淋巴细胞活化、增殖,广泛用于多种结缔组织病。在 Ruperto 关于JDM 的研究[6]中发现MTX 或环孢素A 与泼尼松联合都比单用泼尼松更有效,而且泼尼松加MTX 治疗安全性更高,因此推荐MTX 作为一线使用的免疫抑制剂。在日本的一项关于多发性肌炎和皮肌炎治疗共识[7]中指出,糖皮质激素联合MTX可降低早期糖皮质激素的用量,因此多数专家认为糖皮质激素和MTX 联合治疗是首次诊断为JDM 患者的标准治疗方案。推荐剂量10~15 mg/m2,每周一次,长期使用会导致口腔炎、胃肠道反应、间质性肺病、骨髓抑制、肝肾毒性等,因此常配合叶酸同时使用,定期监测肝肾功能[8]。
1.3 羟氯喹 属于抗疟疾药,后发现其可稳定溶酶体膜、抑制Toll 样受体活化、减少炎症细胞浸润等抑制炎症反应,减少I 型干扰素的生成[9]。2017年欧美儿童关节炎和风湿病学研究联盟(Children’s Arthritis and Rheumatology Research Alliance,CARRA)发布了JDM临床治疗共识[10],其建议对于以皮肤病变为主,无明显肌肉受累的患儿,将羟氯喹为基础用药,可单用或联合其他药物。常用剂量3~5 mg·kg-1·d-1,最大量400 mg/d,连续使用3年以上,需定期做眼科检查[8]。
2 二线药物
2.1 硫唑嘌呤(Azathioprine,AZA)属于嘌呤类似物,干扰嘌呤合成,抑制淋巴细胞增殖,用于环孢素A 或MTX 无效者[7]。研究发现AZA 较少引起肺部损伤,可用于皮肌炎相关的间质性肺病,避免MTX 相关性肺损伤[11]。在3 例接受AZA 治疗的难治性JDM 患者临床案例中发现[12],AZA 可改善皮肤病变,降低整体疾病活动度,且长期随访中并未发现明显不良反应。常用剂量1~3 mg·kg-1·d-1,bid~tid[8],该药具有致瘤性、会抑制骨髓功能、增加感染风险等,在治疗前期应每周监测血常规,连续2个月。
2.2 环孢素A(Cyclosporin A,CsA)环孢素A和他克莫司都属于钙调神经磷酸酶抑制剂,可抑制白细胞介素2和白细胞介素4,调节T细胞介导免疫反应。近年研究[13]发现CsA除了阻断钙调神经磷酸酶活性外,还能阻断p38和c-JunN端激酶通路。研究发现[14]CsA可改善肌肉力量,逐渐减少糖皮质激素用量。用于标准治疗方案难以治疗(如大剂量泼尼松+MTX)的患儿,常用剂量3~5 mg·kg-1·d-1bid[8],肾功能受损是其最常见、最严重的其不良反应,且具有剂量依赖性,因此用药期间应监测肾功能及血药浓度。
2.3 静脉用免疫球蛋白(Intravenous immunoglobulin,IVIG)在重症(特别适用于疾病进展迅速)、糖皮质激素和标准免疫抑制剂不能耐受或无效的情况下,静注IVIG 可作为替代选择或附加治疗[5]。多数推荐在确诊早期使用IVIG(1-2 g/kg,最大量70 g),每月1次[15]。在CARRA发布JDM共识治疗方案[16]中,将JDM患者分为三组:甲氨蝶呤和泼尼松(MP)组,甲强龙、甲氨蝶呤和泼尼松(MMP)组,甲强龙、甲氨蝶呤、泼尼松和免疫球蛋白(MMPI)组,结果显示MMPI 组6 个月后达到中度改善的比例是MP 组的4.16倍,是MMP的1.27倍。2019年法国发布的建议[17]中指出可以在糖皮质激素抵抗或依赖以及皮肤持续受累的JDM患者中使用IVIG。
3 三线药物
3.1 吗替麦考酚酯(Mycophenolate mofetil,MMF)通过抑制鸟苷核苷酸的合成而抑制T、B细胞增殖。有文献[18]表明MMF 除抑制淋巴细胞增殖外,还可抑制成纤维细胞增殖,被认为是治疗各种风湿性疾病的抗纤维化药物。在欧洲制定的JDM诊断和治疗共识[19]中指出MMF 对皮损、肌炎和钙质沉着治疗有效,可用于难治性JDM。Gabriela等[20]认为MMF 可改善肺功能,减少糖皮质激素用量。推荐剂量30 mg·kg-1·d-1,bid口服,最大量2 000 mg/d[8]。MMF 与其他免疫抑制剂相比肝肾毒性更小,是一种有效且耐受性良好的免疫抑制剂。当JDM 患儿不能耐受MTX 治疗时,可考虑MMF 联合糖皮质激素。
3.2 环磷酰胺(Cyclophosphamide,CTX)常作为标准免疫抑制剂和静注免疫球蛋白不能治疗重症JDM 时的升级治疗,特别是严重肌肉无力、溃疡性皮肤病变和器官受累,如胃肠道溃疡、间质性肺疾病和中枢神经系统受累[4]。由于CTX 起效快,免疫抑制作用强,常采用静脉冲击治疗,常用剂量8~12 mg·kg-1·d-1,每2周连用2d或每月1次0.50~0.75 g/m2[8],其主要副作用是:骨髓抑制、泌尿系损伤、肺纤维化等。一项56例接受CTX治疗的JDM 患者和144 例未接受CTX 治疗的JDM 患者的回顾性研究[21],表明CTX 治疗与全身疾病活动度、肌肉疾病活动度和皮肤病活动度的改善有关,且短期毒性作用并不显著。
3.3 他克莫司(Tacrolimus,TAC)由于抑制钙调神经磷酸酶活性的分子途径和药效学的不同,与CsA 相比,TAC 的药理作用强,半衰期长,更有优势[22]。TAC 主要用于难治性或合并间质性肺炎的JDM患儿。在3例接受TAC治疗的难治性JDM的病例报道中[23],3名患者的整体疾病活动性均降低,皮肤病变明显好转。同时有研究[24]表明TAC 对皮肌炎相关间质性肺疾病患者有效,可改善患者的肌肉力量和肺功能。目前关于他克莫司治疗JDM的病例有限,其治疗剂量多基于医师的经验性选择。
4 生物制剂
标准的免疫抑制疗法通常是间接的、非特异性的,但生物疗法可直接针对与疾病发病机制有关的免疫细胞或细胞因子,实现精准靶向治疗。当糖皮质激素及免疫抑制剂治疗无效或无法忍受其副作用被迫停止治疗时,生物制剂是合适的选择。
4.1 利妥昔单抗(Rituximab,RTX)是一种针对B细胞表面CD20抗原蛋白的嵌合单克隆抗体,表达于B淋巴细胞表面,可耗竭外周血B淋巴细胞。在RIM试验[25]中,将受试者(患难治性皮肌炎和多发性肌炎的成人及难治性JDM)随机分为早期RTX治疗组和晚期RTX 治疗组。在早期治疗组,患者在0 周和1周接受药物治疗,随后在8周和9周接受安慰剂治疗,而晚期治疗组相反。主要终点是比较达到国际肌炎评估和临床研究小组定义的改善(Definition Of Improvement,DOI)时间。虽然两组间的DOI时间无统计学差异,但83%患者在44周时达到预定的DOI值。此外,研究发现[26]JDM早期治疗组的DOI时间中位数比晚期治疗组早8 周,早期和晚期RTX 治疗组的大多数患者都能逐渐减少全身糖皮质激素的用量。
4.2 抗肿瘤坏死因子α(TNF-a)拮抗剂 包括如Infliximab等单克隆抗体,Etanercept等循环受体融合蛋白。在一项5例接受Infliximab治疗JDM的回顾性分析[27]中,所有合并钙质沉着症的顽固性JDM患者均出现了明显的临床改善(主要是肌肉无力、关节挛缩),可减缓钙质沉着症进展。而近几年报道了关于TNF-a抑制剂在治疗JDM的过程中出现多种不良反应,如治疗无效、出现皮肌炎和狼疮样综合征重叠现象等[28-29]。目前关于TNF-a拮抗剂治疗JDM效果不一,无法确定TNF-a 拮抗剂是否能够有效治疗JDM。
4.3 Abatacept 是一种人类IgG和第二信号介导物CTLA-4的融合蛋白,与抗原提呈细胞上的CD80和CD86结合,干扰T细胞活化发挥作用,对患严重溃疡性皮疹和钙质沉着症的JDM患者有效[30]。一项评估Abatacep对多肌炎和皮肌炎成年患者疾病活动性和肌肉活检特征影响的试验[31]中,使用abatacept治疗患者中近一半患者的疾病活动降低。在重复进行肌肉活检的患者中,Foxp3+Treg的数量增加表明其对肌肉病变具有积极的治疗作用。
4.4 JAK 抑制剂 Janus 激酶(JAKs)是一类在干扰素介导的细胞因子受体磷酸化激活过程中起关键作用的酶,JAK 抑制剂可以阻断JAKs 的活性,阻断多种细胞因子信号,包括干扰素和IL-6。在一项JAK 抑制剂治疗JDM 的研究[32]中显示,10 名接受JAK 抑制剂的JDM 患儿中半数实现了临床缓解,病情达到稳定,其中部分患儿的肌肉血管病变好转。
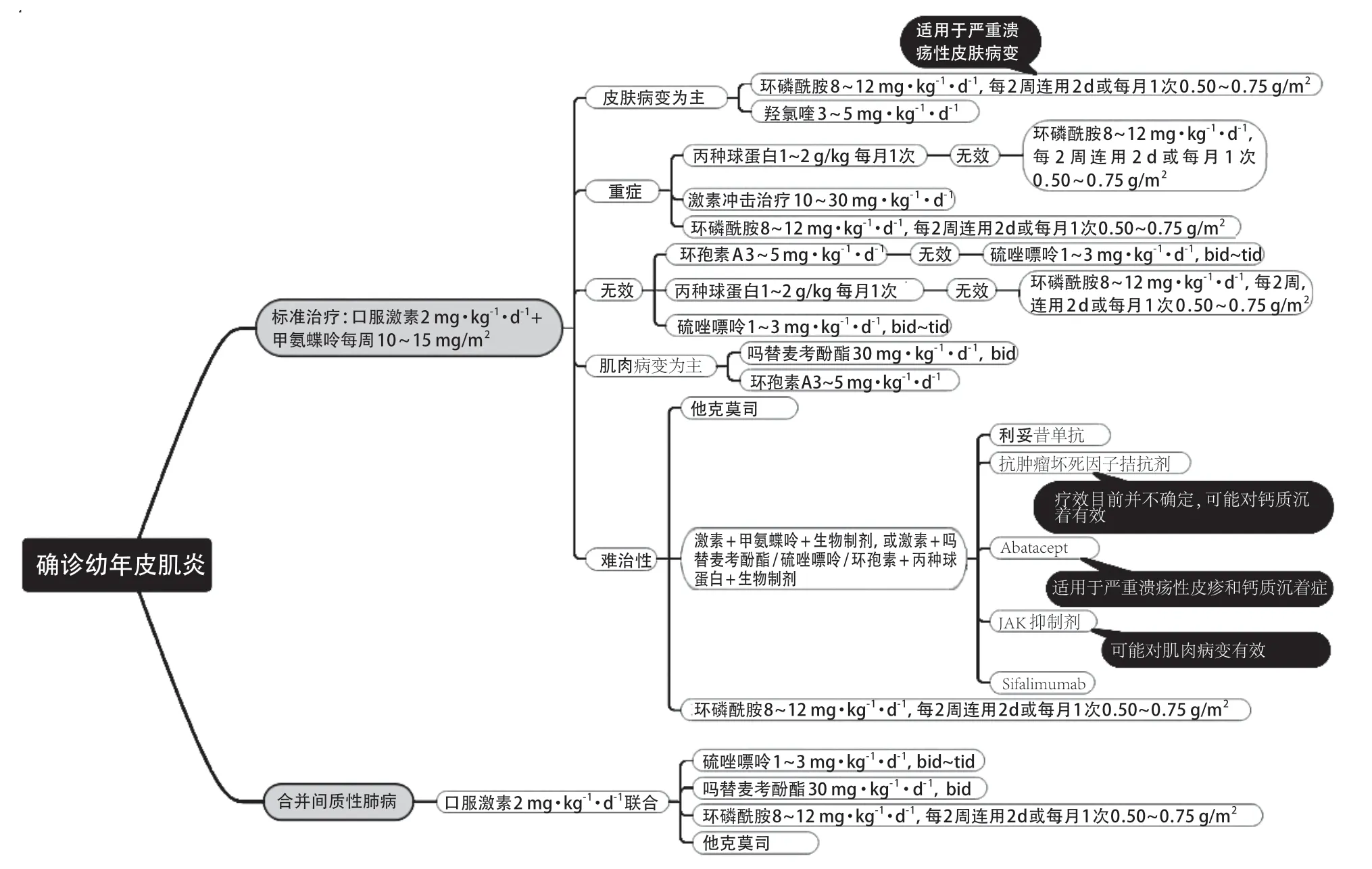
幼年皮肌炎的药物选择流程图
4.5 Sifalimumab 是一种抗干扰素α的单克隆抗体,抑制干扰素信号传导,改善临床症状。有研究表明JDM患者血液和肌肉中高水平表达的I型干扰素诱导基因与疾病活动性相关,提示干扰素介导的免疫调节在JDM 发病机制中起作用[33]。一项评估Sifalimumab对皮肌炎和多肌炎疗效的1b期随机、双盲、对照、多中心临床试验[34],Sifalimumab可降低血液和肌肉组织中的I型IFN基因标记,从而达到临床改善。目前关于Sifalimumab治疗JDM的疗效在国内并未有病例报道。
由于JDM本身发病率较低,生物制剂属于近年来新兴的治疗选择,因此缺少大样本的研究,无法对其疗效做出明确评价。目前生物制剂的选择及使用方式多基于临床医师的经验及个案的病例报道,希望能够进行多中心的、国际合作的随机试验来评估治疗反应。
5 展望
目前有文献[35]发现可根据肌炎特异性抗体(Myositis specific antibody,MSA)将JDM分成多个亚组,每个亚组都有特定的表型和预后,如最常见的抗p155/140阳性的患者更易表现出广泛的光敏性皮疹、溃疡、慢性病程和全身性脂肪营养不良;抗NXP 2 抗体与钙质沉着症和关节挛缩相关;抗MDA 5 抗体提示患间质性肺部疾病的风险增加,常伴有关节炎;抗Mi-2阳性患者表现出”典型的”JDM症状,对标准治疗反应良好,预后良好;抗t-RNA合成酶患者多表现出肌炎、间质性肺部疾病、发热、机械手、雷诺现象和关节炎,多发生在年长儿童中,死亡率较高。因此,我们希望通过对MSA 的检测,针对性地选择治疗方案,更快缓解病情,改善预后。

