产表面活性剂石油降解菌的筛选及其对石油烃的降解特性
孔萌 邢献杰 姜巧 彭明国 王晋 张文艺



摘 要:针对炼油厂含油废水处理过程中产生的“三泥”处置难题,从大庆油田含油污泥中分离出一株既产表面活性剂又能降解石油烃的菌株GJ,通过形态特征观察、生理生化试验及16S rDNA序列分析,鉴定菌株GJ为希瓦氏菌属(Shewanella sp.),将菌株GJ应用于浮渣和生化污泥的降解试验,探讨GJ对浮渣和生化污泥的降解动力学。对菌株产物进行提取纯化、薄层层析初步判断、红外光谱分析,证实GJ菌产物为糖脂类表面活性剂。浮渣和生化污泥降解试验中,第7天时菌株GJ对石油烃的降解率最高,分别达到81.11%和83.21%。Logistic生长模型、Luedeking-Piret模型和一级反应动力学模型可以很好地模拟GJ菌体生长、表面活性产物合成和对石油烃的降解过程。初步推断GJ菌以石油烃为碳源,在生长过程中分泌表面活性剂,打破油水界面,增大菌株与石油烃的接触程度,促进GJ菌对石油烃的摄取、代谢并进行自我增殖。
关键词:石油降解菌;含油污泥;表面活性剂;菌株
中图分类号:X703 文献标志码:A 文章编号:2096-6717(2022)04-0149-08
Screening and petroleum hydrocarbon degradation characteristics of petroleum degradation bacteria producing surfactant
KONG Meng1, XING Xianjie2, JIANG Qiao2, PENG Mingguo1, WANG Jin1, ZHANG Wenyi1
(1. School of Environmental & Safety Engineering, Changzhou University, Changzhou 213164, Jiangsu, P. R. China; 2. Jinling Branch of China Petroleum & Chemical Corporation, Nanjing 210033, P. R. China)
Abstract: In order to solve the problem of "three sludges" in the treatment of oily wastewater from oil refinery, a strain GJ was isolated from the oily sludge of Daqing Oilfield, which can produced surfactant and degraded petroleum hydrocarbon. Through morphological observation, physiological and biochemical experiments and 16S rDNA sequence analysis, the strain GJ was identified as Shewanella sp.. The strain GJ was applied to the degradation experiment of scum and biochemical sludge, and the degradation kinetics of scum and biochemical sludge by GJ was discussed. After extraction and purification, TLC and FTIR analysis, it was confirmed that GJ product was a glycolipid surfactant. In the experiment of scum and biochemical sludge degradation, the degradation rate of petroleum hydrocarbon reached the highest, which was 81.11% and 83.21% respectively at the 7th day of strain GJ. Logistic growth model, Luedeking-Piret model and first-order reaction kinetics model can well simulate the growth of GJ cell, the synthesis of surface active products and the degradation of petroleum hydrocarbons. It is preliminarily inferred that GJ bacteria take petroleum hydrocarbon as carbon source, and secrete surfactant at the oil-water interface during the growth process, increase the contact degree between the strain and petroleum hydrocarbon, and promote the uptake and metabolism of petroleum hydrocarbon by GJ bacteria and self proliferation of GJ bacteria.
Keywords:petroleum degradation bacteria; oily sludge; surfactant; bacteria
随着工业化的迅速发展,石油的需求量大大增加,在石油开采、运输、储存等过程中,产生了大量的含油污泥。炼油厂在处理含油废水时产生的生化污泥、池底污泥和浮渣统称为“三泥”。炼油厂“三泥”主要是指由石油烃类、胶质、沥青质、泥沙、无机絮体、有机絮體以及水和其他有机物、无机物牢固黏结在一起的稳定乳化体系[1],对土壤、地表水和地下水构成重大威胁,油气挥发更会影响空气质量。基于“三泥”对于环境的恶劣影响,含油污泥的无害化处理迫在眉睫。
目前,炼油厂“三泥”的处理方法主要有物理法、化学法和生物法[2],其中,微生物修复技术由于成本低、效果好和无二次污染等特点受到广泛关注[3]。但石油烃的疏水性阻隔了其与微生物的接触,会在一定程度上减少微生物的修复效果[4]。为解决这一问题,往往会添加表面活性剂以起到增溶作用,由于其分子结构同时存在极性亲水基(如羟基、酰胺基、醚键等)和非极性疏水基(如烃链等),因此,具有一定的表面活性,能有效降低水溶液的表面张力[5],从而增大微生物与石油的接触程度,提高微生物降解效率[6]。其中,化学表面活性剂易产生二次污染和生物毒性,无法成为理想的表面活性添加剂。在一定条件下,部分微生物能代谢出一种次级产物表面活性剂[7],因此,对于具有产生表面活性剂性能的石油降解菌的筛选及研究成为石油污染修复中的热点[8]。曹迪等[9]筛选出了具有高效降解石油烃能力和产生表面活性剂能力的菌株,在20 ℃下,第8天对石油烃的降解率可达64.98%。Zhou等[10]从油污土壤中分离出一株芽孢杆菌,发现其产生的脂肽类表面活性剂具有显著的降低表面张力和乳化性能。周敏等[11]筛选出了产脂肽类阴离子表面活性剂石油降解菌,试验结果发现,生物表面活性剂不仅可提高乳化性能,还可以促进石油降解菌的生长,提高石油降解率。笔者筛选得到的希瓦氏菌运用于石油降解的案例较少,刘芳明[12]曾筛选到一株南极低温降解菌NJ49,但与笔者研究不同的是,刘芳明并未证实其具有产生表面活性剂的特性。
笔者采用微生物法降解生化污泥和浮渣,从大庆油田含油污泥中筛选出4株菌,仅一株具有产表面活性剂的性能,命名为GJ,鉴定此产表面活性剂菌为希瓦氏菌属(Shewanella sp.),并对其产物进行提取鉴定,分别运用Logistic模型、Luedeking-Piret模型和一级动力学模型对菌体生长、产物合成和降解石油过程进行动力学分析,进一步推断GJ降解石油烃的作用机制。
1 材料与方法
1.1 样品来源
菌株筛选自大庆油田的含油污泥。两种含油污泥来自南京金陵石化,分别为浮渣和生化污泥,其中,浮渣的含水率为57.14%,含油率为16.28%,含渣率为26.58%;生化污泥含水率为35.03%,含油率为8.50%,含渣率为56.47%。
1.2 培养基配方
肉汤蛋白胨培养基(LB)[13]用于分离纯化菌株;固体培养基是在LB基礎上加20 g/L琼脂粉;无机盐培养基[14]用来降解含油污泥,由NaCl 1 g、(NH4)2 SO4 4 g、K2HPO4 4 g、KH2PO4 4 g、MgSO4·7H2O 0.2 g、微量元素 1 mL(CaCl2·2H2O 1 g、FeSO4·7H2O 1 g、EDTA 1.4 g)加蒸馏水至1 L,pH值调至6.5,121 ℃灭菌20 min;血平板培养基由酪蛋白胰酶消化物10.0 g、心胰酶消化物3.0 g、玉米淀粉1.0 g、琼脂14.0 g、肉胃酶消化物5.0 g、酵母浸出粉5.0 g、氯化钠5.0 g、羊血70 mL加蒸馏水至1 L配制而成,所用血平板培养基购于江门市凯林贸易有限公司。
1.3 产表面活性剂菌的筛选和鉴定
1.3.1 产表面活性剂石油降解菌的筛选
血平板筛选:取1 μL菌液滴在血平板上,25 ℃培养48 h,观察菌落周围是否有溶血圈[15]。
油扩散法测定排油活性:在直径9 cm的培养皿中倒入30 mL蒸馏水,滴入1 mL液体石蜡,待水面形成油膜后,向油膜中央滴入10 μL发酵液,测量排油圈直径[16]。
乳化性能表征:向比色管中加入3 mL正己烷和2 mL发酵液,剧烈晃动60 s后静置24 h,观察乳化层高度[17]。
1.3.2 菌种鉴定
1)生理生化鉴定:观察菌落的形态特征,参照《伯杰氏细菌分类鉴定手册》对细菌进行生理生化试验鉴定[18]。
2)菌株16S rDNA的鉴定:采用上海生工E2up柱式细菌基因组DNA提取试剂盒提取菌株的基因组DNA,并进行1%琼脂糖凝胶电泳检测。委托上海生工生物工程技术服务有限公司完成PCR产物纯化及测序。
1.3.3 表面活性剂的分离与提纯
将培养3 d的发酵液置于离心机中,以4 ℃、8 000 r/min的条件离心20 min,去除菌体。用6 mol/L HCl将上清液pH值调节为2.0,于4 ℃冰箱中静置24 h,观察是否有沉淀。如有沉淀,则表面活性剂可能有脂肽、脂蛋白存在;如无沉淀,则有可能存在糖脂[19]。取上清液加入等体积的乙酸乙酯、甲基叔丁基醚、V氯仿∶V甲醇=2∶1、V氯仿∶V甲醇=1∶1,萃取2次,有机相合并并用无水NaSO4干燥,45 ℃旋转蒸发,得到的浅黄色浓稠物即为表面活性剂粗产物[20]。
将粗产物溶于0.05 mol/L的NaHCO3溶液中,过滤不溶杂质,用6 mol/L HCl调节pH值至2.0,置于离心机中,以4 ℃、9 000 r/min的条件离心15 min,收集沉淀,40 ℃烘干后即为纯化表面活性剂。
1.3.4 生物表面活性剂的鉴定
薄层层析(TLC):取0.2 g上述粗产物溶于1 mL氯仿中,点样于硅胶G板,展开剂为三氯甲烷/甲醇/水(65/15/2,V∶V),用不同的显色剂显色。
1)苯酚硫酸显色剂:3 mL苯酚与5 mL浓硫酸溶于95 mL乙醇中,若显棕色斑点即存在糖脂,反之,无糖脂存在。
2)茚三酮显色剂:0.5 g茚三酮溶于100 mL丙酮中,若显红色斑点即存在脂肽,反之,无脂肽存在。
3)钼酸铵高氯酸显色剂:40 mg溴百里香酚蓝溶于100 mL 0.01%的NaOH溶液中,若显蓝紫色斑点即存在磷脂或类脂,反之,无磷脂或类脂存在[21-22]。
红外光谱扫描分析(FT-IR):采用KBr压片法将上述纯化后的表面活性剂混合压成透明薄片后,使用红外光谱扫描分析测定[23]。
1.4 产表面活性剂生长动力学
取0.5 mL菌液培养至OD600为1,按5%的接种量接种至9.5 mL新配制的LB中,置于50 mL离心管中,纱布封口,置于振荡培养箱以25 ℃、150 r/min的条件培养,从第2小时开始每隔2 h取样,以空白培养基为参比,测量600 nm波长处的OD值[24]。
Logistic模型常用作描述有限环境下生物种群的S型增长[25],使用Logistic方程拟合菌体生长曲线,见式(2)。
式中:y为x时刻的菌株细胞密度(OD600);x为菌株生长时间,h;a为菌株最大浓度;k为细菌生长瞬时速率,h-1;b为模型参数。
1.5 表面活性剂合成动力学
使用Luedeking-Piret方程拟合菌体合成分泌表面活性剂的过程,见式(3)。
式中:P为表面活性剂产量,g/L;m1为非生长相关产物形成参数;m2为生长相关产物形成参数;X为最大细胞浓度(OD600);t为发酵时间,h。
当m1=0、m2≠0时,产物形成于菌体生长阶段,为生长偶联型,产物直接来源于产能的初级代谢;当m1≠0、m2≠0时,产物形成于生长期和稳定期,产物形成与细胞生长部分偶联;当m1≠0、m2=0时,产物形成与细胞生长无关。
1.6 产表面活性剂菌对生化污泥的降解动力学
以5%的接种量将种子液接入19 mL降解培养基中,再加入0.1 g经研磨并过100目筛的均质化含油污泥,置于振荡培养箱中以150 r/min、25 ℃条件降解7 d,并设置3个平行对照,运用红外测油仪测定含油量,每天1次[26]。降解率由式(4)计算得到。
式中:w1为降解后测定含油量,mg;w2为降解前测定的含油量,mg。
对生化污泥和浮渣进行降解,通过动力学曲线来比较降解过程中的变化,一级反应方程式见式(5)。
式中:S为含油污泥t时刻的含油率,%;t为时间,d;k为一级反应速率常数,d-1;S0为含油污泥初始含油率,%。
2 结果与讨论
2.1 产表面活性剂菌的筛选和鉴定
2.1.1 产表面活性剂菌的分离纯化
从大庆油田含油污泥中分离纯化出4株产表面活性剂菌,用血平板进行初筛后,获得1株菌在血平板上产生明显溶血圈,命名为GJ,但血平板溶血现象也有可能由产溶血酶菌产生,易混淆[27],还需进一步鉴定,因此,保留另外3株排油直径大于3 cm的菌株,分别命名为CJ、BJ、TJ,以进行进一步研究。
表1是油扩散法和乳化性能复筛结果。由表1可以发现,GJ的排油活性及乳化性能明显高于其他菌株,因此,选择GJ作为目标菌株。观察菌株培养特征和形态特征,GJ菌落较大,为扁平、光滑、半透明、淡粉色菌落。其部分生理生化特性见表2。
通过测序,获得的序列输入Gene Bank后,利用BLAST对比分析同源性并绘制系统发育树。如图1所示,GJ菌在分子系统发育分类上属于希瓦氏菌属(Shewanella sp.),与GJ最近缘的菌株是Shewanella putrefaciens strain FDAARGOS_681 (CP046329.1:771993-773358),核苷酸同源性为100%。
2.1.2 产表面活性剂菌生长动力学、产物合成动力学
图2为GJ菌株的生长动力学模型。由图2可知,GJ菌在46 h时菌浓度达到最大。2 h后进入对数生长期,此时营养充足,生长迅速;28 h后进入稳定期,由于前期长势迅猛,营养物质消耗较快,46 h后便进入衰亡期[28]。
利用Origin 9.0软件,根据试验数据对Logistic方程进行非线性拟合,求解方程中的参数,a为1.580 5,b为6.959 8,k为0.144 9,此模型的拟合程度良好(R2=0.971 8),说明Logistic模型可以较好地描述GJ菌体生长的情况。
根据GJ菌株生长曲线和表面活性剂产量曲线的变化趋势,发现生长期和稳定期都在进行表面活性剂的合成,此过程为部分生长偶联型。因此,Luedeking-Piret方程可变为
如图2所示,将P与X进行线性拟合,得到P=0.120 5X-0.481 0,R2=0.984 8。
2.2 表面活性剂的提取、纯化及鉴定
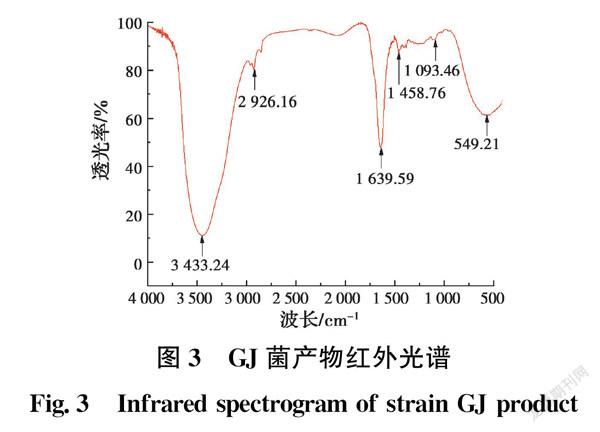
发酵液离心后所得上清液用6 mol/L HCl调节pH值至2.0,置于4 ℃冰箱中静置24 h后未产生沉淀,说明产物中没有脂肽、脂蛋白存在,初步鉴定产生的表面活性剂为糖脂类物质。薄层层析分析显示,GJ菌产物在苯酚硫酸显色剂下显棕色,加入其他显色剂均无明显变化。这说明GJ菌主要产糖脂类表面活性剂,不产生或者产生较少的脂肽类、磷脂类物质。将GJ菌株产物提纯,用红外光谱仪分析物质结构,结果见图3。3 433.24 cm-1波段吸收峰为—OH伸缩振动;2 926.16 cm-1处的吸收峰为糖类分子中C—H键的伸缩振动,表明产物中含饱和脂肪链;1 639.59 cm-1处是C=O双键的伸缩振动,表明存在饱和脂肪链;1 458.76 cm-1处为脂肪族肽链上C—H键的变角振动吸收峰,—CH3和—CH2表明存在烷烃的链状结构;1 093.46 cm-1处的吸收峰归属于C—O—C键的伸缩振动,为酯类吸收峰,说明分子中存在一个五元環内酯结构和糖苷键,进一步证实了GJ菌的产物为糖脂类表面活性剂。
2.3 产表面活性剂菌对含油污泥的降解动力学
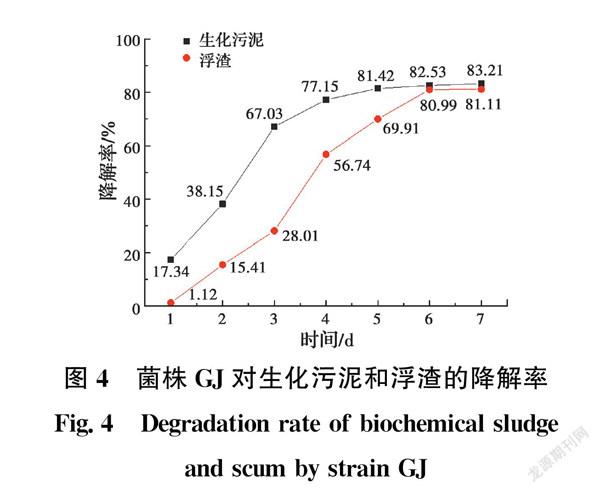
在降解培养基中将GJ分别用于降解浮渣和生化污泥,每天测定菌株对含油污泥的降解率。如图4所示,GJ对浮渣和生化污泥均有较好的降解效果,浮渣的最终降解率为81.11%,生化污泥的降解率最终达到83.21%。GJ对生化污泥的降解速率呈先快后慢的状态,对浮渣则呈先慢后快的状态。推测GJ在含油量较低的环境下代谢更加活跃,能在较短时间内合成分泌出表面活性剂。而处于含油量较高的环境中时,由于含油污泥稳定的油包水或水包油结构,微生物与石油烃间存在油水界面,导致微生物难以摄取石油烃作为碳源供给自身代谢,需要更长时间来适应较高含油量的环境。之后分泌表面活性剂增大含油污泥乳化程度,从而增大微生物与石油烃的接触程度,进一步对石油烃进行摄取和分解,最终达到降低含油量的目的。
图5为菌株GJ降解生化污泥和浮渣过程中污泥含油率的变化,含油量逐渐减少,基本呈由慢到快再变慢的状态,最终菌株GJ降解后的生化污泥含油率为1.61%,浮渣含油率为2.73%。
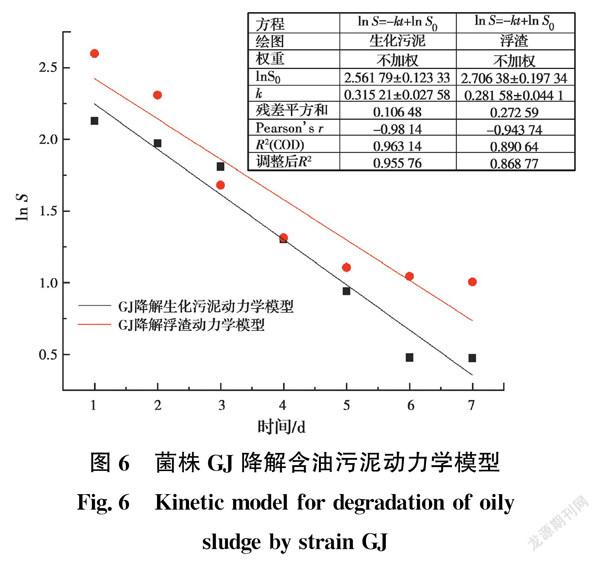
图6为ln S与t的拟合结果。根据石油烃降解一级反应动力学拟合结果可知,菌株GJ降解生化污泥的一级动力学方程为S=e-0.315 2t+2.561 8;降解浮渣的一级动力学方程为S=e-0.281 6t+2.706 4。此外,一级动力学模型曲线与菌株GJ降解过程中生化污泥和浮渣含油量的变化拟合度较好,菌株GJ降解生化污泥和浮渣动力学模型的相关系数分别为R2=0.963 1和R2=0.890 6。在降解含油污泥过程中,菌株GJ对含油污泥的降解变化基本遵循一级反应动力学。
2.4 产表面活性剂菌降解含油污泥机理分析
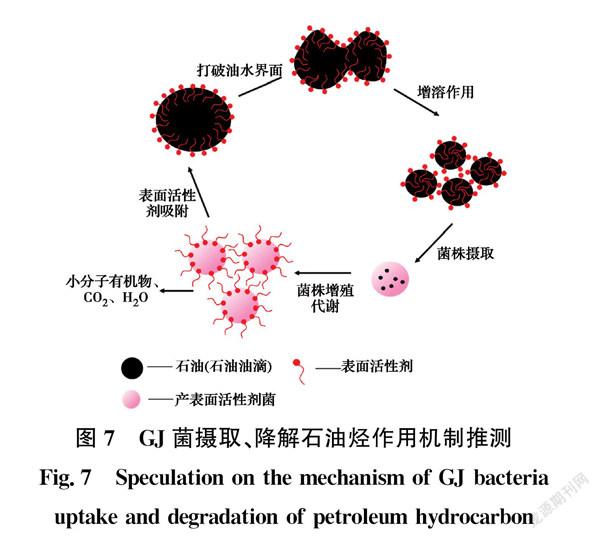
表面活性剂在产表面活性剂菌降解石油烃的过程中有重要作用,含油污泥是稳定的油包水或水包油的乳化体系,微生物与石油烃之间存在稳定的油水界面,导致微生物能接触到的石油烃十分有限,因此,以石油烃为唯一碳源的产表面活性剂菌能摄取到的石油烃极少,这也是产表面活性剂菌在降解初期效率较低的主要原因。产表面活性剂菌生长代谢过程中合成分泌出表面活性剂并排到胞外,打破油水界面,与石油烃进行增溶反应,大幅增加微生物与石油烃的接触程度,从而能摄取石油烃并进行解离,通过活动代谢最终转化为小分子有机物、CO2和H2O[29-30],同时,又继续合成分泌出表面活性剂,整个过程循环进行,这也是降解中期效果明显的原因。GJ菌摄取、降解石油烃的作用机制如图7所示。
3 结论
1)从大庆油田含油污泥中筛选出1株既产表面活性剂又能降解石油烃的菌株GJ,为革兰氏阴性菌,属于希瓦氏菌属(Shewanella sp.),菌株GJ呈“S”型生长,能与Logistic生长方程较好拟合。
2)薄层层析法和红外光谱分析鉴定GJ的产物中存在一个五元环内酯结构和糖苷键,证明GJ的产物为糖脂类表面活性剂。运用Luedeking-Piret方程拟合菌体合成分泌表面活性剂的情况,所得动力学方程可较好地模拟GJ分泌表面活性剂的过程。GJ对浮渣和生化污泥中的石油烃均有较好的降解效果,降解率分别为81.11%和83.21%,降解动力学均符合一级反应动力学方程式。
3)初步推断GJ菌摄取、降解石油烃的作用机制为:菌株GJ是以石油烃作为碳源的微生物,在生长过程中分泌次级产物为表面活性剂,表面活性剂打破油水界面,增大菌株与石油烃的接触程度,从而能摄取石油烃并进行解离,促进对石油烃的摄取、代谢及增殖。代谢产物最终转化为小分子有机物、CO2和H2O,同时,又继续合成分泌出新的表面活性物质,整个代谢过程循环进行。
参考文献:
[1] 郑祥林. 含油污泥无害化处理技术研究[J]. 化工设计通讯, 2020, 46(4): 176,207.
ZHENG X L. Study on harmless treatment technology of oily sludge [J]. Chemical Engineering Design Communications, 2020, 46(4): 176,207. (in Chinese)
[2] 侯影飞, 黄朝琦, 秦志文, 等. 含油污泥处理技术研究进展[J]. 当代化工, 2020, 49(3): 631-637.
HOU Y F, HUANG Z Q, QIN Z W, et al. Research progress of oily sludge treatment technology [J]. Contemporary Chemical Industry, 2020, 49(3): 631-637. (in Chinese)
[3] 徐金蘭, 黄廷林, 唐智新, 等. 高效石油降解菌的筛选及石油污染土壤生物修复特性的研究[J]. 环境科学学报, 2007, 27(4): 622-628.
XU J L, HUANG T L, TANG Z X, et al. Isolation of petroleum degradation bacteria and its application to bioremediation of petroleum-contaminated soil [J]. Acta Scientiae Circumstantiae, 2007, 27(4): 622-628. (in Chinese)
[4] 文炜涛, 王新伟, 蔡婷, 等. 脂肽生物表面活性剂作用下多菌种石油生物降解影响因素优化[J]. 环境工程学报, 2018, 12(12): 3520-3530.
WEN W T, WANG X W, CAI T, et al. Factors optimization for multi-strain biodegradation of petroleum under the effect of surfactin [J]. Chinese Journal of Environmental Engineering, 2018, 12(12): 3520-3530. (in Chinese)
[5] GOGOI B K, DUTTA N N, GOSWAMI P, et al. A case study of bioremediation of petroleum-hydrocarbon contaminated soil at a crude oil spill site [J]. Advances in Environmental Research, 2003, 7(4): 767-782.
[6] ABALOS A,VIAS M, SABAT J, et al. Enhanced biodegradation of casablanca crude oil by a microbial consortium in presence of a rhamnolipid produced by pseudomonas aeruginosa AT10 [J]. Biodegradation, 2004, 15(4): 249-260.
[7] BARATHI S, VASUDEVAN N. Utilization of petroleum hydrocarbons by Pseudomonas fluorescens isolated from a petroleum-contaminated soil [J]. Environment International, 2001, 26(5/6): 413-416.
[8] 倪妮, 宋洋, 王芳, 等. 多環芳烃污染土壤生物联合强化修复研究进展[J]. 土壤学报, 2016, 53(3): 561-571.
NI N, SONG Y, WANG F, et al. A review of researches on intensified bio-remediation of polycyclic aromatic hydrocarbons contaminated soils [J]. Acta Pedologica Sinica, 2016, 53(3): 561-571. (in Chinese)
[9] 曹迪, 单荣, 刘安娜, 等. 产表面活性剂石油降解菌的筛选及其降解率的测定[J]. 黑龙江八一农垦大学学报, 2019, 31(1): 61-67.
CAO D, SHAN R, LIU A N, et al. Screening of oil-degrading bacteria with production surfactant and the determination of degradation rates [J]. Journal of Heilongjiang Bayi Agricultural University, 2019, 31(1): 61-67. (in Chinese)
[10] ZHOU H C, CHEN J X, YANG Z, et al. Biosurfactant production and characterization of Bacillus sp. ZG0427 isolated from oil-contaminated soil [J]. Annals of Microbiology, 2015, 65(4): 2255-2264.
[11] 周敏, 陈吉祥, 杨智, 等. 芽孢杆菌ZG0427表面活性剂性质及对石油降解菌的作用[J]. 安全与环境学报, 2017, 17(6): 2376-2381.
ZHOU M, CHEN J X, YANG Z, et al. Characterization and its effect on oil-degradation bacteria of biosurfactants produced by a Bacillus sp. ZG0427 [J]. Journal of Safety and Environment, 2017, 17(6): 2376-2381. (in Chinese)
[12] 刘芳明. 南极海洋石油烃低温降解菌的筛选、鉴定及其低温降解特性研究[D]. 山东 青岛:国家海洋局第一海洋研究所, 2008.
LIU F M. Screening, identification and low-temperature degradation characteristics study of cold-adapted petroleum hydrocarbon-degrading bacteria isolated from antarctic sea [D]. Qingdao, Shandong: The First Institute of Oceanography, State Oceanic Administration, 2008 (in Chinese).
[13] 高鹏飞, 刘虹, 丛唯一, 等. 石油烃降解菌株的复配及其降解特性研究[J]. 安全与环境工程, 2019, 26(6): 108-113.
GAO P F, LIU H, CONG W Y, et al. Composition of petroleum hydrocarbon degrading strains and their degradation characteristics [J]. Safety and Environmental Engineering, 2019, 26(6): 108-113. (in Chinese)
[14] 陈玉琳, 刘秋, 于基成, 等. 海洋石油降解菌AH07的分离鉴定及其石油降解性能分析[J]. 微生物学杂志, 2020, 40(1): 32-36.
CHEN Y L, LIU Q, YU J C, et al. Isolation and identification of marine petroleum degradable bacterium AH07 and its degradation performance characteristics [J]. Journal of Microbiology, 2020, 40(1): 32-36. (in Chinese)
[15] 張娜, 郑青松, 刘玲, 等. 产表面活性剂石油降解菌的筛选及发酵条件优化[J]. 南京农业大学学报, 2011, 34(4): 133-137.
ZHANG N, ZHENG Q S, LIU L, et al. Isolation of oil-degrading bacteria with biosurfactant production and its fermentation condition optimization [J]. Journal of Nanjing Agricultural University, 2011, 34(4): 133-137. (in Chinese)
[16] 毕思宁, 王彦杰, 左豫虎. 生物表面活性剂排油圈检测方法的改进和应用[J]. 黑龙江八一农垦大学学报, 2009, 21(6): 58-60.
BI S N, WANG Y J, ZUO Y H. Improvement and application of oil spreading to detect biosurfactant [J]. Journal of Heilongjiang Bayi Agricultural University, 2009, 21(6): 58-60. (in Chinese)
[17] BHARALI P, DAS S, KONWAR B K, et al. Crude biosurfactant from thermophilic Alcaligenes faecalis: Feasibility in petro-spill bioremediation [J]. International Biodeterioration & Biodegradation, 2011, 65(5): 682-690.
[18] 廖延雄. 《伯杰氏鉴定细菌学手册》与《伯杰氏分类细菌学手册》[J]. 微生物学通报, 1992, 19(4): 249.
LIAO Y X. Berger’s Handbook of Identification Bacteriology and Berger’s Handbook of Classification Bacteriology [J]. Microbiology, 1992, 19(4): 249. (in Chinese)
[19] 邓振山, 马琳, 张袭, 等. 1株产表面活性剂石油降解菌筛选及发酵条件优化[J]. 西北大学学报(自然科学版), 2017, 47(4): 545-551.
DENG Z S, MA L, ZHANG X, et al. Isolation of oil-degrading bacteria with biosurfactant production and its fermentation condition optimization [J]. Journal of Northwest University (Natural Science Edition), 2017, 47(4): 545-551. (in Chinese)
[20] 赵东维. 生物表面活性剂产生菌对石油的降解及对石油烃的增溶作用研究 [D]. 山东 青岛: 中国海洋大学,2013.
ZHAO D W. Study on the oil degradation by biosurfactant producing bacteria and the solubilization of petroleum hudrocarbons [D].Qingdao, Shandong: Chinese Marine University, 2013 (in Chinese).
[21] 杨利娟. 表面活性剂产生菌及石油烃降解菌在石油烃降解中的作用 [D]. 广东 汕头: 汕头大学,2008.
YANG L J. Role of surfactant producing bacteria and petroleum hydrocarbon degrading bacteria in petroleum hydrocarbon degradation [D]. Shantou, Guangdong: University of Shantou, 2008. (in Chinese).
[22] 张娜, 隆小华, 刘兆普, 等. 石油降解菌X-1所产表面活性剂的研究[J]. 天然产物研究与开发, 2012, 24(3): 389-392.
ZHANG N, LONG X H, LIU Z P, et al. Biosurfactant produced by oil-degrading bacteria X-1 [J]. Natural Product Research and Development, 2012, 24(3): 389-392. (in Chinese)
[23] 徐鑫, 刘娅, 杨丽. 生物表面活性剂产生菌的筛选·鉴定及其目标产物结构分析[J]. 安徽农业科学, 2015, 43(12): 203-204,244.
XU X, LIU Y, YANG L. Screening of biosurfactant-producing bacterial strain, identification and structural analysis of the target product [J]. Journal of Anhui Agricultural Sciences, 2015, 43(12): 203-204,244. (in Chinese)
[24] 杨启瑞, 范红兵. 微生物生长曲线测定方法的改进[J]. 微生物学研究与应用, 1991(4): 23-25.
YANG Q R, FAN H B. Improvement of the method for determination of microbial growth curve [J]. Microbiology Research and Application, 1991(4): 23-25. (in Chinese).
[25] 陈泽慧, 高志伟, 董小娜, 等. 藻毒素降解菌CQ5对MC-LR粗提液的降解动力学[J]. 环境化学, 2018, 37(1): 82-88.
CHEN Z H, GAO Z W, DONG X N, et al. Degradation kinetics of MC-LR crude extracts by strain CQ5 [J]. Environmental Chemistry, 2018, 37(1): 82-88. (in Chinese)
[26] 徐薇薇, 郭平, 林建國. 低温胁迫下产生物表面活性剂的海洋石油降解菌性能[J]. 科学技术与工程, 2019, 19(23): 32-35.
XU W W, GUO P, LIN J G. Characterization of biosurfactant-producing and petroleum degrading bacteria under low temperature stress [J]. Science Technology and Engineering, 2019, 19(23): 32-35. (in Chinese)
[27] JAIN D K, COLLINS-THOMPSON D L, LEE H, et al. A drop-collapsing test for screening surfactant-producing microorganisms [J]. Journal of Microbiological Methods, 1991, 13(4): 271-279.
[28] 苏琼, 江子骏. 高效苯酚降解菌的筛选及其降解特性分析[J]. 湖北大学学报(自然科学版), 2019, 41(6): 567-571.
SU Q, JIANG Z J. Screening and degrading property of highly effective phenol degrading bacterium strain [J]. Journal of Hubei University (Natural Science), 2019, 41(6): 567-571. (in Chinese)
[29] 贾凌慧, 郑世浩, 孙丽慧, 等. 石油降解低温细菌的筛选及降解特性的表征[J]. 环境工程, 2020, 38(6):252-258.
JIA L H, ZHENG S H, SUN L H, et al. Screening of cold-adapted petroleum degrading bacteria and characterizing microflora for petroleum degradation [J]. Environmental Engineering, 2020, 38(6):252-258.(in Chinese)
[30] 王卫强, 崔静, 吴尚书, 等. 石油烃降解菌Pseudomonas sp.及其生物表面活性剂对原油处理效果分析[J]. 石油学报(石油加工), 2020, 36(5): 1039-1046.
WANG W Q, CUI J, WU S S, el al. Effect of petroleum hydrocarbon decomposing bacteria Pseudomonas sp. and its biosurfactants on crude oil treatment [J]. Acta Petrolei Sinica (Petroleum Processing Section), 2020, 36(5): 1039-1046. (in Chinese).
(编辑 黄廷)
收稿日期:2020-08-23
基金项目:中国石化总公司科技计划(318024-5)
作者简介:孔萌(1996- ),女,主要从事环境微生物研究,E-mail:614328886@qq.com。
张文艺(通信作者),男,博士,教授,E-mail:zhangwenyi888@sina.com。
Received:2020-08-23
Foundation items:Science and Technology Project of Sinopec Corporation (No. 318024-5)
Author brief:KONG Meng (1996- ), main research interest: environmental microorganism, E-mail: 614328886@qq.com.
ZHANG Wenyi (corresponding author), PhD, professor, E-mail: zhangwenyi888@sina.com.

