红土镍矿浸出液萃取分离钴镍的研究
*王嘉萱 刘志慧 戴梦秋 张彩霞
(江西理工大学材料冶金化学学部 江西 341000)
我国镍矿资源中,硫化铜镍矿占比86%,红土镍矿占比9.6%,其他镍矿占比4.4%。2000年之前,金属镍的产出主要来源于硫化镍矿,但随着时代的发展,硫化镍矿消耗不断增加,资源储量不断减少,矿石品位不断降低,于是人们开始寻求新的镍矿资源,红土镍矿便成为人们新的选择。到2020年为止,世界镍资源的产出中,红土镍矿占比已经高达60.14%[1-7],说明红土镍矿资源将变为镍资源产出的主要部分。我国经济正处于高速发展阶段,镍的需求量不断增加,因此,红土镍矿的合理开发和充分利用变得尤为重要。
1.原料和方法
(1)实验原料和仪器
P507、N235、磺化煤油,购于郑州和成新材料科技有限公司;氢氧化钠、氯化钠、盐酸、硫氰酸铵、过硫化氨、丙酮、冰醋酸、丁二酮肟等购于西陇科学股份有限公司;六水合硫酸镍购于天津市光复化学试剂厂;七水合氯化钴购于上海麦克林生化科技有限公司。以上试剂均为分析纯。
紫外可见分光光度计765N,上海佑科仪器仪表有限公司;电子分析天平FA2004,上海沪粤明科学仪器有限公司。
(2)实验方法
根据红土镍矿硫酸高压酸浸工艺中,浸出液中钴镍浓度比例[8-10],配制0.20mol/L镍(Ⅱ)离子溶液和0.02mol/L的钴(Ⅱ)离子溶液,盐酸调节溶液的pH,NaCl调节Cl-浓度为0.20g/mL。采用P507-N235混合萃取剂,磺化煤油为稀释剂。萃取剂浓度以萃取剂在有机相中所占的体积分数计算。用移液枪向60mL分液漏斗中量取适量待萃溶液和配制好的萃取剂,在室温下采用人工振荡的方式进行萃取。静置一段时间分液,分液后移取一定量的萃余液,稀释后用紫外可见分光光度计分析萃余液中镍(Ⅱ)、钴(Ⅱ)的浓度。按 式(1)计算钴镍的分离程度:

(3)分析方法
向50ml容量瓶中加入萃余相液体1.00mL,定容。通过比色法分别测量其中钴镍的含量。
萃余液中镍的测定比色法:取50mL容量瓶,加入定容后溶液1.00mL,加入4.00mL 20%氢氧化钠溶液、5.00mL 5%过硫酸氨溶液、5.00mL 1%丁二酮肟试剂静置显色后,加入去离子水定容,利用紫外可见分光光度计测定镍(Ⅱ)离子吸光度,波长435nm,用比色皿取适量样品进行检测即可。
萃余液中钴的测定比色法:取50mL容量瓶,加入定容后溶液5.00mL,加入5.00mL冰醋酸、30.00mL丙酮、0.50g NH4SCN,加入去离子水定容,利用紫外可见分光光度计测定钴(Ⅱ)离子吸光度,波长620nm,用比色皿取适量样品进行检测即可。
(4)紫外可见吸收光谱分析
①镍(Ⅱ)离子标准曲线
用移液枪量取0.01mg/L镍标准溶液2.00mL、4.00mL、6.00mL、8.00mL、10.00mL于5个50mL的容量瓶中,各加入4.00mL 1mol/L NaOH溶液、5.00mL 5%过硫酸氨溶液、5.00mL 1%丁二酮肟溶液,静置一段时间后显色,加入去离子水定容至刻度,摇晃均匀,吸取部分溶液加入至比色皿中,以去离子水为参比溶液,在上述最大吸收波长下以吸光度为纵坐标,镍离子浓度(μg/mL)为横坐标,绘制镍离子标准曲线。硫酸镍的含量与吸光度之间具有线性关系。
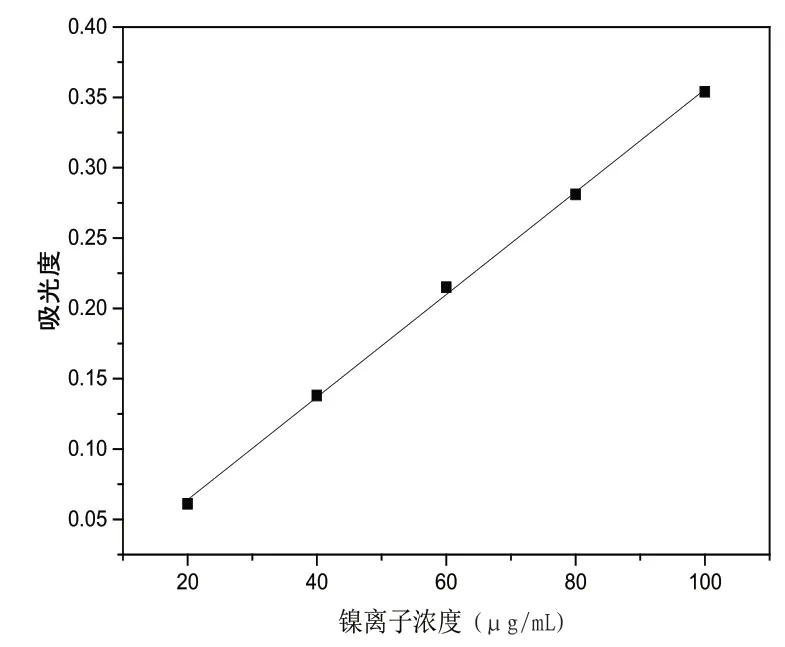
图1 镍(Ⅱ)离子标准曲线
由图1可知,镍(Ⅱ)离子吸收曲线的回归方程如式(2)所示:
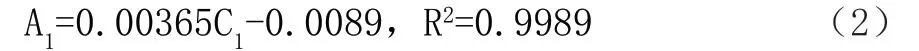
式中,A1代表吸光度;C1代表镍(Ⅱ)离子浓度。
②钴(Ⅱ)离子标准曲线
用移液枪量取0.10mg/L钴标准溶液2.00mL、4.00mL、6.00mL、8.00mL、10.00mL于5个50mL的容量瓶中,各向其中加入0.50g硫氰酸铵、5.00mL冰醋酸、30.00mL丙酮,加入去离子水定容至刻度,摇晃均匀,吸取部分溶液加入比色皿中,以试剂空白溶液(上述不加标准钴的溶液)为参比溶液,在上述最大吸收波长下以吸光度为纵坐标,钴离子浓度(μg/mL)为横坐标,绘制钴离子标准曲线。
由图2可知,钴(Ⅱ)离子吸收曲线的回归方程如式(3)所示:
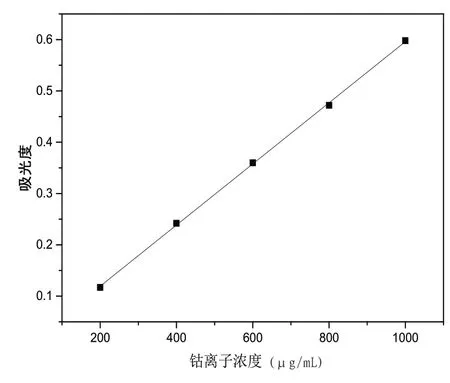
图2 钴(Ⅱ)离子标准曲线
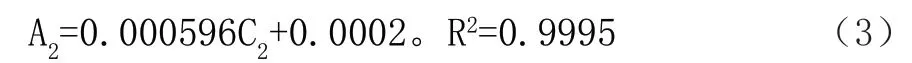
式中,A2代表吸光度;C2代表钴(Ⅱ)离子浓度。
(5)协同萃取机理
P507是磷酸类萃取剂,主要成分为2-乙基己基磷酸单2-乙基己基酯。其结构式如图3。N235是烷基数为8-10C的三烷基胺,通常是混合物。
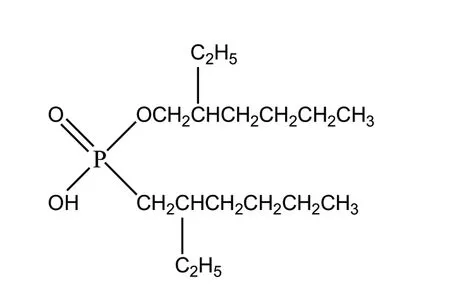
图3 萃取剂P507结构式
水分子中的氢氧原子并不是直线构造,而是呈现出105°的钝角,因为氧原子吸电子能力远高于氢原子,所以电子对会偏向于氧原子,导致氧原子呈现出电负性,而氢原子呈现出正电性。金属盐在水中溶解,金属离子带正电,因为正负离子间的静电作用,相互吸引,我们一般称这种现象为水合。酸性萃取剂在同金属离子反应时,其解离出的酸根会取代金属离子的内配位层水合水,形成萃取配合物,这样金属离子便会进入到有机相中。
对于P507而言,P507属于有机磷酸萃取剂,其结构中的P=O能够在解离后形成酸根,最后便同钴离子反应形成萃取配合物。从而将钴从水相中分离出来。反应式为:

N235属于按化学性质可分为胺类萃取剂,由于其碳链长短不一,物质并不单一,属于混合物。胺就是氨气中的氢原子被烃基所取代的有机化合物;根据取代数量的不同,可分为四种,被取代单个氢原子的称之为伯胺,通常表示为NH2R;被取代两个氢原子的称之为仲胺,通常表示为NHR2;氨气中的氢原子全部被取代时,称之为叔胺,通常表示为NR3。N235便属于叔胺。胺类萃取剂以氮原子为给体,能够与一些阴离子,如Cl-形成铵盐。
在镍钴萃取分离过程中,钴离子能够与溶液中的氯离子生成四氯合钴离子配离子。四氯合钴离子配离子同N235形成铵盐。钴离子便与N235形成铵盐萃合物进入到有机相中,但对于镍离子而言,镍离子不能够同氯离子形成配离子,不能够被N235萃取分离,所以N235就可以起到钴镍分离的作用。该萃取过程可表示为:
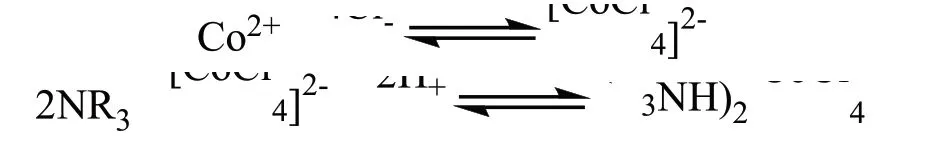
当P507与N235形成萃取体系时,萃取过程中,N235作为氢离子的受体,能够生成阳离子,然后同盐溶液中的阴离子结合,将待萃取的钴离子同氯离子一起形成萃合物进入有机相。对于P507的萃取过程而言,萃取过程中会替换下来氢离子,但因为N235的存在,能够吸收氢离子,所以不需要加入氢氧根中和氢离子。
2.结果与讨论
调节水相pH为5.0,萃取时间为5min,萃取剂浓度为20%(P507:N235=1:1)。加入10.00mL有机相,按照相比(A/O)分别为1:2、1:1、3:2、2:1、5:2,量取对应体积的0.20mol/L浓度的镍离子溶液和0.02mol/L的钴离子混合溶液,水相中加入NaCl调节Cl-浓度达到200g/L,实验结果见 图4(a);确定相比为2:1,分别调节水相初始pH为1.0、2.0、3.0、4.0、5.0,进行了初始pH影响研究,结果见图4(b);确定相比为2:1、水相初始pH为4.0、萃取剂浓度为20%(P507:N235=1:1)、在萃取时间为1min、3min、5min、7min、9min的范围内研究了萃取时间对钴镍分离程度的影响,实验结果见图4(c);确定相比为2:1、水相初始pH值为4.0、稀释剂为磺化煤油、萃取时间为5min时,在浓度为 10%、15%、20%、25%、30%(P507:N235=1:1)的范围内研究了萃取剂浓度对钴镍分离程度的影响,结果见图4(d);当水相初始pH值为4.0、萃取剂浓度为20%、稀释剂为磺化煤油、萃取时间为5min时,在萃取剂P507:N235=1:2、1:1、3:2、2:1、1:2的范围内研究了相比例对钴镍分离程度的影响,实验结果见图4(e)。
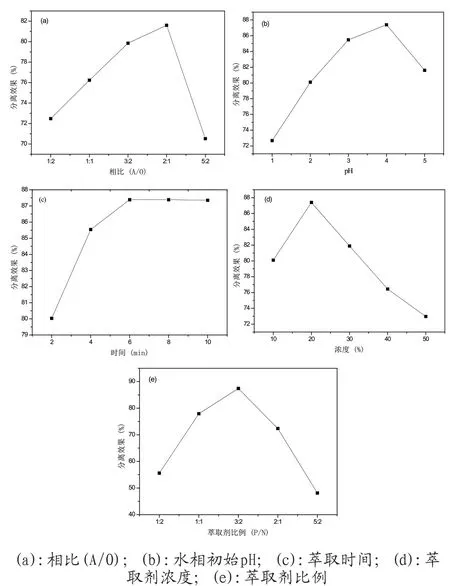
图4 镍萃取影响研究
由图4(a)可知,随着相比的增加,分离效果增加,相比为2:1后,分离效果下降。原因主要是有机相萃取达到饱和,有机相比例增加,分离效果增加不明显。所以选取相比(A/O)为2:1。由图4(b)可知,随着pH的增加,分离效果逐渐增加,但当pH大于4.0后,分离效果却逐渐减小。P507在萃取过程中会产生H+,H+的累积会抑制P507的萃取效果,而N235需要H+的参与,所以当pH过低时,会抑制P507的萃取。同理,pH过高,N235无法进行萃取,打破了萃取体系的平衡。所以根据实验结果,pH为4.0时,该萃取体系分离效果最好。根据图4(c),随着萃取时间的增加,分离效果增加,但萃取时间达到5min后,曲线趋于平缓,分离效果增加不明显。说明萃取时间为5min,萃取就已基本完成,所以选取萃取时间为5min。根据图4(d)得出,随着萃取剂浓度的升高,分离效果越好,但萃取剂浓度为20%后,分离效果逐渐变小,可能是因为萃取剂浓度低时,溶液中钴离子未萃取完全,当萃取剂浓度达到20%后,萃取剂的流动性变低,萃取效果下降,所以选取浓度为20%时,效果最佳。根据图4(e)得出萃取剂比例为1:1时,分离效果最好。
3.结论
采用P507和N235混合萃取剂,对模拟红土镍矿浸出液中的镍(Ⅱ)进行了萃取分离研究。当P/N为1:1、水相初始pH为4.0、萃取剂浓度为20%、水油相比例为2:1、稀释剂为磺化煤油、萃取时间为5min,在该条件下镍钴分离效果达到87.39%。

