铁基催化剂高级氧化技术降解废水研究进展
*郅轲轲 李哲 马鹏飞 谭永祥 张维康
(中国石油大学(北京)克拉玛依校区 新疆 834000)
随着人们对美好生活的向往,越来越多的新型材料被运用于石油化工、医疗制药等产业,有机物的使用量大大增 加[1],从而对环境造成污染。绿水青山就是金山银山,如何高效、快速、环保地去除水体中有机污染物成为目前我国面临的问题之一。自然环境下,部分污染物可以在光照的作用下分解,但汇入地下水的污染物由于没有光照很难被分解,从而导致恶性循环,对水生生物产生不可逆转的毒害作用[2]。
高级氧化法可以产生多种自由基离子,从而将大分子有机物逐步分解直至矿化。目前,高级氧化法包括Fenton氧化法[3]、臭氧氧化法[4]、氯化法[5]、光解法[6]、光催化法[7]和高铁酸盐(VI)催化氧化法[8]等。
铁属于过渡金属,相对铜、锰而言毒性更低。目前,关于Fe0以及各种铁基催化剂如铁酸铜(CuFe2O4)在高级氧化技术中应用的报道接踵而至[9]。铁基催化剂在降解抗生素类废水、染料废水、工业废水等方面展现了非常好的效果及前景[10]。本文就多种铁基催化剂在高级氧化技术中的作用进行综述,主要介绍过硫酸盐的高级氧化技术[11],以及目前遇到的问题和发展前景,以促进该项技术的持续化发展。
1.基于铁基催化剂的过硫酸盐的高级氧化技术
过硫酸盐的氧化技术作为新的高级氧化技术(SRAOPs),通过激发水溶液中过一硫酸盐PMS产生硫酸根自由基离子·SO4-从而降解水中有机污染物。硫酸根自由基离子不仅具有很高的氧化还原电位(2.6-3.1V),可以将有机物转换为H2O与CO2,它还可以在较广的pH值范围内适用[12],因此,活化·SO4-的量决定了降解效果。在活化机制方面而言,过渡金属化合物与过硫酸盐反应会产生大量的·SO4-,反应方程式如下:
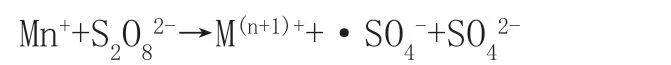
通过上述方程式可知,该反应过程中金属元素处于离子形态分散在溶液中,尽管可以较好的通过活化SR-AOPs机制降解废水,但由于其不易回收的性质,生产成本大幅提升,且极易对环境造成二次污染。因此,金属浸出率较低的材料成为了新的研究方向,通过过硫酸盐的多相催化技术,可以很好的解决上述问题[13]。
(1)铁酸铜CuFe2O4的高级氧化技术
过渡金属的多金属自旋氧化物被证明可以高效活化过硫酸盐PMS,是因为多金属氧化物之间的电子传输相对于单过渡金属氧化物而言有大幅提升[10]。CuFe2O4晶体是一种具有磁性结构的纳米尖晶石铁氧体,其化学性质稳定,机械强度高,金属浸出率低,容易被分离二次应用等优点,常常被适用于Fenton技术中。目前,大家普遍认为Fenton的反应机理为Haber-Weiss机制[11](图1)。相对于单金属的Cu、Fe而言,CuFe2O4中的Cu、Fe元素能分别在催化中起到作用,并且由于电子空穴等效应,铜与铁元素之间相互转换速率大大加快,故反应有效成分持续保持在较高浓度,反应机理如下。该反应途径不仅可以促进2种金属间的电子对循环[12],还可以大幅提升对H2O2的催化效率。

图1 Haber-Weiss反应机理
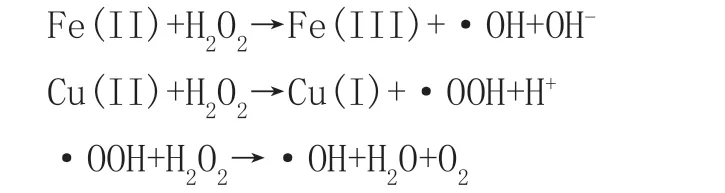
过硫酸盐是近些年来新兴起Fenton法中的高效氧化剂,但反应易受到水体中Cl-、HCO3-以及水体的pH值的影响,其性能也有所改变[13]。反应机理如下:
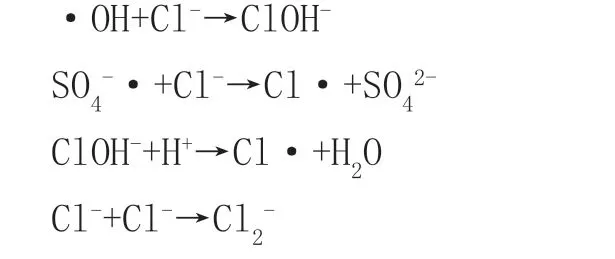
目前,部分研究指出,在铁酸铜活化过硫酸盐的高级氧化技术中,对反应起到主要作用的是非自由基,即单线态氧1O218。铁酸铜中铁铜离子在·SO5-等自由基的作用下发生电子转移,从而导致大量单线态氧的生成,而后通过 Fe(III)与Cu(II)之间的相互转换,使反应可以稳步进行,反应机理如下:
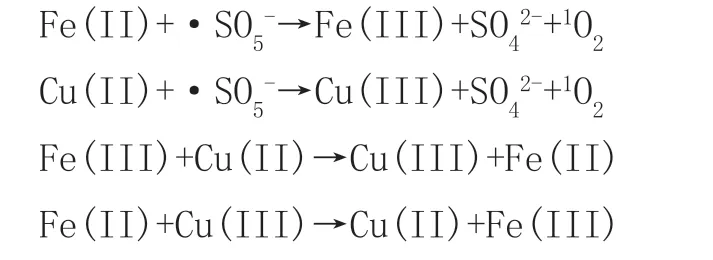
许多具有铁氧四面体结构(MeFe2O4)的铁基催化剂也有不错的效果,例如CoFe2O4、MnFe2O4等,其反应机理与铁酸铜类似。由于CuFe2O4金属浸出率低,且具有磁性容易被分离的特性,其重复利用率效果优良[14],在工业生产以及环境保护方面有着很好的效果。
(2)四氧化三铁Fe3O4的高级氧化技术
Fe3O4是一种黑色具有旋转尖晶石结构的晶体。磁铁矿中Fe2+与Fe3+在铁氧八面体上是无序排列的,故电子可以在Fe2+与Fe3+间发生迅速转移,故在八面体上的同一位置可以发生可逆的氧化还原反应。Fe3O4还可与载体复合。由于Fe3O4易聚集,比表面积变小,在溶液中有效碰撞次数减少,导致其催化活性降低。通过非均相催化方法,即选择多孔性载体[20],可有效提升其比表面积,防止聚集,增加化学位点接触,从而使化学反应速率有大幅提高。目前使用较多的载体一般具有较好的稳定性且吸附能力较强,如石墨烯及氧化石墨烯[21-22]等。复合后,通过范德华力等作用与载体紧密结合,不易从载体表面脱落,从而达到更好的降解效果。
(3)单质铁的高级氧化技术
①Fe2+活化过硫酸盐
ANIPSITAKIS等[11]综合比较了9种金属离子(V3+、Mn2+、Fe2+、Ni2+、Ce3+、Ru3+、Cu2+、Ag+、Co2+)活化2类过硫酸盐的效果,由此可推测Fe2+在激发PMS产生·SO4-方面的效果较为优秀,但Fe2+又具有一定的还原性,故Fe2+会与有机物竞争,并大量转换为Fe3+,能与有机物反应的·SO4-量大大减少。因此在该反应过程中必须保持稳定的Fe2+浓度。反应机理如下:
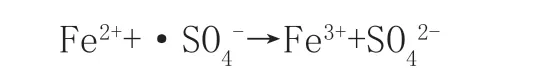
②Fe0活化过硫酸盐
Fe2+在中性至碱性环境下会生成氢氧化物沉淀导致有效成分减少,因此,越来越多的研究者采用Fe0活化过硫酸盐PS降解有机污染物[18]。经研究表明,Fe0的效果要远远高于Fe2+且对环境更加合适[19],大幅度减少对环境的污染。在Fe0/PS体系中,Fe0可以转化成为Fe2+,还可以循环利用Fe3+从而大幅增加利用率,反应机理如下:
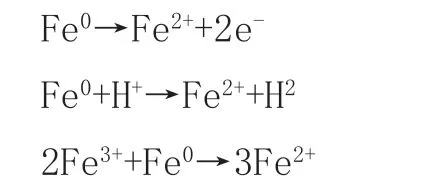
该反应需要消耗氢离子,故容易受到pH值的影响,随着pH值的升高,该反应会逐渐变慢,通常在使用Fe0活化PS时会在水体中加入适量的H2O2,以达到减少氧化剂成本的目的。通过部分方法合成的Fe0化合物可以通过非自由基途径,及自身电子转移来降解水中污染物[25]。表1为单质铁及其非氧化物降解不同种污染物的研究进展。通过分析表1可知,Fe不仅在有氧化剂存在的情况下展现出良好的高级氧化效果,通过核外电子的转移也可以自身完成高级氧化从而降解水中污染物。
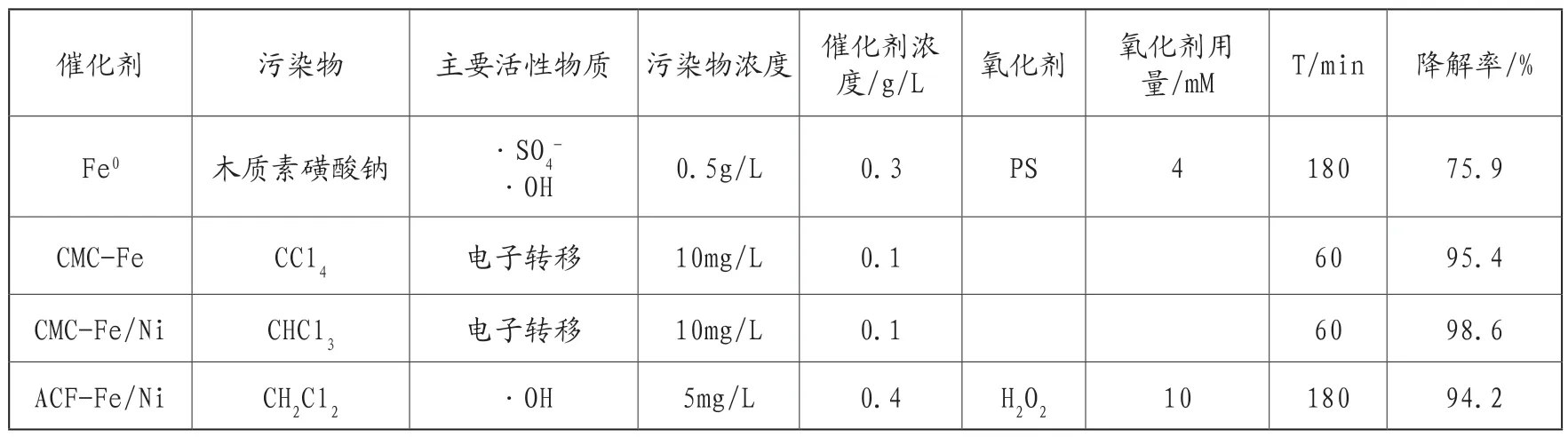
表1 单质铁及其非氧化物降解不同种污染物的研究进展[21-23]
2.展望
近年来铁基催化剂高级氧化技术得到广泛关注,就铁基催化剂自身而言,由于中心原子为Fe,其核外电子排布并不属于稳定状态,故化学性质相对较活泼,其不但容易受到pH值影响,且易受到水中各种离子影响。过硫酸盐的高级氧化技术属于新兴技术,上文中几种金属离子对过硫酸盐都有活化作用。就当下问题,提出几条思路以及改进的可能性。
(1)采取双金属协同的高级氧化技术中的多金属复合方法,以铁为核心筛选比较其它过渡元素金属离子,复合新型铁基催化剂。
(2)反应终止后,部分铁基催化剂由于变性可能会产生铁渣等废料,后续若处理不当,极易对水体造成二次污染;同时反应过程中存在金属的变价反应,降低了反应有效分子的碰撞,副反应较多。
(3)通过表面载体等方法修饰铁基催化剂,在增加比表面积的同时增强其酸碱耐受,使其可以在更广泛的pH值范围内适用。
(4)非自由基的高级氧化技术在降解废水过程中效果也很显著,寻找新的非自由基反应途径降解废水。相对于只产生硫酸根自由基,通过非自由基产生单线态氧使得降解效果进一步提升。
(5)综上,大部分铁基催化剂反应条件为酸性乃至强酸性环境,在中性环境中并不适用,若要用其降解废水,则需要调节水体pH值,而若水体中存在酸性不耐受或酸性易分解物质,极易产生不良后果,且反应终止后要继续调节水的pH值,大大增加成本。

