枯草芽孢杆菌对脂多糖应激肉仔鸡生长性能、免疫性能和血清抗氧化性能的影响
杨敏敏 车育彦 王 睿 王海鑫 刘 彬 李 琰 张嘉怡 秦士贞 史兆国
(甘肃农业大学动物科学技术学院,兰州 730070)
近些年,随着我国畜牧行业的蓬勃发展,在高密度、规模化、集约化养殖模式的生产过程中,动物易受到外源性微生物(如严重的环境污染、复杂的免疫接种程序以及大肠杆菌等病原菌)的侵袭,这些外源性刺激会间接诱导动物机体发生免疫应激,使机体处于免疫应激状态[1]。在此状态下,动物机体的免疫系统被激活,导致机体炎症反应加剧,对能量的需求增加,将原本用于生长的营养物质被分配到免疫系统中,从而使得动物机体的合成代谢减弱,分解代谢加强,营养物质在机体内的沉积减少,造成动物生产性能下降,养殖效益降低,给养殖行业带来了巨大的经济损失[2]。因此,找寻一种有效的饲料添加剂,对调节机体的免疫系统、保护畜禽免受应激的影响具有重要意义。
枯草芽孢杆菌(Bacillussubtilis,BS)是一种能够产生抗逆性内生孢子的需氧革兰氏阳性菌[3]。研究表明,枯草芽孢杆菌作为一种优质、安全且目前应用最广泛的饲用益生菌之一,具有提高动物生产性能、增强机体免疫及抗氧化功能、缓解热应激和维护家禽肠道健康等多种功能[4-5]。此外,也有研究表明,由BS产生的表面活性脂肽在体外和体内试验中均表现出明显的抗炎作用[6-7]。但是,目前关于BS对肉鸡在免疫应激状态下的研究鲜有报道。
脂多糖(lipopolysaccharide,LPS)是目前构建动物免疫应激模型中应用最普遍、最经典的药物[8]。LPS是革兰氏阴性菌外膜的组成成分,其本身无毒性作用,但能够释放内源性活性因子,作为非特异性免疫原与宿主的免疫效应细胞相互作用,通过一系列细胞内信号转导系统,诱导畜禽在短时间内发生免疫应激[9-10]。本试验通过对试验肉鸡进行LPS应激处理建立免疫应激模型,并在饲粮中添加BS,探讨其对LPS免疫应激肉仔鸡生长性能、免疫性能和抗氧化性能的影响,以期为预防及缓解免疫应激对机体造成损伤提供一种选择,为BS在家禽生产中的应用提供参考依据。
1 材料与方法
1.1 试验材料
BS(活菌数≥5.0×109CFU/g)购自甘肃某饲料科技有限公司,LPS购自北京某公司,来源于大肠杆菌,血清型为O55∶B5,称取LPS粉剂5 mg,加入10 mL灭菌的生理盐水中,涡旋振荡混匀,配制成浓度为0.5 mg/mL的LPS溶液,现用现配。1日龄爱拔益加(AA)肉鸡购自西安某禽业有限公司。
1.2 试验设计
本试验采用2×2两因子设计,2个因子分别为饲粮(饲喂基础饲粮或添加200 g/t BS的试验饲粮)和LPS应激(口腔灌服LPS溶液或生理盐水)。将1日龄健康、体重相近的AA肉仔鸡192只(公母各占1/2),随机分为:1)基础饲粮+生理盐水组;2)基础饲粮+LPS组;3)试验饲粮+生理盐水组;4)试验饲粮+LPS组,共计4个组,每组6个重复,每个重复8只鸡。试验期为28 d,分为3个阶段,包括应激前期(第1~14天)、LPS应激期(第15~21天)、恢复期(第22~28天)。于试验第14、16、18、20天早晨,对基础饲粮+LPS组和试验饲粮+LPS组的肉仔鸡口腔灌服LPS溶液(500 μg/kg BW)(LPS灌服剂量参照李悦等[11]和Li等[12]),同时对基础饲粮+生理盐水组和试验饲粮+生理盐水组的肉仔鸡口腔灌服等量的生理盐水。
1.3 试验饲粮
基础饲粮参照NRC(1994)和《鸡饲养标准》(NY/T 33—2004)配制,其组成及营养水平见表1。

表1 基础饲粮组成及营养水平(风干基础)
1.4 饲养管理
试验采用3层笼养方式,试验前对鸡舍及其相关器具进行清洗消毒,进鸡前3天采用人工控温的方式控制鸡舍温度。每天24 h恒定光照,试验期间鸡只自由采食和饮水,按照常规免疫程序定期进行免疫接种。
1.5 检测指标与方法
1.5.1 生长性能
试验于第1天以重复为单位进行称重记录其初始体重,并于第14、21、28天早晨以重复为单位各称重1次(称重前停饲12 h,自由饮水),同时,以重复为单位记录采食量。根据记录的数据计算平均日增重(ADG)、平均日采食量(ADFI)和饲料转化率(FCR)。
1.5.2 免疫器官指数
各试验组分别于试验第21和28天时,每个重复随机选取1只接近于平均体重的肉仔鸡屠宰,颈部放血致死后,迅速剖开颈部和腹腔,完整摘取胸腺、脾脏和法氏囊,同时剔除器官表面黏附的筋膜和脂肪组织,用滤纸吸干表面的血水后,运用电子天平准确称重。免疫器官指数计算公式如下:
免疫器官指数(g/kg)=免疫器官重量(g)/
宰前空腹活体重(kg)。
1.5.3 血清细胞因子、免疫和抗氧化指标
在第21和28天时,每个重复随机选取1只接近于平均体重的肉鸡,翅下静脉采集血液样品,将采集的血液样品室温静置30 min后,在4 °C条件下3 000 r/min离心10 min,分离得到的血清于-20 ℃冰箱中保存备用,用以检测血清中免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、皮质酮(CORT)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、丙二醛(MDA)含量,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性及总抗氧化能力(T-AOC),以上指标均采用酶联免疫吸附剂测定(ELISA)试剂盒进行测定,具体操作方法按照试剂盒内说明书进行,试剂盒购自上海酶联生物有限公司。
1.6 数据处理与分析
试验数据用Excel 2010软件进行初步统计,利用SPSS 26.0统计软件的一般线性模型进行两因子方差分析,每个重复作为1个试验单元,主效应包括饲粮和LPS应激以及两者互作。方差分析差异显著时用Duncan氏法进行多重比较,以P<0.05表示差异显著,试验结果用平均值±标准差表示。
2 结果与分析
2.1 BS对LPS应激肉仔鸡生长性能的影响
由表2可知,在应激前期,饲粮中添加BS可显著提高肉仔鸡的ADG(P<0.05),对ADFI和FCR无显著影响(P>0.05)。在应激期和恢复期,LPS应激显著降低ADG(P<0.05),而饲粮中添加BS的肉仔鸡ADG显著高于未添加BS的肉仔鸡(P<0.05)。与基础饲粮组相比,饲粮中添加BS可显著提高应激期和恢复期的ADG(P<0.05)。在恢复期,饲粮中添加BS可显著降低FCR(P<0.05)。饲粮中添加BS和LPS应激对各阶段的ADFI均无显著影响(P>0.05)。饲粮中添加BS与LPS应激对肉仔鸡的ADG、ADFI和FCR均无显著的交互作用(P>0.05)。
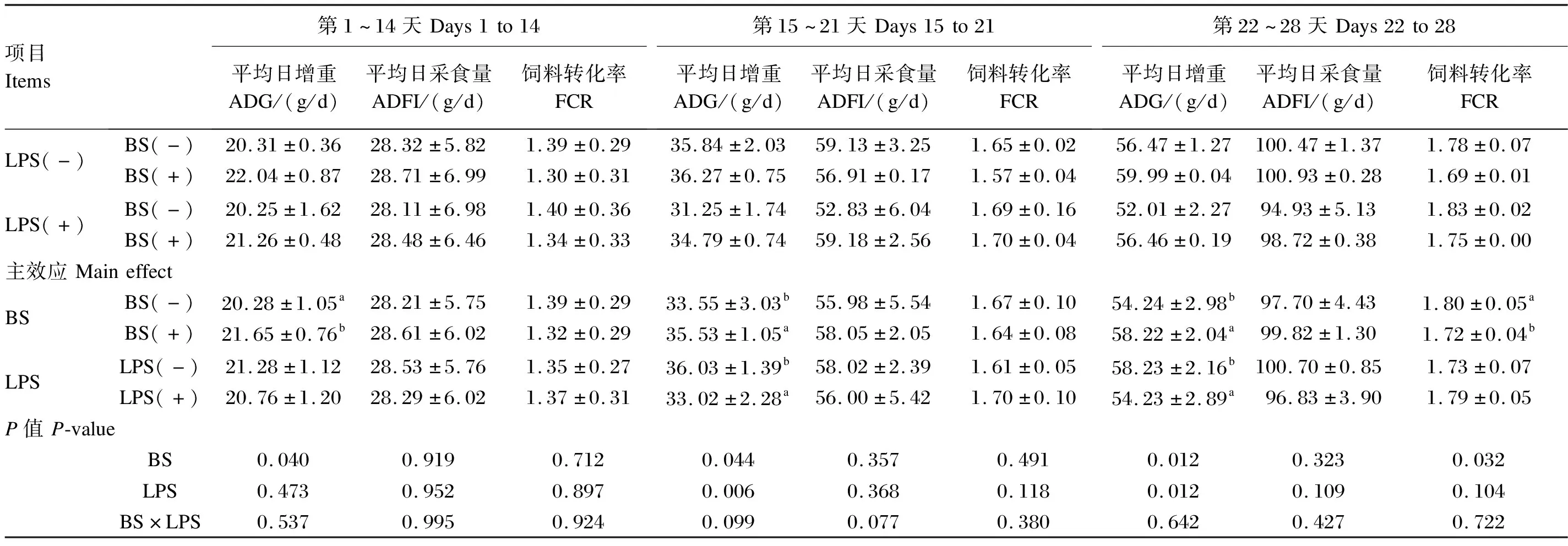
表2 BS对免LPS应激肉仔鸡生长性能的影响
2.2 BS对LPS应激肉仔鸡免疫器官指数的影响
由表3可知,在第21天,LPS应激显著提高脾脏指数(P<0.05),对胸腺指数和法氏囊指数无显著影响(P>0.05)。在第28天,饲粮中添加BS与LPS应激对肉仔鸡脾脏指数有显著的交互作用(P<0.05)。在无应激条件下,饲粮中添加BS对脾脏指数无显著影响(P>0.05);在LPS应激条件下,饲粮中添加BS可显著降低脾脏指数(P<0.05)。在整个试验期,饲粮中添加BS与LPS应激对肉仔鸡胸腺指数和法氏囊指数均无显著影响(P>0.05)。

表3 BS对LPS应激肉仔鸡免疫器官指数的影响
2.3 BS对LPS应激肉仔鸡血清免疫球蛋白含量的影响
由表4可知,在第21天,饲粮中添加BS与LPS应激对血清IgA的含量有显著的交互作用(P<0.05)。无应激条件下,饲粮中添加BS对血清IgA含量无显著影响(P>0.05);在LPS应激条件下,饲粮中添加BS可显著降低血清IgA含量(P<0.05)。LPS应激显著提高血清中IgG的含量(P<0.05)。在第28天,各试验组间血清免疫球蛋白含量无显著差异(P>0.05)。

表4 BS对LPS应激肉仔鸡血清免疫球蛋白含量的影响
2.4 BS对LPS应激肉仔鸡血清细胞因子含量的影响
由表5可知,在第21天,与基础饲粮组相比,饲粮中添加BS显著降低了血清CORT含量,对血清IL-1β、IL-6、TNF-α含量无显著影响(P>0.05)。在LPS应激条件下,血清细胞因子IL-1β、IL-6的含量显著升高(P<0.05)。饲粮中添加BS与LPS应激对血清IL-10、TNF-α的含量有显著的交互作用(P<0.05)。在无应激条件下,饲粮中添加BS对血清IL-10、TNF-α的含量无显著影响(P>0.05);在LPS应激条件下,饲粮中添加BS可显著降低血清IL-10、TNF-α含量(P<0.05)。在第28天,饲粮中添加BS与LPS应激对血清CORT、IL-1β含量有显著的交互作用(P<0.05)。在无应激条件下,饲粮中添加BS对血清CORT、IL-1β含量无显著影响(P>0.05);在LPS应激条件下,饲粮中添加BS可显著降低血清CORT、IL-1β含量(P<0.05)。与无应激相比,LPS应激显著增加血清了IL-6、TNF-α的含量(P<0.05),对血清IL-10含量无显著影响(P>0.05)。

表5 BS对LPS应激肉仔鸡血清细胞因子含量的影响
2.5 BS对LPS应激肉仔鸡血清抗氧化性能的影响
由表6可知,在第21天,饲粮中添加BS与LPS应激对血清T-AOC、MDA含量和CAT活性有显著交互作用(P<0.05)。在无应激条件下,饲粮中添加BS对血清T-AOC、MDA含量和CAT活性无显著影响(P>0.05);在LPS应激条件下,饲粮中添加BS可显著提高血清T-AOC含量(P<0.05),显著降低MDA含量(P<0.05),显著增加CAT活性(P<0.05),对血清SOD活性无显著影响(P>0.05)。在第28天,LPS应激显著降低血清SOD活性(P<0.05),对血清T-AOC、MDA含量和CAT活性无显著影响(P>0.05)。
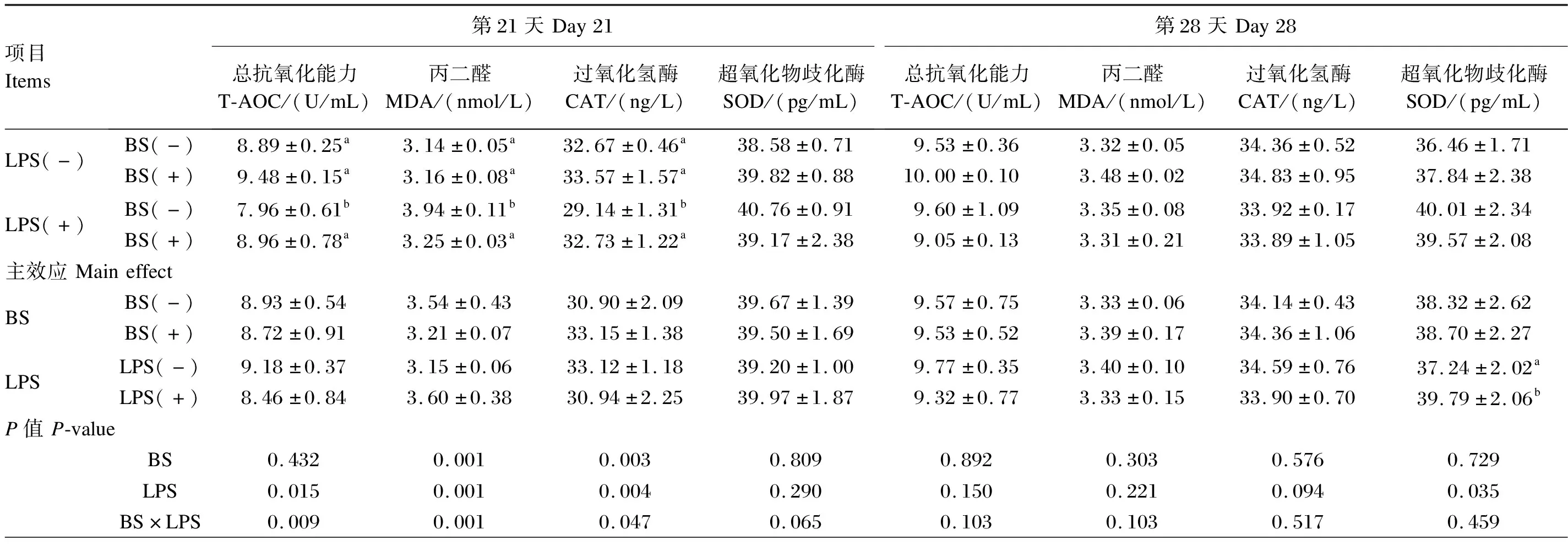
表6 BS对LPS应激肉仔鸡血清抗氧化性能的影响
3 讨 论
3.1 BS对LPS应激肉仔鸡生长性能的影响
LPS是存在于革兰氏阴性菌细胞壁外膜中的致病成分,在被动物机体吸收后能够诱导免疫细胞的合成,同时分泌大量的炎性细胞因子(如IL-1β、IL-6、TNF-α等)[13]。此外,动物机体会出现厌食、生长受阻等特征,LPS被普遍应用于构建动物免疫应激模型[14]。大量研究表明,LPS应激会降低肉仔鸡的生长性能[15-16]。本试验结果表明,口腔灌服500 μg/kg BW的LPS显著降低应激期和恢复期的ADG,但对FCR无显著影响。这一结果与李悦等[11]研究结果一致。杨莉[1]研究发现,腹腔注射1.5 mg/kg BW的LPS可显著降低21日龄肉仔鸡ADG和ADFI,但对FCR无显著影响。Shen等[17]研究报道,腹腔注射3 mg/kg BW LPS,可显著降低其ADG、ADFI和FCR。而Kamboh等[18]研究结果表明,连续多次使用0.25 mg/kg BW剂量的LPS并不影响肉仔鸡的生长性能。因此,可推断出LPS的水平越高对肉仔鸡生长性能的影响越显著。BS作为一种功能性添加剂被广泛应用于家禽生产中,且有大量研究表明,BS能提高家禽生产性能。Gao等[19]研究发现,BS可显著降低FCR和提高肉仔鸡的末重及ADG;Mahmoud等[20]研究表明,BS有提高肉仔鸡ADG的趋势;张雪等[21]研究发现,BS可极显著提高肉仔鸡ADG,显著提高ADFI和显著降低FCR。本试验结果表明,在应激前期,饲粮中添加BS可显著提高ADG;在恢复期,饲粮中添加BS可显著降低FCR,这一结果与上述研究结果一致。同时,在LPS应激条件下,饲粮中添加BS的肉仔鸡ADG显著高于未添加组。LPS应激导致的肉仔鸡生长性能降低,是由于LPS作为非特异性免疫刺激源,激活了下丘脑-垂体-肾上腺轴中枢神经系统,此外,调控与食欲有关的信号分子导致受体产生厌食反应,刺激动物机体产生大量炎症细胞因子而引起发热,并将原本用于维持机体稳态的营养物质重新分配到免疫系统中,使机体的分解代谢增加,合成代谢减少,营养物质在动物机体内的沉积量减少,从而导致畜禽生长发育缓慢,生长性能降低[1-2]。
3.2 BS对LPS应激肉仔鸡免疫性能的影响
家禽最主要的免疫器官有胸腺、脾脏、法氏囊,一般认为免疫器官指数的变化可间接表明机体的免疫状况,胸腺和法式囊属于中枢免疫器官,二者是T、B淋巴细胞发育、分化和成熟的主要场所[22]。脾脏是机体最大的外周淋巴免疫器官,是血管通路上的重要过滤器官,含有大量的淋巴细胞、树突状细胞和巨噬细胞,是细胞免疫和体液免疫应答的重要部位[23]。本试验结果表明,在第21和28天,LPS应激显著提高脾脏指数,出现该结果的原因可能是LPS应激使得脾脏中免疫应答处于过度激活的状态,大量的淋巴细胞通过中枢免疫器官迁移到脾脏中参与机体的免疫应答而使脾脏肿大[12]。这一研究结果与李昆[14]和杨莉[1]研究结果一致。本试验发现,在LPS应激条件下,饲粮中添加BS可显著降低脾脏指数,表明BS对脾脏的免疫应答具有调节作用。
免疫球蛋白是机体免疫系统的重要组成部分,其在血液中的含量是反映机体免疫功能的重要标志。同时,免疫球蛋白在炎症的调节中起着关键性作用[1]。IgG是动物血清中含量最高的免疫球蛋白,是体液免疫应答最主要的抗体,在动物机体自然感染或者人工免疫后产生,能够持续的发挥抗病毒、抗毒素以及抗菌的免疫学活性;IgM是动物机体接触抗原后产生的最早的免疫球蛋白,其含量较少,主要由B淋巴细胞和脾脏产生,同样具有抗病毒、抗毒素以及抗菌的生理作用;IgA在血清中含量较少,其主要参与黏膜免疫[24-25]。Zhang等[26]和李昆[14]研究发现,LPS刺激可显著提高血清中IgA、IgG的含量。但王娟娟[27]研究发现,LPS刺激对血清中各项免疫球蛋白指标均无显著影响。本研究结果表明,LPS应激显著提高血清中IgA、IgG的含量,这一结果表明LPS引起了机体的体液免疫反应,使免疫系统处于过度的激活状态。益生菌可维持动物肠道内微生态平衡,刺激与肠黏膜有关的淋巴组织活化,诱发其生成淋巴细胞来调节机体的免疫应答[28]。闫一博等[29]研究表明,在饲粮中添加BS后试验组肉鸡血清中IgG、IgM和IgA含量均极显著高于对照组。王琳[30]研究得出,饲粮中添加BS可显著提高育成鸡血清中IgG和IgM含量。Bai等[31]研究报道,BS可增加肉仔鸡血清中IgG、IgA的含量。本研究结果表明,在无应激条件下,饲粮中添加BS对血清免疫球蛋白含量无显著影响;在LPS应激条件下,饲粮中添加BS可显著降低血清IgA的含量。造成这一结果的具体原因尚不清楚,有待进一步研究。
细胞因子是动物机体受到免疫源或其他刺激时诱导巨噬/单核细胞在免疫初期,合成与分泌产生的具有激素样活性的蛋白质或小分子多肽,是激活宿主防御系统、调节固有免疫和适应性免疫的关键因子,其含量在机体发生炎症反应后迅速变化[1-2]。在LPS应激作用下,免疫细胞通过激活Toll样受体-核转录因子-κB(TLRs-NF-κB)信号传导途径来诱导细胞因子的分泌和表达,分泌的细胞因子被释放到血液中通过血液在整个动物机体内循环,此过程会同时发生促炎和抗炎反应,其中IL-4、IL-10、IL-2等是抗炎因子,可抑制炎症反应的发生;IL-1β、IL-6、TNF-α等会促进炎症反应的发生,称促炎因子[32]。因此,检测细胞因子的含量被广泛应用于评价动物机体的免疫状况。马邯生等[2]研究报道,LPS应激显著提高血清中TNF-α、IL-2、IL-6、干扰素-γ(IFN-γ)的含量。李昆[14]研究发现,LPS刺激后血清中IL-1β、IL-2、IL-6、TNF-α、一氧化氮(NO)、诱导型一氧化氮合酶(iNOS)含量显著升高。本试验结果表明,在第21天,LPS应激显著提高血清中IL-1β、IL-6的含量,这一结果与前人研究结果相似,表明成功建立了免疫应激模型。此外,本研究结果还表明,在LPS应激条件下,饲粮中添加BS可显著降低血清IL-10、TNF-α的含量。CORT作为下丘脑-垂体-肾上腺(HPA)轴上重要的应激激素,CORT含量的变化是判断畜禽是否产生应激的最直接指标[33]。在第28天,在LPS应激条件下,饲粮中添加BS可显著降低血清CORT、IL-1β的含量。这表明饲粮中添加BS可抑制LPS应激诱导的炎症反应,其原因可能是BS作为非特异性的免疫因子,具有一定的免疫调节活性,可以激活巨噬/单核细胞,刺激宿主建立完整的免疫系统[5];此外,芽孢杆菌可以改善肠道内微生态环境,增强肠道屏障功能,减少肠道中内外抗原,降低抗原(如LPS)与炎症通路上的特异性受体Toll样受体(TLR4)结合,减少TLR4的活化,进而抑制NF-κB核移位诱导产生促炎细胞因子,减少炎症发生[12,34-35]。
3.3 BS对LPS应激肉仔鸡血清抗氧化性能的影响
动物机体在免疫应激状态下,炎性反应能导致多种免疫细胞的活化和聚集,释放出大量的活性氧(ROS),过量的ROS会造成动物机体内的氧化还原稳态失衡,导致机体产生氧化应激,从而对机体造成损伤[36]。MDA是常见的脂质过氧化,通过测定其含量可以间接反映出动物机体内的氧化损伤程度;T-AOC是反映动物机体抗氧化能力的综合指标,其水平高低可反映机体自由基代谢的状况和机体抗氧化系统对外源性刺激的代偿能力[14]。CAT、SOD是机体主要的抗氧化酶,具有清除过多自由基的作用,其活性或含量是评定机体抗氧化状态的重要指标[3]。有研究报道,LPS应激可增加动物机体内MDA的含量,降低SOD、CAT、GSH-Px的活性,使体内过氧化物和超氧化物的活性或含量增加,进而对机体造成损伤[37-38]。本试验结果表明,LPS应激显著降低血清T-AOC和CAT的活性,增加MDA的含量。该结果表明LPS应激打破了体内氧化/抗氧化系统的平衡,这一结果与前人研究结果一致。同时,本试验结果表明,在LPS应激条件下,饲粮中添加BS可显著提高血清T-AOC和CAT的活性,降低MDA的含量。这一结果与翟玲等[39]和余东游等[40]的研究结果一致,表明BS能够增强动物机体内抗氧化酶的活性或含量,提高抗氧化防御功能,缓解氧化应激对动物机体造成的损伤[5]。产生这一结果的原因可能是BS通过调控核转录因子E2相关因子(Nrf2)/抗氧化反应元件(ARE)信号通路,上调其下游二相抗氧化酶基因的表达,提高动物机体内抗氧化酶活性,从而发挥其抗氧化作用[31]。
4 结 论
在本试验条件下,饲粮中添加BS可在一定程度上改善肉仔鸡的生长性能,提高血清抗氧化性能和降低炎性细胞因子的含量,从而缓解LPS应激对肉仔鸡造成的机体损伤。

