磁学温度成像方法
靳 龙,王亚斌,温旭琴,苏日建
(郑州轻工业大学计算机与通信工程学院,郑州 450000)
0 引言
细胞能量代谢状态的原位、高时空分辨检测是生命科学研究的迫切需求。无论是细胞代谢过程中细胞信息的定量测量,还是观测疾病导致细胞内在状态的改变以及肿瘤热疗等现代生物医学应用领域中,相关生物量的实时获取均亟需一种细胞尺度的信息获取手段,从而实现活体细胞内生物信息的准确描述。温度是反应生物活动状态的基本物理量,研究实现一种细胞尺度(0.1℃@10 μm)的高灵敏温度成像方法,不仅可以实现细胞信息测量,而且具有重要的临床应用价值。
磁学测温方式以其人体“磁透传”和低风险性等特性,在实现透过肌肤探测人体内部的脏器温度方面具有天然的优势,在医学影像、医学治疗和生物科技研究领域中具有广阔的应用前景。磁学温度成像利用肌体组织或磁纳米粒子的电磁参数与温度之间的相关性,通过测量电磁特性参数再计算相应的组织参数或材料特性,进而求解相应被测对象的温度。目前磁学影像主要包括磁共振温度成像和磁性纳米粒子温度成像两大类。本文综述了磁学温度成像的实现方法,按照不同温度敏感量可具体分为:质子共振频移温度成像、纵向弛豫时间温度成像、横向弛豫时间温度成像、质子共振波谱温度成像、温度敏感造影剂温度成像和磁纳米粒子温度成像。
1 磁共振温度成像方法
1.1 质子共振频移温度成像
质子共振频移温度成像(proton resonance frequency shift temperature imaging,PRFSMI)是依据组织温度与质子共振频率变化量的相关性进行温度变化的检测。其数学描述为()=+ σ()。由于均匀主磁场上叠加了共振质子周围化学环境产生的局域磁场,导致回波信号中的相位信息( )=()TB变化,则相应的温度变化为Δ=(Φ()-Φ())/(αγTB)。
PRFSMI 的前提是假定温度的变化只与水质子相关,然而不同组织类型(如脂肪)、磁化率、主磁场漂移、呼吸及心脏脉动等生理运动都会影响温度的获取精度及时空分辨率,研究者从不同角度开展了工作。
Markus 等通过控制层析选择梯度极性和射频脉冲时间,使自旋回波序列对水或参照物(脂肪)具有频率选择性。通过采集对比参考图像和水图像,可实现温度图像的校正。当脂肪组织占比小于20%时,可使误差大大减少。为了避免多组织类型相互影响的问题,Yuan 等采用改进序列脉冲的方法抑制脂肪信号。
在水性组织中磁化率对温度测量误差的影响比较小,而在脂肪组织中磁化率的影响可达0.0039~0.0094 ppm/℃,特别是高脂肪组织,磁化率为主要的温度测量误差来源(图1)。Baron等采用建立二维和三维曲线间最小化差异的模型修正高脂肪组织温度成像中磁化率带来的误差,使温度测量误差从3.8 ℃降为2~2.3 ℃。
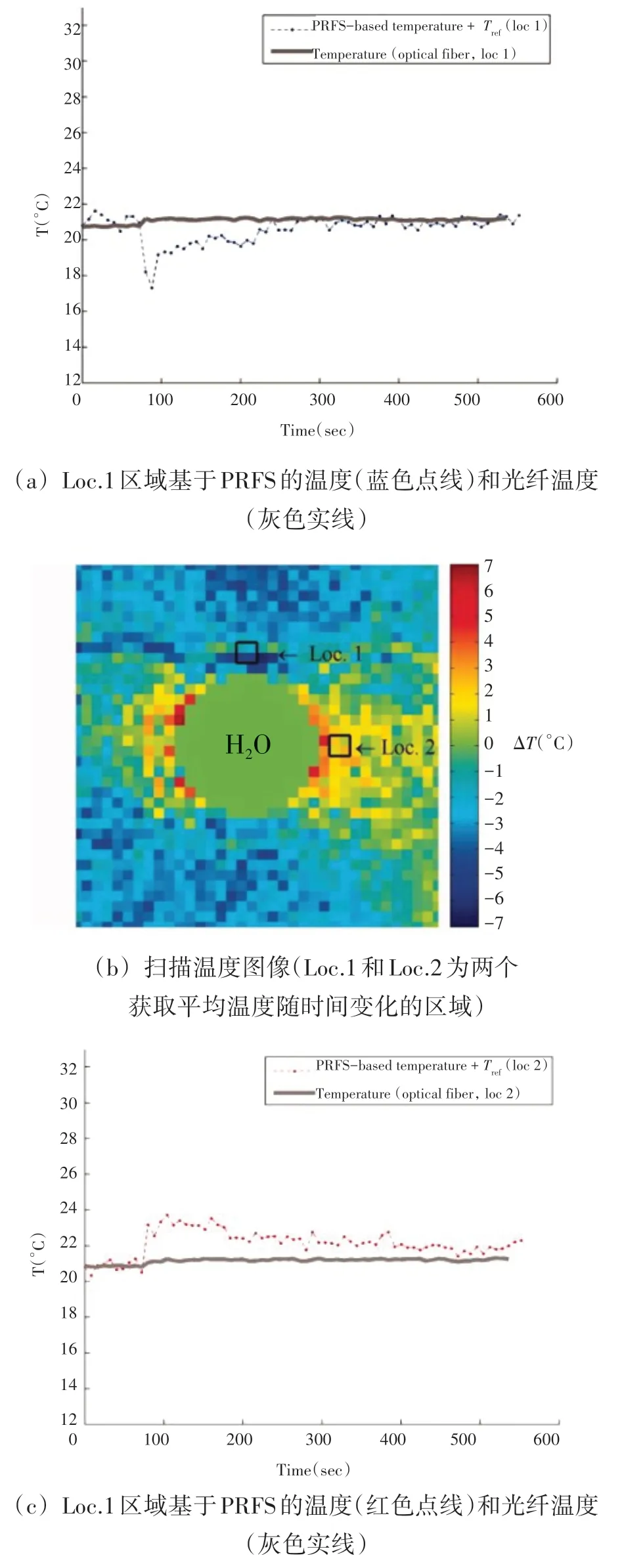
图1 基于PRFS温度图像的水加热实验
由于共振频率与主磁场相关性及PRFS 测温的参考组织相位相关性都使得磁场漂移对温度测量的敏感性加剧,特别是在应用强梯度场测量时,累积主磁场漂移可达0.01~0.06 ppm/minute,所以温度测量中有必要考虑主磁场漂移带来的测量误差。Zou 等提出了一种基于有限差分的无参考温度测量方法,减小了主磁场漂移带来的测量误差,并提高了PRFSMI 的实时性和鲁棒性。Gellermann等采用外部参考源的方式进行热疗过程的温度检测,将温度测量误差降到了2 ℃。Svedin等将自由感应衰减相位引导回波插入到三维分段回波平面成像序列中,以修正每个K空间数据,进而修订温度成像信息。
消除生理运动造成的温度测量影响最直接的方法是缩短数据采集时间。Todd 等分别采用快速梯度回波和单次激励多行采样的方法消除生理运动对温度测量的影响均取得一定的效果。Svedin 等则采用径向或螺旋等非笛卡尔模式进行K 空间数据采集,以获得增强运动抑制鲁棒性和高效率。Peng 等采用同时多切片磁共振成像方式将数据采样速度提高了3~4倍。上述方法最大的挑战在于它们本质上都是采用迭代的方式计算,无法实现磁共振温度成像的实时应用。
PRFSMI 是目前研究最多,同时也是应用最广泛的温度成像方式,然而其存在的多种组织类型差异、主磁场漂移、磁化率、生理运动等干扰因素,致使其至今在温度精度及时空分辨率尚无法满足临床应用的要求。
1.2 纵向弛豫时间(T1)温度成像
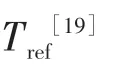
图2 T1弛豫时间随温度的变化
1.3 横向弛豫时间(T2)温度成像
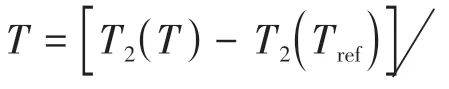
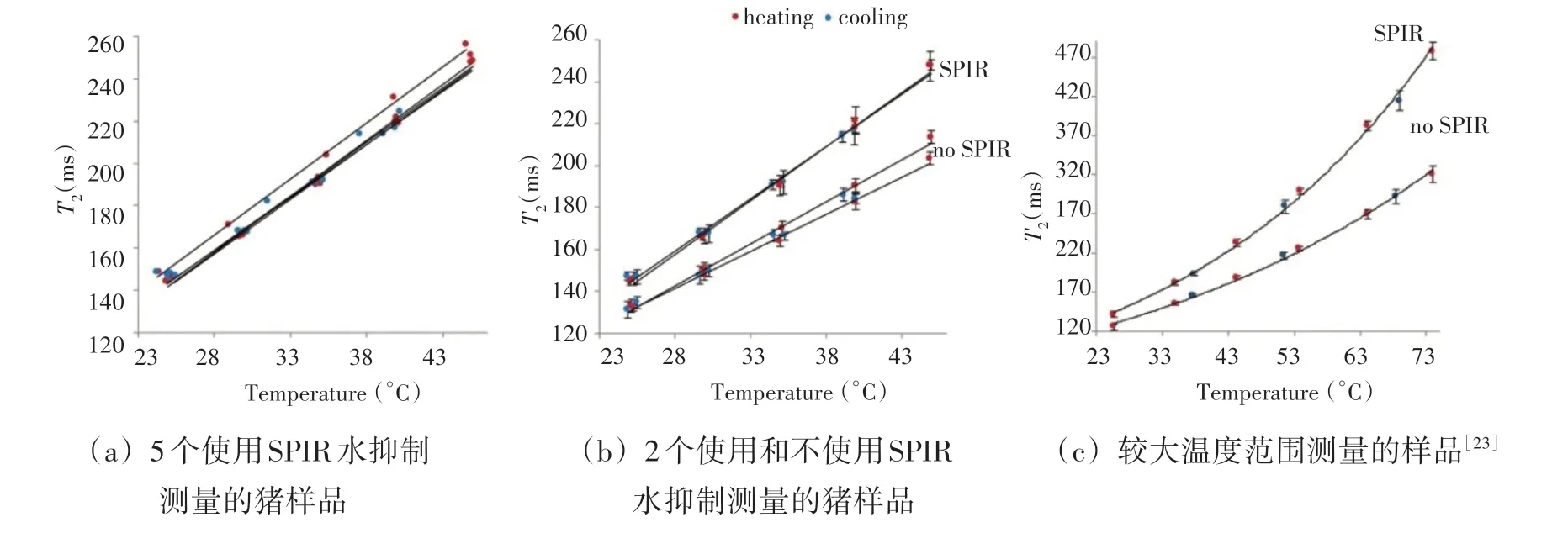
图3 加热和冷却过程中,T2弛豫时间随温度的变化
1.4 质子磁共振波谱(MRS)温度成像
质子磁共振波谱温度成像(PMRSTI)方法是利用频谱中不同组织成分的质子峰分离(化学频移)是温度的函数这一原理进行温度信息的获取,与前述方法不同,该方法获取的是绝对温度信息。目前存在有不同的波谱成像方法,如单体素波谱成像,回波平面光谱成像(EPSI),以及线扫描回波平面波谱成像。但由于波谱成像需要在MRI 图像增加一个维度,因此通常速度相对很慢,分辨率相对较低。3~4 mm 的空间分辨率和大约1 分钟的时间分辨率已被证明。需要注意的是,波谱成像方法可能对体素内场不均匀性敏感,影响波谱宽度,使确定峰位变得困难。可以通过增加空间分辨率(获取较小的体素)来缓解不均匀性影响,但代价是需要提高SNR 或扫描时间。提高场强也可能获得良好的时间稳定性和空间均匀性,甚至可用内部参考可靠地检测一些微弱的代谢信号。但在PMRSTI 中,需要复杂的后处理步骤。而且,尽管波谱温度成像省去了对比参考图像,但参考刻度依然需要。另外水信号和参考信号之间的化学移位差的绝对值可能受组织位置和参数的影响(图4)。然而,它确实为潜在的绝对温度测量提供了独特的工具。
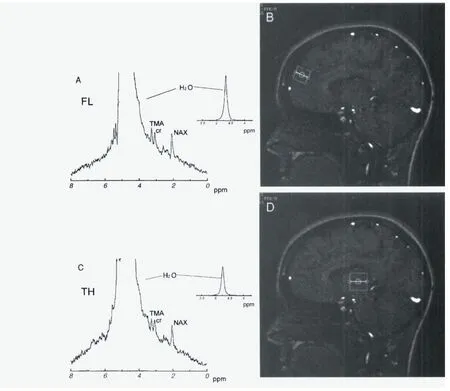
图4 人类大脑的1H磁共振图像和光谱
1.5 温度敏感造影剂温度成像
与PMRSTI一样,温度敏感造影剂温度成像(sensitive contrast agent temperature imaging,SCATI)也是获取绝对组织温度,利用了各种脂质体、自旋分子材料和顺磁镧系稀土化合物的热敏感特性获取温度信息。
顺磁性镧系化合物表现出比质子要高得多的温度依赖性,实验证明其化学移位比水中的质子大300 倍。因此,这类镧系的化合物对于高精度、高分辨率、温度变化较小的应用特别适宜。这类化合物的最大问题是其化学移位与pH 值和钙的含量有一定的关系。Hekma⁃tyar 等对基于铥的化合物TmDOTMA-研究发现其化学移位约为水质子的60倍,并且与pH值和钙无关。因此,基于顺磁性镧系化合物表现出非常好的技术前景。
2 磁性纳米粒子温度成像方法
磁性纳米粒子温度成像(MNPTI)的优势在于其产生的与温度相关的宏观磁化矢量要远高于同等激励下氢原子的宏观磁化矢量,相对于磁共振测温更容易获取高精度的温度测量。Reeves和Perreard 等分别采用幅值、频率扫描的方法测量弛豫时间,然后通过布朗方程计算出温度信息,精度可达0.3 ℃和0.42 ℃。近几年,刘文中团队在磁性纳米粒子温度测量方面做了很多工作,目前已经掌握了磁性纳米粒子有效弛豫时间及交流磁化强度奇次谐波进行温度测量的方法,同时,通过理论与实验研究明确了不同频率低频场下磁流体团聚分离温度点,可消除测量中因磁流体团聚带来的误差。分析了磁性纳米粒子温度测量硬件系统的误差源,通过仿真与实验确定系统参数,使得当信号交流偏置率在80 dB 时,测量误差小于0.1 K。通过增加交流激励信号采样反馈,减小功率放大器的非线性波动,从而获取稳定的测量信号。实验表明系统响应波动小于0.04%。
3 结语
通过对上述不同温度成像方法的总结,可以得出表1 所示的上述各种温度成像方法的对比。可以发现质子共振频移、纵向弛豫时间和横向弛豫时间温度成像方式获取的都是相对于标定温度变化信息,而非被测对象的绝对温度。质子磁共振波谱、温度敏感造影剂和磁纳米粒子温度成像方式获取的是被测对象的绝对温度。但就目前而言,上述方法在细胞尺寸温度信息获取方面均需进一步完善。
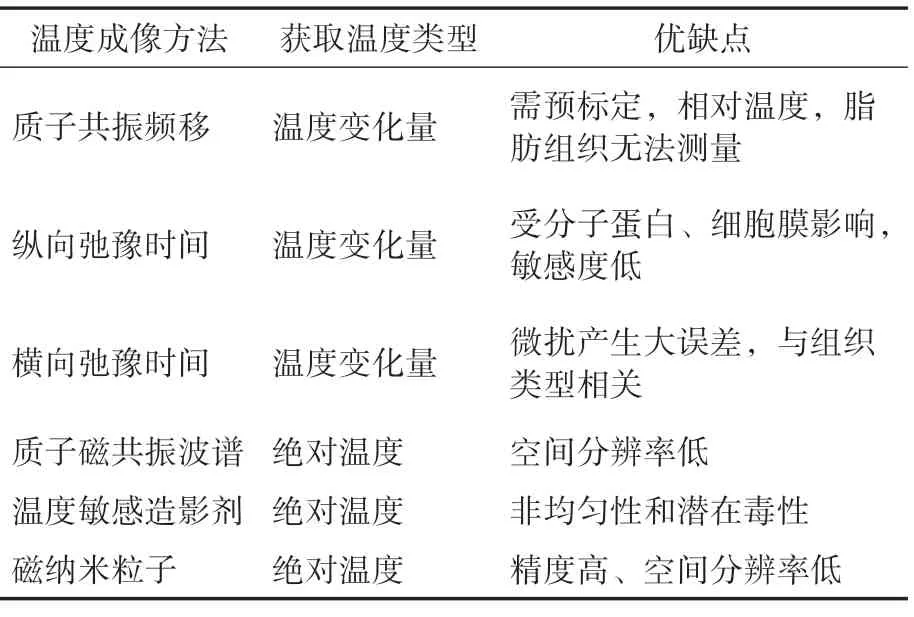
表1 磁学温度成像方法对比
上述磁学温度成像技术在温度测量精度和空间分辨率单一尺度实现了较高的分辨率,但实现细胞尺寸(0.1℃@10 μm)分辨率温度成像还需进一步探究。其中,基于超顺磁性纳米粒子的温度成像技术最具研究潜力,超顺磁纳米粒子是目前已知最高效的磁温敏感材料,信号强度相比氢质子提高3~6个数量级,具备0.1℃以上分辨率。针对微米尺度目标定位问题,研究人员指出,加大梯度磁场后,在零磁场点周围可以形成一种微米尺度的等磁场封闭结构,通过该磁场内对应的磁共振频率便可实现共振定位。如10 T/m梯度场中,零磁场点(FFP)附近1 高斯等位面将坍缩为10 μm 的椭球面。即微米尺度的目标定位是可实现的。简而言之,基于超顺磁性纳米粒子的温度成像技术具备实现细胞尺寸分辨率温度成像的潜力。随着温度成像技术研究的深入发展,细胞尺寸分辨率温度成像有望为生物医学发展做出巨大贡献。

