稳定表达CYP2A13和CYP2A13/POR的Flp-In CHO重组细胞系的构建
孙 莉,陆定艳,刘 欢,何俊奇,孙 佳,王永林,李勇军,杨 畅,刘 亭
(1. 贵州医科大学贵州省药物制剂重点实验室/省部共建药用植物功效与利用国家重点实验室,贵阳 550004;2. 贵州医科大学药学院,贵阳 550025;3. 贵州医科大学民族药与中药开发应用教育部工程研究中心, 贵阳 550004)
细胞色素P450家族2亚家族A成员13(cytochrome P450 family 2 subfamily A member 13,CYP2A13)在肺、支气管等人呼吸道组织中特异性表达。由于CYP2A13可以高效代谢活化4-甲基亚硝胺-1-3-吡啶基-1-丁酮[4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone,NNK]、黄曲霉毒素B1(aflatoxin B1,AFB1)等前致癌物,从而使其产生致癌性,不少研究认为CYP2A13与肺癌的发生密切相关[1-2]。因此,构建一个稳定表达CYP2A13的细胞系,并利用此细胞系筛选能被CYP2A13代谢活化的前致癌物,对肺癌的预防具有重要意义。目前,已报道的CYP2A13的外源表达系统主要是细菌表达系统和昆虫细胞表达系统[3-4]。细菌作为原核生物,其蛋白翻译后的折叠和修饰过程过于简单,因此表达的蛋白与哺乳动物蛋白结构相差较多,会造成所表达的CYP450酶活性缺失。此外,CYP2A13的细菌和昆虫细胞表达系统主要是用于体外代谢实验[5],不能直接用于基于细胞毒的毒物筛选。因此,本文拟构建稳定表达CYP2A13的中国仓鼠卵巢细胞(chinese hamsters ovary,CHO),以达到既能表达CYP2A13蛋白供体外代谢实验用,又能在细胞水平上筛选前致癌物的目的。
细胞色素P450氧化还原酶(NAPDH-cytochrome P450 oxidoreductase,POR)是细胞色素P450家族发挥活性的重要蛋白,可将NAPDH的两个电子传递给CYP酶,使其发挥代谢活性[6-7]。研究表明,细菌表达系统和昆虫细胞表达系统只有在双表达POR和CYP450酶的条件下,CYP450酶才能发挥代谢活性[5]。但是,CHO是否需要共表达POR尚未有相关研究报道。因此,本文采用操作简单、易于筛选的Flp-In CHO细胞,构建稳定表达CYP2A13的CYP2A13-CHO细胞和稳定表达CYP2A13和POR的CYP2A13-POR-CHO细胞,并从中筛选代谢活性较好的细胞系,为体外研究CYP2A13代谢活化的前致癌物提供有利的研究工具。
1 材料与方法
1.1 材料
1.1.1细胞 Flp-In CHO细胞株由浙江大学陈枢青教授赠送;POR-Flp-In CHO由课题组构建保存。
1.1.2主要试剂 pcDNA5/FRT载体由浙江大学陈枢青教授赠送;Ham′s F12培养基(8120286)、胰蛋白酶(1917558)购自Gibco公司;TRIzol试剂(204203)购自Ambion公司;胎牛血清(FBSCN00419-2)购自AusgeneX公司;潮霉素B(H044-57US)、LipofectamineTM2000(2173562)购自Invitrogen公司;二辛可宁酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(20190910)、牛血清白蛋白Ⅴ(bovine serum albumin,BSA)(A8020)、ECL Plus超敏发光液(27A069)、RIPA裂解液(MA0151-Dec-18E)购自索莱宝公司;辣根过氧化物酶标记的山羊抗兔IgG(ab205718)、辣根过氧化物酶标记的山羊抗小鼠IgG(ab6789)、兔抗CYP2A13多克隆抗体(ab135703)、小鼠抗GAPDH单克隆抗体(ab8245)购自Abcam公司;AFB1(2J0I16)购自青岛普瑞邦生物工程有限公司;NNK(BCCB1513)购自Sigma公司;PVDF膜(R7CA8782A)购自Millipor公司;pcDNA5/FRT-CYP2A13由北京博迈德基因技术有限公司合成;荧光定量试剂盒TB GreenTMPremix Ex TaqTMⅡ(AK81979A)、逆转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser(AJ91603A)购自TaKaRa公司;水溶性四甲基偶氮唑盐(3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium,MTS)(0000408248)购自上海普洛麦格生物产品有限公司;PCR引物由上海恒英公司合成,引物如下:GAPDH上游物为5′-CATCATCTCCGCCCCTTCTG-3′,下游引物为5′-CATGGACCGTGGTCATGAGT-3′;CYP2A13上游引物为5′-CCTGGTGATGACCACCC-3′;下游引物为5′-CGTGGATCACTGCCTCTG-3′。
1.1.3仪器 细胞培养箱(美国Thermo Fisher Scientific公司); 低温高速离心机(美国Thermo Fisher Scientific公司);多功能酶标仪(美国Thermo Fisher Scientific公司);蛋白快速转印仪(美国Bio-Rad公司);凝胶成像仪(美国Bio-Rad公司);电泳仪(美国Bio-Rad公司);垂直电泳槽(美国Bio-Rad公司);倒置荧光显微镜(日本Nikon公司)。
1.2 方法
1.2.1细胞培养及处理 用含10%胎牛血清的Ham’s F12完全培养基,在37 ℃、5% CO2的恒温培养箱中培养。细胞达到80%汇合度时,胰蛋白酶消化传代,传代比例为1 ∶3。
1.2.2CYP2A13-CHO和CYP2A13-POR-CHO细胞系构建 取对数生长期的Flp-In CHO和POR-Flp-In CHO细胞,用完全培养基将细胞稀释至1.5×108个·L-1,以2 mL/孔接种于6孔板中,置于37 ℃、5% CO2恒温培养箱中培养24 h。待细胞汇合度达到70%时,用0.25 μg pcDNA5/FRT-CYP2A13质粒(同时以不含CYP2A13基因的pcDNA5/FRT空载体作为阴性对照)及2.25 μg辅助质粒pOG44与8 μL LipofectamineTM2000混合液转染细胞。转染48 h后,向培养基中加终浓度为500 mg·L-1的潮霉素B进行阳性克隆的筛选。
1.2.3qRT-PCR检测CYP2A13 mRNA表达水平 利用RNA裂解液TRIzol将细胞充分裂解,提取细胞总RNA并逆转录成cDNA。qRT-PCR反应体系:2 μL cDNA,10 μmol·L-1上下游引物各1 μL,12.5 μL TB GreenTMPremix Ex TaqTMⅡ。反应条件: 95 ℃预变性5 min,(94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s)×40个循环。以GAPDH为内参,通过2-ΔΔCt法进行数据分析。
1.2.4Western blot检测CYP2A13蛋白表达水平 利用RIPA裂解液提取总蛋白并用BCA试剂盒进行蛋白浓度测定。取20 μg蛋白样品变性后进行SDS-PAGE,然后在蛋白转印仪的作用下,恒压25 V、30 min将蛋白转移到PVDF膜上。室温下5% BSA封闭3 h,一抗(兔抗CYP2A13多克隆抗体,稀释度1 ∶200;小鼠抗GAPDH单克隆抗体,稀释度1 ∶5 000)于4 ℃孵育过夜。1× TBST洗膜后,分别加入二抗(辣根过氧化物酶标记的山羊抗兔IgG或辣根过氧化物酶标记的山羊抗小鼠IgG,1 ∶2 000),室温下孵育2 h。1× TBST洗膜后,将ECL Plus超敏发光液均匀滴加在PVDF膜上避光反应1 min,然后放入凝胶成像仪中显影曝光。使用Quantity One软件进行灰度值分析,以目的蛋白与内参GAPDH条带灰度值的比值作为目的蛋白的相对表达量。
1.2.5MTS法测定AFB1、NNK对CYP2A13-CHO细胞、CYP2A13-POR-CHO的细胞毒性 取对数生长期的Flp-In CHO空白细胞(CHO)、Flp-In CHO空载体细胞(vehicle-CHO)、CYP2A13-CHO细胞和CYP2A13-POR-CHO细胞,用完全培养基将上述4种细胞分别稀释至密度为1.0×108个·L-1,以100 μL/孔接种到96孔板中培养24 h后,加入AFB1(0、20、30、40 μmol·L-1)和NNK(0、40、80 μmol·L-1)的完全培养基。药物作用24 h后,弃去含药培养基,每孔加入100 μL无血清培养基和5 μL的MTS,继续培养2.5 h后,用酶标仪在490 nm处检测各孔的吸光度值(A),按照公式计算存活率。存活率/%=(A给药-A培养基/A空白-A培养基)×100%。
2 结果
2.1 CYP2A13-CHO、CYP2A13-POR-CHO的CYP2A13的表达水平明显升高相比于CHO和vehicle-CHO祖细胞,CYP2A13-CHO细胞和CYP2A13-POR-CHO细胞的CYP2A13 mRNA和蛋白表达水平均升高(Fig 1, 2)。
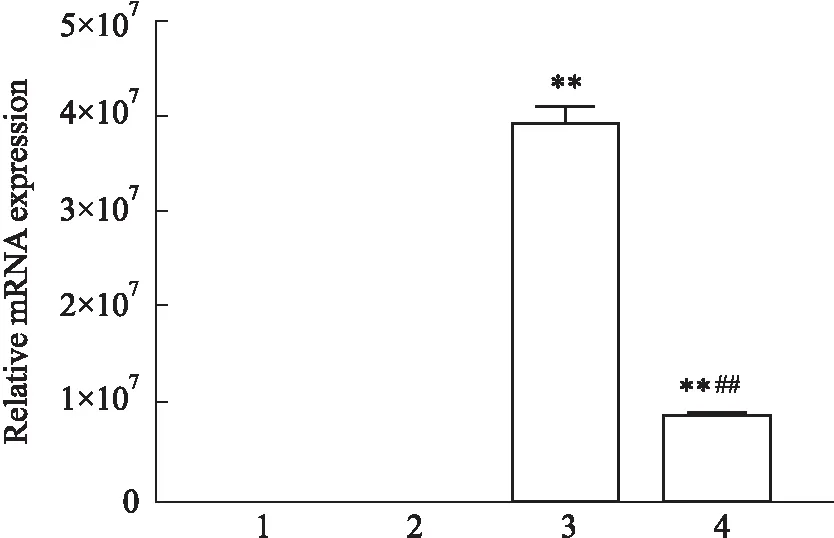
Fig 1 The mRNA expression of CYP2A13 in different groups n=3 )
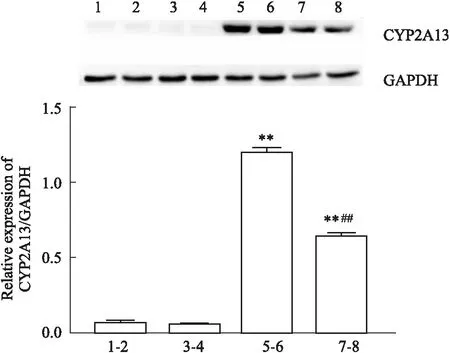
Fig 2 The protein expression of CYP2A13 in different groups n=3)
2.2 NNK、AFB1对CYP2A13-CHO和CYP2A13-POR-CHO细胞具有较强毒性作用各浓度的AFB1、NNK对CHO和vehicle-CHO没有杀伤作用。但是,在AFB1和NNK作用下,CYP2A13-CHO和CYP2A13-POR-CHO的存活率都明显降低。相同给药浓度下,AFB1和NNK对CYP2A13-CHO的杀伤作用明显强于CYP2A13-POR-CHO细胞(Tab 1,2)。
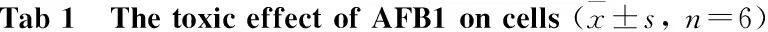

3 讨论
肺癌的发病率和死亡率均位居第一,已成为危害人类健康的重大疾病之一[8-9]。研究表明,CYP2A13作为一种在气管和肺粘膜中选择性表达的CYP450酶,可高效代谢AFB1和NNK等前致癌物,与肺癌的发生密切相关[1-2,10-11]。因此,构建一个筛选能被CYP2A13代谢活化的前致癌物的工具至关重要。
Flp-In CHO是将FRT位点植入到CHO细胞染色体改造而来的细胞株,只需运用特殊的载体(pcDNA5/FRT)就可将所转染的cDNA定点整合到FRT位点,从而保证了所转染的外源基因具有相同的表达效率[12]。因此该细胞株只需通过潮霉素B的压力筛选,即可得到稳定且均一表达的转染细胞系,省去了筛选单克隆的时间,大大提高了效率[13-14]。课题组前期通过慢病毒转染,已成功构建稳定表达POR的POR-Flp-In CHO细胞系。因此,本研究在课题组前期研究的基础上,分别构建了CYP2A13-CHO和CYP2A13-POR-CHO两种体外重组细胞系,并比较了两者的代谢活性。
本研究发现AFB1和NNK均可对CYP2A13-CHO和CYP2A13-POR-CHO两种细胞系产生毒性作用,且CYP2A13-CHO对NNK、AFB1的敏感性高于CYP2A13-POR-CHO。POR是一个定位于内质网膜上重要的黄素蛋白[15],其可将NAPDH的电子转移至肝微粒体细胞色素P450氧化酶,是CYP450酶的唯一电子供体,在CYP450对底物的代谢活化过程中起着必不可少的作用[16-17]。CYP2A13只有在POR提供电子的前提下才能发挥代谢活化前致癌物的作用。但有趣的是,本研究发现单转染CYP2A13的细胞系的代谢活性反而要高于双转染CYP2A13/POR细胞系的代谢活性。
有研究发现大鼠POR蛋白的晶体结构同人的POR蛋白类似,同样可将来自NADPH的电子依次传递给黄素腺嘌呤二核苷和黄素单核苷,最终将电子传递给CYP450酶的亚铁离子,使其对底物产生代谢作用[18]。序列分析表明,中国仓鼠的POR和人POR序列相似,我们推测CYP2A13也可利用CHO表达的POR,从而代谢激活前致癌物NNK、AFB1产生细胞毒性作用。相较CYP2A13-CHO,CYP2A13-POR-CHO转入较多的外源基因(POR和eGFP),对细胞本身产生了较大负担,使CYP2A13的表达量降低,从而导致其对NNK、AFB1的敏感性不高。
综上所述,本研究构建了一株CYP2A13表达较高且活性较好的CYP2A13-CHO细胞系,为筛选CYP2A13代谢激活的前致癌物提供了工具。

