状态性焦虑对小鼠睡眠-觉醒周期的影响
杨 悦,卞宏生,王艳艳,于 爽,李廷利,黄莉莉
(黑龙江中医药大学药学院,黑龙江 哈尔滨 150040)
状态性焦虑是指某一特定情境引起的短暂情绪状态,与交感神经系统活动暂时增强有关[1]。而睡眠与情绪大脑之间存在密切关系,睡眠-觉醒行为通过不同脑区各类核团的相互制约来调控[2]。临床研究表明,患有焦虑症的人出现睡眠障碍症状的风险更高[3],同时睡眠不足将导致状态性焦虑水平增加[4]。Ramos等[5]提出的Triple test装置是将经典的旷场(open field,OF)、高架十字迷宫(elevated plus maze,EPM)和明暗穿梭箱(light/dark box,LDB)物理整合,不仅用于状态性焦虑模型的复制和评价,还可用于药物筛选和检测与焦虑相关的遗传差异[6]。且经本实验室前期研究发现,其复制的状态性焦虑模型小鼠存在明显的探究行为抑制与HPA轴亢进[7],但该模型下小鼠睡眠-觉醒周期的变化尚不明确。为进一步了解状态性焦虑与睡眠-觉醒行为之间的关系,在Triple test装置复制小鼠状态性焦虑模型基础上,利用皮层脑电记录与分析技术观察状态性焦虑对小鼠睡眠-觉醒周期的影响。
1 材料与方法
1.1 实验动物健康雄性ICR小鼠18只,SPF级,体质量(25~30)g,购自黑龙江中医药大学药物安全评价中心。许可证号:SCXK(黑)2013-004。
1.2 实验条件小鼠饲养于独立通气笼(IVC)中,恒定光照条件(早7 ∶00照明,晚19 ∶00熄灯),光照强度:300 lux。室温:(23±1) ℃,相对湿度:(55±5)%。按体质量分笼饲养(6只/笼)并自由摄取食水。
行为测试环境:相对湿度:(55±5)%;环境温度:(22±2) ℃;环境噪音≤ 40 dB;实验期间,所有光照均来自Triple Test实验装置的光源,光照强度:LDB明箱:750 lux,LDB暗箱:20 lux,EPM:15 lux,OF:10 lux
屏蔽室监测环境:恒温(24±1) ℃、恒湿(55±10)%、恒定光照条件(早7 ∶00照明,晚19 ∶00熄灯)的屏蔽室中进行,监测环境通气、隔音。
1.3 主要仪器设备RU25H5型独立通气笼IVC(苏杭科技器材有限公司);51600型小鼠脑立体定位仪(美国Stoelting公司);MP150型十六导生理信号记录仪(美国BIOPAC公司);三重复合装置(自制;Triple test)。
1.4 状态性焦虑小鼠模型复制与行为学评价
1.4.1状态性焦虑小鼠模型复制 Triple test实验装置[6]由OF、EPM、LDB整合而成(Fig 1),OF由白色木板构成包括55 cm(L)×55 cm(W)的底板(等分为25个方格,中央区9格,周边区16格)和30 cm(H)的围墙。EPM由黑色木板构成,包括5 cm(L)×30 cm(W)×15 cm(H)的相对闭臂和5 cm(L)×30 cm(W)的相对开臂,开臂有0.5 cm防掉落的边缘突起,EPM闭臂两侧分别通过5 cm×5 cm的开口连通OF和LDB。LDB由白板和黑板构成,包括27 cm(L)×27 cm(W)×27 cm(H)的明箱和27 cm(L)×18 cm(W)×27 cm(H)的暗箱,分隔明暗两侧的是27 cm(W)×30 cm(H)的隔板,隔板底部中央有5 cm×5 cm的开口可连通。整个装置提升至距离地面0.5 m。

Fig 1 Triple test
制备方法:模型于每日13 ∶00-18 ∶00进行。将实验动物提前30 min分单笼置于Triple Test装置所在环境中适应。实验开始时,提取鼠尾,将实验动物置于OF正中央格背朝OF开口一侧释放同时开始计时,每只动物自由探索装置15 min。实验结束后取出实验动物,放回原笼,运回饲养室,并用10%酒精清洁箱体,去除异味及动物排泄物。
1.4.2行为学评价指标及判断标准 通过录像采集或计算每只小鼠在Triple test装置中15 min的如下行为参数:
OF:中央格运动时间(OF inner time):
四肢全部进入到中央9格区的总时间
中央格运动时间%(OF inner time %):
EPM:开臂停留时间(EPM open time):
四肢全部进入开臂的总时间
开臂停留时间%(EPM open time %):
开臂进入次数(EPM open entries):
四肢全部进入开臂的频次之和
开臂进入次数%(EPM open entries%):
LDB:明箱停留时间(LDB time in light):
四肢全部进入明区的总时间
暗箱停留时间(LDB time in black):
四肢全部进入暗区的总时间
明箱停留时间%(LDB time in light %):
穿梭运动次数(LDB transitions):
四肢全部从一区跨入另一区频次之和
1.5 小鼠的脑电记录与分析
1.5.1小鼠皮层脑电电极与肌电电极埋置 实验动物先用水合氯醛经腹腔注射麻醉后,将其固定于脑立体定位仪上。用碘酒棉将小鼠头顶浸润消毒。电极埋置:无菌暴露颅骨,酸蚀剂去除组织筋膜,盐水清洁颅骨表面后于前囟前1 mm,额骨中线旁开1.5 mm;人字缝前1 mm,顶骨中线旁开1.5 mm处分别插入2根脑电电极,使接触硬脑膜,并用牙托粉进行固定。术后将小鼠置于有机玻璃笼内单笼饲养恢复1周,自由摄取食水,并连续3 d经腹腔注射青霉素。
1.5.2小鼠脑电图(electroencephalogram,EEG)和肌电图(electromyogram,EMG)分析判断标准 恢复期后小鼠置于屏蔽室,将头部插座与十六导生理记录仪相连,调试设备,描记EEG和EMG信号,Sleep Sign 3.0软件分析(10s/帧),监测指标的记录和判断如下:
(1)觉醒时间(Wake)和觉醒所占比例(Wake%):EEG信号呈现不规则的低幅度高频波动;EMG呈现高幅波动(Fig 2)。
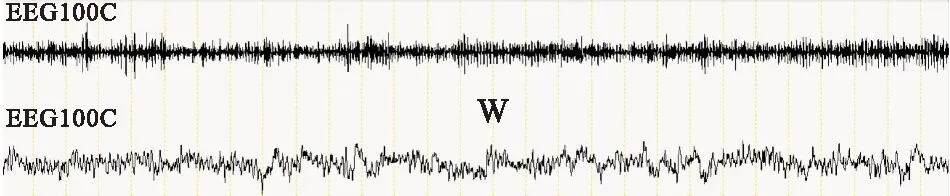
Fig 2 Awakening
(2)非快动眼睡眠时间(NREMS)和非快动眼睡眠时相所占比例(NREMS%):EEG呈现高振幅慢波和特征性的纺锤波;EMG明显减弱(Fig 3)。

Fig 3 Non-rapid eye movement sleep
(3)快动眼睡眠时间(REMS)和快动眼睡眠时相所占比例(REMS%):EEG呈现低幅高频θ波;EMG基本消失(Fig 4)。
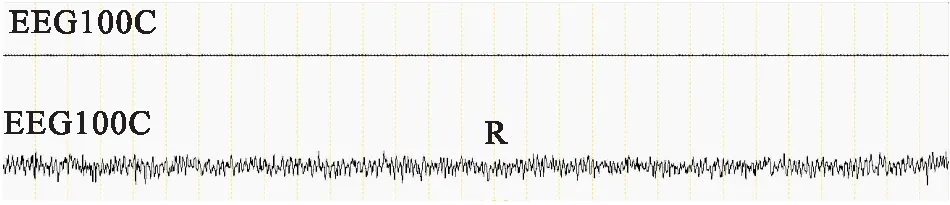
Fig 4 Rapid eye movement sleep
1.6 状态性焦虑小鼠睡眠-觉醒周期的变化实验动物经皮层脑电埋置术后恢复,按上述测试条件,将小鼠移至脑电描记室,连接电极插座,连续描记24 h的EEG和EMG信号,以作为模型复制前脑电图的基线对照。脑电图描记后次日的13:00进行小鼠状态性焦虑造模(d 1),每只鼠测试15 min,测试完成后再次连接十六导生理记录仪,连续描记24 h的脑电图。每日1次,连续7 d。

2 结果
2.1 状态性焦虑小鼠的行为学评价
2.1.1状态性焦虑小鼠OF中的行为学变化 结果见Fig 5。OF中行为学评价结果表明,与造模d 1相比,状态性焦虑小鼠OF中央运动时间d 4、5、7明显减少(P<0.05;P<0.01),OF中央运动时间% d 3-5明显降低(P<0.05;P<0.01),呈现OF中探究行为的抑制。

Fig 5 Time and its % time spent in central area of OF
2.1.2状态性焦虑小鼠EPM中的行为学变化 结果见Fig 6。EPM中行为学评价结果表明,与造模d 1相比,状态性焦虑小鼠开臂进入时间及时间%、开臂进入次数及次数%均呈逐日上升趋势,d 4开始均具显著变化(P<0.01)。
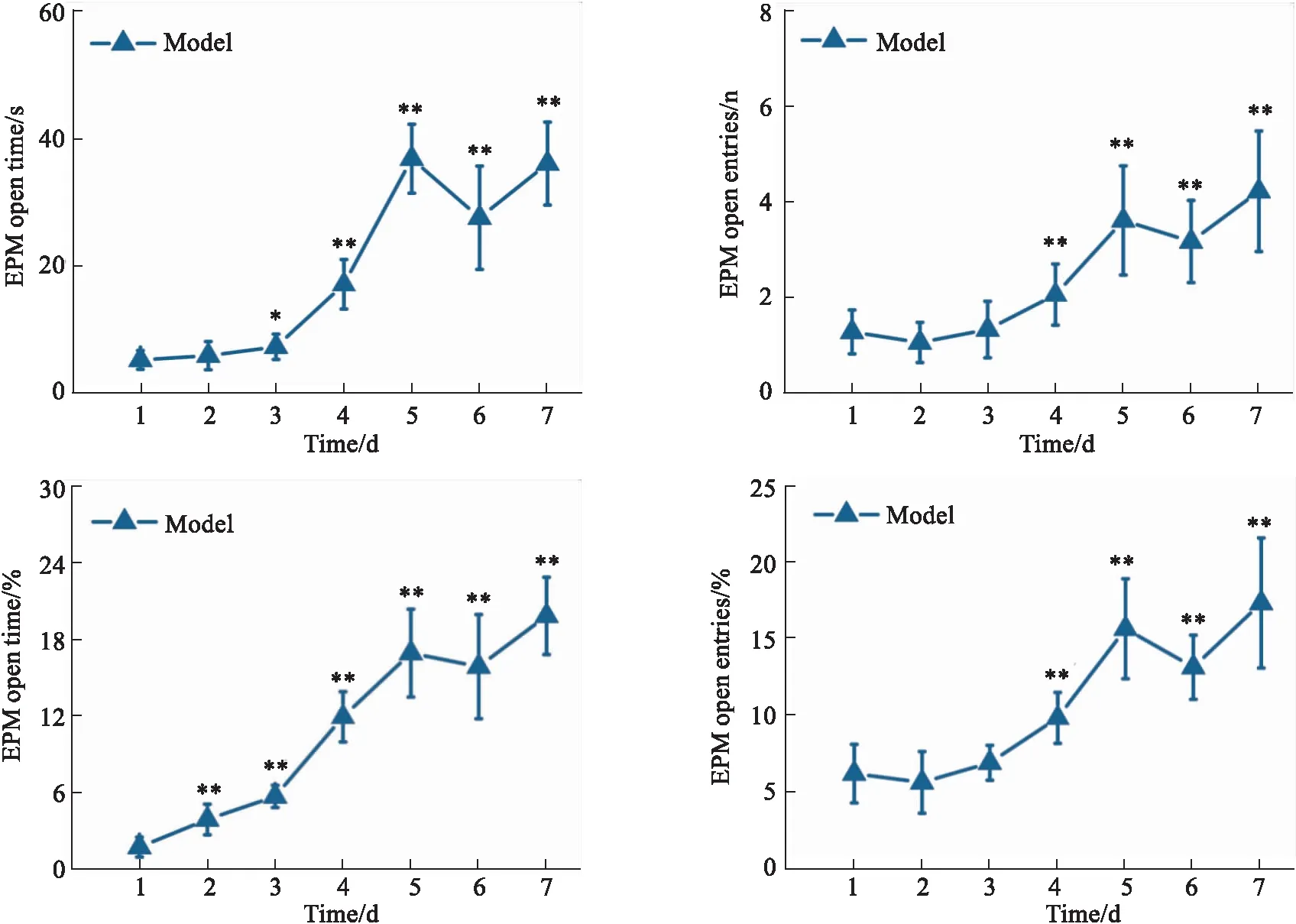
Fig 6 Time and its % time spent in open arms of EPM, number of open arm entries and its % entries n=18)
2.1.3状态性焦虑小鼠LDB中的行为学变化 结果见Fig 7。LDB中行为学评价结果表明,与造模d 1相比,状态性焦虑小鼠明箱运动时间及时间%、穿梭运动次数在d 5~7均明显增加(P<0.05,P<0.01)。暗箱运动时间于d 2(P<0.01)、d 4(P<0.05)明显增加。
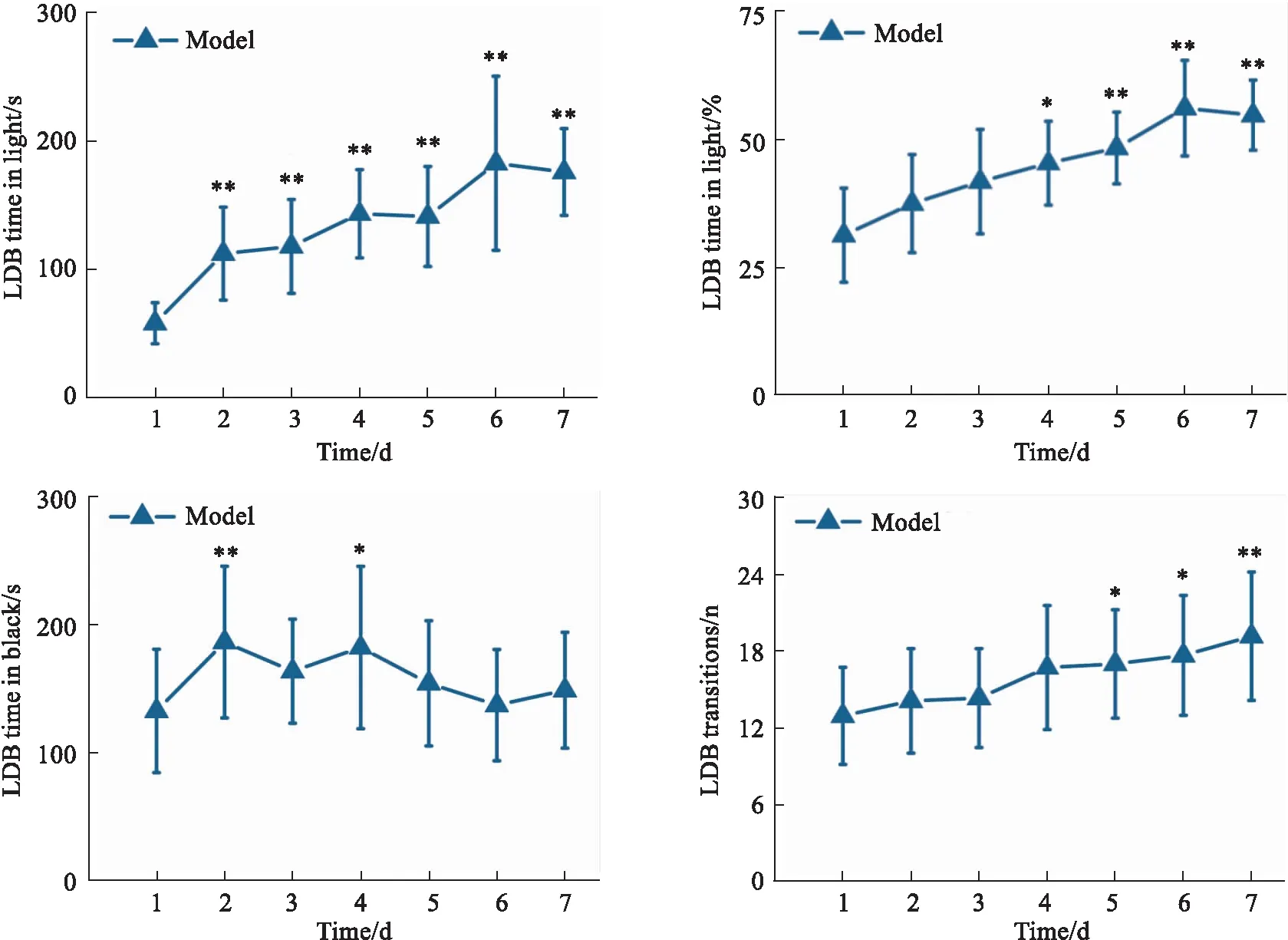
Fig 7 Time spent and frequency of transitions of LDB n=18)
2.2 状态性焦虑小鼠睡眠-觉醒周期的变化
2.2.1状态性焦虑小鼠睡眠-觉醒时间的变化 结果见Fig 8。脑电图分析结果表明,与基线睡眠相比,状态性焦虑小鼠Wake时间明显延长,同时NREM睡眠时间明显缩短(P<0.05,P<0.01),REM睡眠时间偶见明显延长(P<0.05)。且相比于夜间,日间觉醒-睡眠时间的改变更加明显。
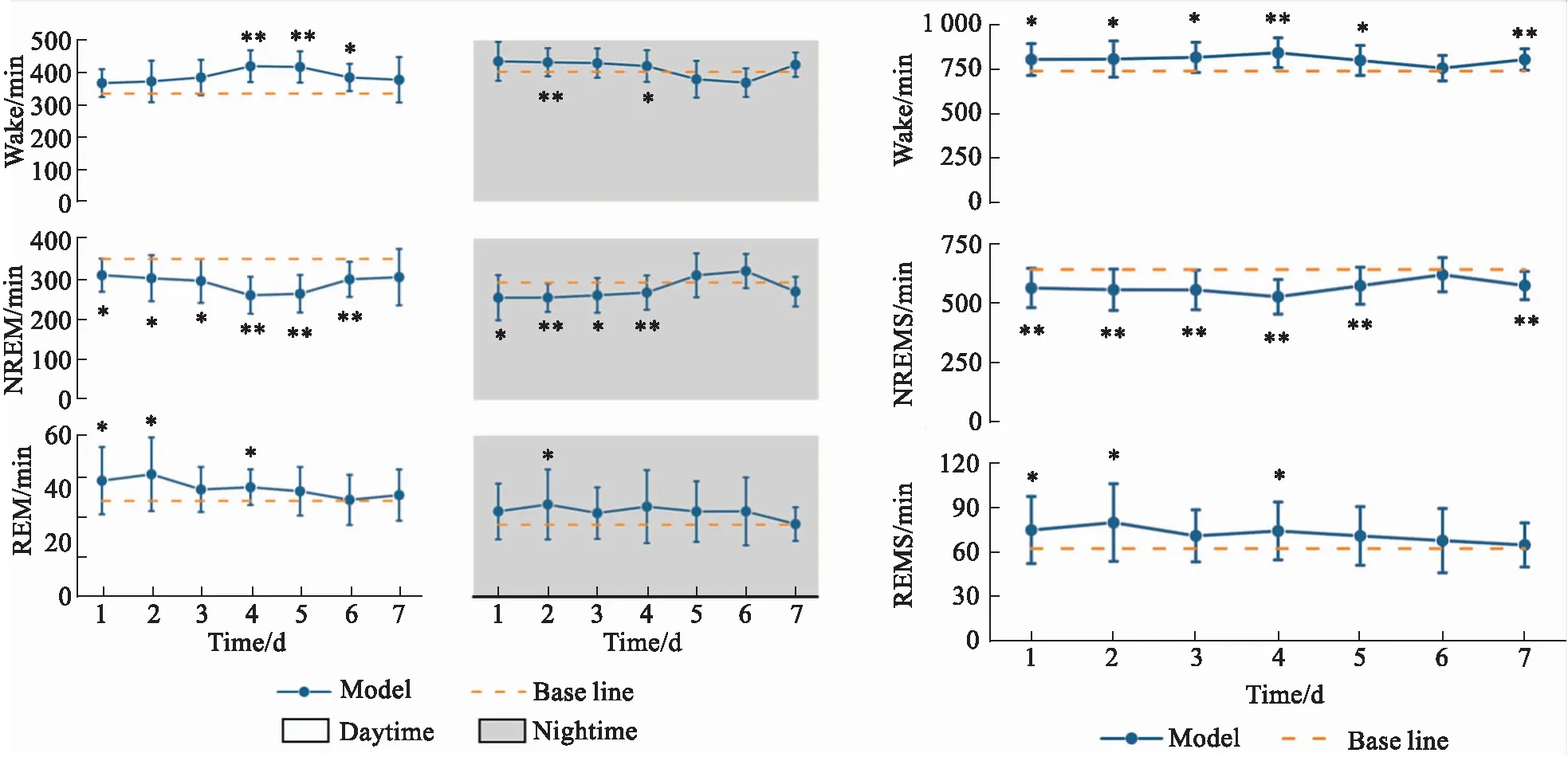
Fig 8 Changes in awakening-sleep time in mice with state n=18)
2.2.2状态性焦虑小鼠觉醒-睡眠时相的变化 结果见Fig 9。脑电图分析结果表明,与基线睡眠相比,状态性焦虑小鼠Wake时间比例明显增加,同时NREMS时间比例明显下降(P<0.05,P<0.01),REMS时间比例偶见明显升高(P<0.05)。且相比于夜间,日间觉醒-睡眠时相的改变更加明显。

Fig 9 Changes in awakening-sleep phase in mice with state anxiety n=18)
3 讨论
焦虑症和睡眠障碍之间往往存在着紧密联系,失眠是广泛性焦虑症的一个症状标准,且睡眠不足可能赋予患焦虑症及相关疾病的风险[8-9]。课题组前期研究发现,Triple test装置复制的状态性焦虑小鼠呈现明显的焦虑样行为伴有HPA轴失调,但未对状态性焦虑小鼠的睡眠活动进行监测。因此,本实验应用Triple test装置复制小鼠状态性焦虑模型,同时进行脑电图描记,探讨状态性焦虑对睡眠-觉醒周期的影响。
焦虑动物模型的复制方法诸多,在非条件化动物模型中OF、EPM和LDB最为常见,当前的观点认为围绕OF、EPM、LDB间焦虑指标的相互关系很少,行为变量的主成分分析体现在不同的因素上,表明不同测试反映了情感的不同维度,那么应用单独的测试来评估情绪是不够全面的,而一系列不同的测试又存在先前测试经验对后续测试的影响[10]。Triple test作为经典的焦虑测试装置的集成,实现了同时进行情绪的多维度考察,最大程度减轻了相继测试所致的混淆影响,还可与运动活性的变化区分开,被证明是一种焦虑和一般活动性的可靠测量方式[6-7]。本研究发现,状态性焦虑小鼠呈现明显的探究性行为抑制,表明Triple test可复制和评价小鼠的状态性焦虑模型,且前4 d表现更多的焦虑样行为。
脑电图是客观反映睡眠架构的重要指标,是国际公认的评价参数[11],可用于睡眠-觉醒周期的分析。焦虑对睡眠的影响多体现在睡眠时长、睡眠连续性、睡眠深度和REM睡眠压力的改变[8]。相关报道指出,高焦虑个体往往存在睡眠深度的抑制,而NREM睡眠对于抵抗焦虑症的发展至关重要[12-13]。研究在模型复制基础上探讨了焦虑与睡眠之间的关系,得知状态性焦虑小鼠伴有觉醒-睡眠时间和睡眠时相的改变,表现为约束小鼠的睡眠时长和睡眠深度及REM睡眠压力的偶见升高,且指标上看对日间睡眠的影响更加明显。
另外,经查阅文献得知基底外侧杏仁核(BLA)和中央杏仁核(CeA)在焦虑过程中起着特别重要的作用。BLA与内侧前额叶皮层(mPFC)的交互连接与焦虑密切相关[14],BLA接收来自丘脑和前额叶皮质的感觉信息传入,激活CeA后向脑内不同靶区进行投射,从而呈现不同的焦虑样反应[15]。目前认为杏仁核可以驱动觉醒中枢兴奋,而在睡眠-觉醒状态的调节过程中食欲素(orexin,包括orexin-A和orexin-B)发挥重要作用,它是由下丘脑外侧区orexins神经元释放的神经递质,可作用于上行网状激活系统,使睡眠缩短而觉醒程度增加[16]。研究发现,脑室内灌注orexin-A可引起焦虑样行为,表现为OF的中央运动时间和EPM开臂时间减少[17]。而orexin缺乏会减弱谷氨酸能激活下丘脑外侧区产生的唤醒行为[18]。因此,推测焦虑引起的睡眠-觉醒周期的改变可能与杏仁核驱动的下丘脑外侧区释放orexin增加有关。为今后探讨相关机制丰富理论基础,且作为初步研究与状态性焦虑和睡眠-觉醒周期相关的药效学研究有待进一步开展。

