肉桂醛调控CD44s/STAT3信号通路抑制胰腺癌细胞增殖和肿瘤细胞干性
朱素丽,陈运昊,姚尖平,周兴旺
(中山大学 1.中山医学院生化与分子生物学教研室、 2.附属第一医院检验科、 3.附属第一医院心外科, 广东 广州 510080)
胰腺癌(pancreatic cancer,PC)恶性程度高,预后极差,具有发病隐匿、早期诊断困难、进展快、转移早等特点,5年整体生存率不到10%[1]。2020年的数据统计表明,胰腺癌全球范围内的发病人数为49.6万,而死亡人数就已经达到46.6万,几乎与发病人数相当,已经成为癌症死亡的第7大原因[2]。目前,手术切除是唯一可能的治愈手段,但仅20%的患者可接受手术,且超过80%的患者术后复发。大部分患者发现病情时已发生转移,而对于晚期患者,主要采取的是全身化疗联合方案,但这也仅将患者的生存期延长6~12个月[3]。已有许多研究表明,肿瘤干细胞(cancer stem cells,CSCs)是导致PC易转移复发和易耐药的重要原因[4]。因此,研究发展不仅能够抑制普通胰腺癌细胞,更能有效抑制胰腺癌干细胞的新治疗策略至关重要。
肉桂醛(cinnamaldehyde,CA)是主要来源于樟科植物肉桂的一种醛类化合物,为黏稠状黄色液体,自然界存在的肉桂醛均为反式结构。现有研究表明,肉桂醛具有防治糖尿病、抑菌、抗病毒、抗癌等多种药理活性,尤其是在抗结直肠癌方面,具有抑制细胞增殖、诱导凋亡、逆转上皮间质转化等作用[5],被认为是一种具有抗癌活性的天然分子。然而CA是否也能抑制胰腺癌生长尚不清楚。
CD44作为细胞外成分的重要受体,广泛参与肿瘤细胞黏附、增殖、迁移等过程,在胰腺癌中,CD44的标准亚型即CD44s与肿瘤细胞干性密切相关,CD44s高表达被认为具有促进肿瘤转移复发的作用,可作为胰腺癌细胞干性标志物[6]。转录激活因子3(STAT3)在调节癌细胞生长和存活方面至关重要,CD44s可激活STAT3的磷酸化,维持肿瘤干细胞自我更新和多向分化潜能,因此,抑制CD44s/STAT3信号通路是抑制胰腺癌生长和干性的途径之一[7]。本研究首次发现肉桂醛可显著抑制胰腺癌细胞PANC-1的生长增殖,在此基础上还研究了其对胰腺癌细胞干性的抑制作用,以及对相关的CD44s/STAT3信号通路的影响。
1 材料与方法
1.1 材料
1.1.1细胞株 胰腺癌细胞PANC-1购自 American Type Culture Collection(ATCC)。
1.1.2药物与试剂 反式肉桂醛,购于上海源叶生物有限公司(批号H02M6Q1,检测纯度≥99%);高糖DMEM细胞培养基、胎牛血清(FBS)、胰蛋白酶及青霉素-链霉素购于美国Thermo 公司;Cell Counting Kit-8(CCK-8试剂)购于日本同仁研究所(Dojindo);1%结晶紫(批号V5265)、DMSO(批号D2650)购于美国Sigma公司;CFSE染色试剂盒(批号C34554)购于美国Invitrogen;EGF(批号78016)、b-FGF(批号78003.1)、B27(批号05711)、ALDEFLUORTMKit(批号01700)以及DMEM/F12干细胞培养基(批号36254)购于加拿大干细胞技术有限公司(STEMCELL Technologies);PrimeScriptTMRT Master Mix(批号RR036A)和TB GreenTMPremix Ex TaqTM(批号RR420A)购于日本TaKaRa;流式抗体APC-CD24和PE-CD44购于北京BioLegend生物科技有限公司;一抗抗体Nanog(批号4903)、Sox-2(批号3579)、Oct-4(批号2750)、GAPDH(批号5174)、p-STAT3(批号9145)、STAT3(批号9139)及CD44s(批号3540)均购于美国Cell Signaling Technology(CST),山羊抗鼠二抗(批号SA00001-2)和山羊抗兔二抗(批号SA00001-1)购于中国Proteintech;STAT3激活剂Colivelin TFA(批号HY-P1061A)购于美国MedChemExpress生物科技公司。
1.1.3仪器 CO2恒温细胞培养箱(美国Thermo);酶标仪(瑞士TECAN);图像扫描机分析软件(美国Bio-Rad);研究级倒置荧光显微镜(德国Leica);10色分析型流式细胞仪(美国Beckman);超微量紫外、可见光分光光度计(美国Thermo);实时荧光定量PCR系统(美国Bio-Rad);Western blot电泳仪器、转印槽及化学发光成像系统(美国Bio-Rad)。
1.2 方法
1.2.1细胞培养 胰腺癌细胞系PANC-1细胞培养于含10% FBS、1×105U·L-1青霉素和100 mg·L-1链霉素的DMEM培养基中,置于37℃、5% CO2培养箱常规培养,每隔2~3 d传代一次,取对数生长期细胞进行实验。
1.2.2CCK-8法检测细胞存活率 将对数生长期的PANC-1细胞悬液浓度调整为6×107个·L-1,接种于96孔板,每孔100 μL(6 000个细胞/孔),d 2待细胞贴壁后,用递增浓度的CA(0、5、15、20、30、50、70、100、150 μmol·L-1)进行处理,每个药物浓度设置3个复孔,分别继续培养24、48或72 h后,每孔加入10 μL CCK-8试剂,置于37℃、5% CO2培养箱孵育45~60 min,使用酶标仪在450 nm 处测量吸光度(OD)值;分别计算3个时间段的细胞生长抑制率,生长抑制率/%=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.2.3CFSE染色实验 将对数生长期的PANC-1细胞消化收集,加入Cell TraceTMCFSE染料(5 μmol·L-1),37 ℃避光孵育15 min,加入完全培养液中和5 min,离心收集染色细胞,常规培养,用于后续实验验证,流式收集分析数据。
1.2.4克隆形成实验 将对数生长期的PANC-1细胞制备成浓度为4×105个·L-1的单细胞悬液,均匀的接种于6孔板中,每孔加入2 mL(800个细胞/孔),设置空白溶剂对照组、CA低浓度组(8 μmol·L-1)及CA高浓度组(16 μmol·L-1);处理48 h后将培养基更换为无药物的完全培养液,继续培养10 d后,甲醇固定15 min,0.5% 结晶紫染色,风干后拍照并进行统计分析。
1.2.5干细胞悬浮成球实验 制备含有EGF(20 μg·L-1)、bFGF(20 μg·L-1)、B27(10 μg·L-1)的DME:F12干细胞培养液,分别用含有指定浓度CA(0、8、16 μmol·L-1)的干细胞培养基重悬细胞,将浓度调整为2.5×106个·L-1,接种于超低黏附6孔板,每孔2 ml(5 000个细胞/孔),每组设置3个复孔,继续培养7 d后,使用倒置显微镜对单个球体进行拍照、计算球体数目并进行统计分析。
1.2.6实时荧光定量PCR检测干性基因表达 将对数生长期的PANC-1细胞接种于6孔板,贴壁后用指定浓度的CA(0、8、16 μmol·L-1)处理48 h,随后每孔加入1 mL TRIzol 试剂,提取细胞总RNA,使用超微量紫外分光光度计进行纯度检测及含量测量、琼脂糖电泳确定RNA完整性,用逆转录试剂盒合成cDNA,以cDNA为模板进行荧光定量PCR反应,具体操作根据PrimeScriptTMRT Master Mix和TB GreenTMPremix Ex TaqTM的试剂盒说明书进行。实验结果根据相对定量方法进行分析,计算2-ΔΔCt值,比较药物处理组与空白溶剂组之间检测基因的表达差异是否具有统计学意义。
1.2.7流式细胞术检测CD44+CD24+细胞比例 将对数生长期的PANC-1细胞接种于6孔板,贴壁后加入指定浓度的CA处理48 h,胰酶消化,用4 ℃预冷的PBS洗涤两次,将细胞浓度调整为1×106个/100 μL后,将APC anti-human CD24抗体和PE anti-human CD44抗体以1 ∶40的比例加入100 μL细胞悬液中,4 ℃避光染色45 min,离心去上清,预冷PBS洗涤两次,流式上机检测CD44+CD24+亚群比例,用Flow Jo软件对数据进行分析。
1.2.8流式细胞术检测ALDH+细胞比例 将经不同处理后的PANC-1细胞收集,4 ℃预冷PBS洗涤两次,预先将5 μL DEAB加入至阴性对照管中,用ALDEFLUORTMAssay Buffer调整细胞浓度为1×109个·L-1,随后添加5 μL活化的ALDEFLUORTM至1 mL细胞悬液中,混合并立即将0.5 mL混合物转移到阴性对照管,避光孵育30 min,离心去上清,流式上机检测ALDH+比例并做统计分析。
1.2.9Western blot检测相关蛋白表达 使用指定浓度的CA处理PANC-1细胞48 h,加入适量含蛋白酶、磷酸酶抑制剂的蛋白裂解液(50 mmol·L-1Tris-HCl, pH 7.6, 150 mmol·L-1NaCl, 0.1% SDS, 1% NP-40),置于冰上震荡裂解20 min后,4 ℃、1 2000 r·min-1离心15 min,取上清,用BCA试剂盒对蛋白浓度进行检测,加入蛋白缓冲液,100 ℃加热变性10 min。蛋白样品进行SDS-PAGE电泳,随后转移到PVDF膜,用5%的脱脂牛奶室温封闭2 h,对应一抗4 ℃孵育过夜,TBST洗涤3次,HRP标记山羊抗兔/鼠二抗室温孵育1 h,TBST洗涤3次,加入ECL发光液在化学发光仪上进行显色,采集图像。
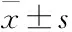
2 结果
2.1 CCK-8检测CA对胰腺癌细胞存活率的影响CA结构式如Fig 1A所示,用递增浓度的CA分别处理PANC-1胰腺癌细胞24、48及72 h,实验结束点加入CCK-8试剂对细胞存活率进行检测。如Fig 1B所示,CA可明显降低PANC-1细胞的存活率,作用呈浓度和时间依赖性,其中CA处理下PANC-1细胞对应的IC50值在24 h为114.67±6.21 μmol·L-1、在48 h为16.57±1.10 μmol·L-1、在72 h为12.77±0.12 μmol·L-1。
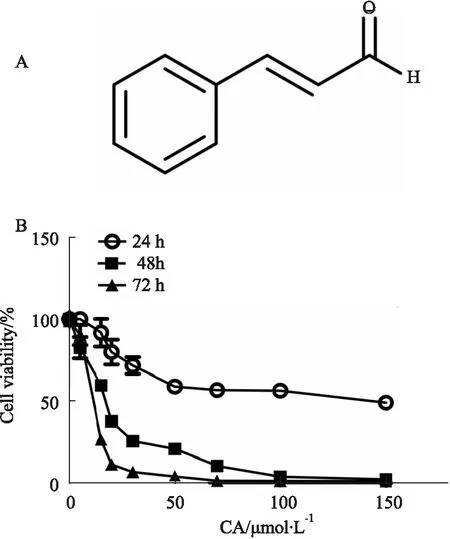
Fig 1 Effects of CA on cell viability of pancreatic cancer PANC-1 cells n=3)
2.2 CA抑制胰腺癌PANC-1细胞的增殖能力CFSE是一种可对活细胞染色的荧光染料,其荧光强度会随着细胞增殖而逐级递减。如Fig 2所示,与空白对照相比,CA处理后,细胞的荧光强度明显下降,差异具有统计学意义(P<0.01),表明CA可明显抑制PANC-1细胞的增殖能力。
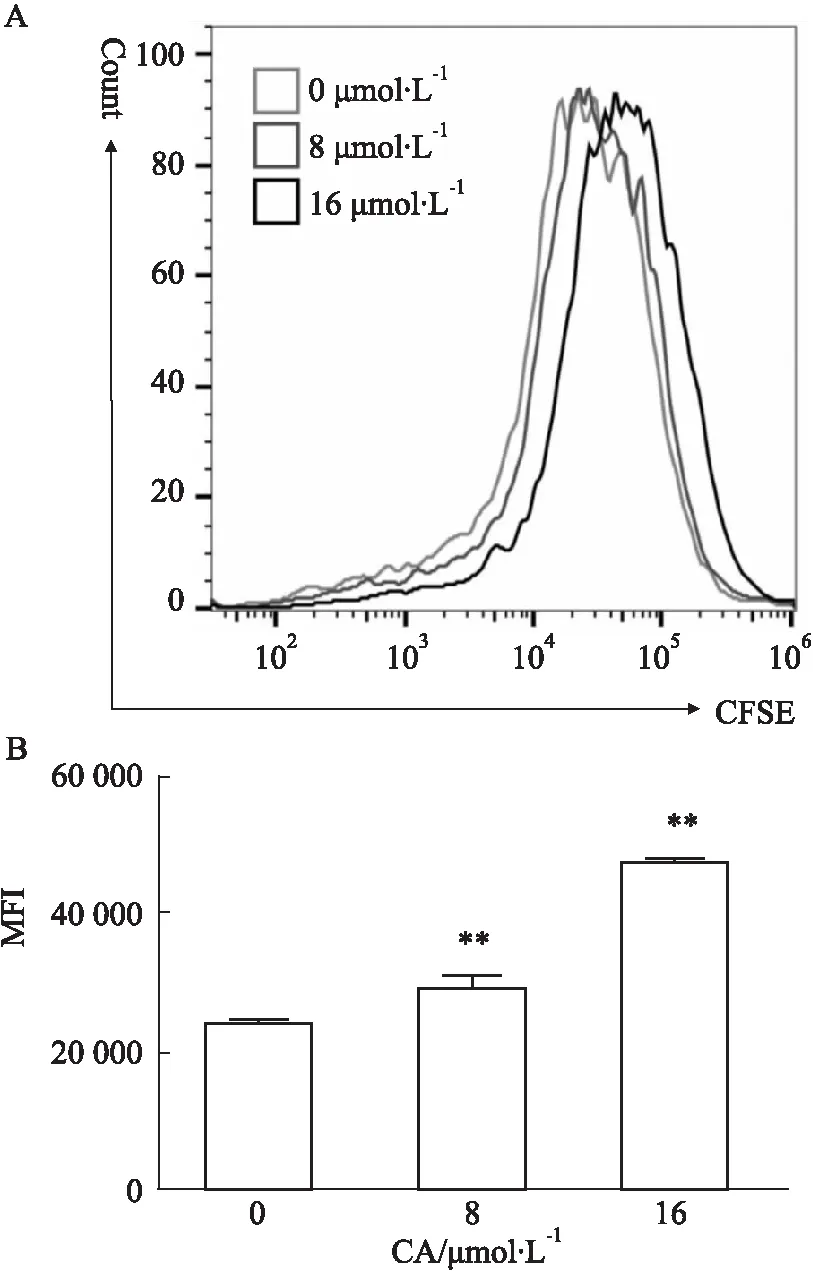
Fig 2 Effects of CA on proliferation of pancreatic cancer PANC-1 cells n=3)
2.3 CA抑制PANC-1癌细胞的克隆形成能力为了进一步探究CA对单个胰腺癌细胞增殖能力的影响,采用平板克隆形成实验进行研究。用CA(0、8、16 μmol·L-1)处理细胞48 h后,继续用无药物培养基培养至克隆长到肉眼可见大小,固定染色。如Fig 3所示,CA呈剂量依赖性使克隆体积变小,数量变少,在高浓度药物处理组(16 μmol·L-1),细胞的克隆形成能力几乎被完全抑制。
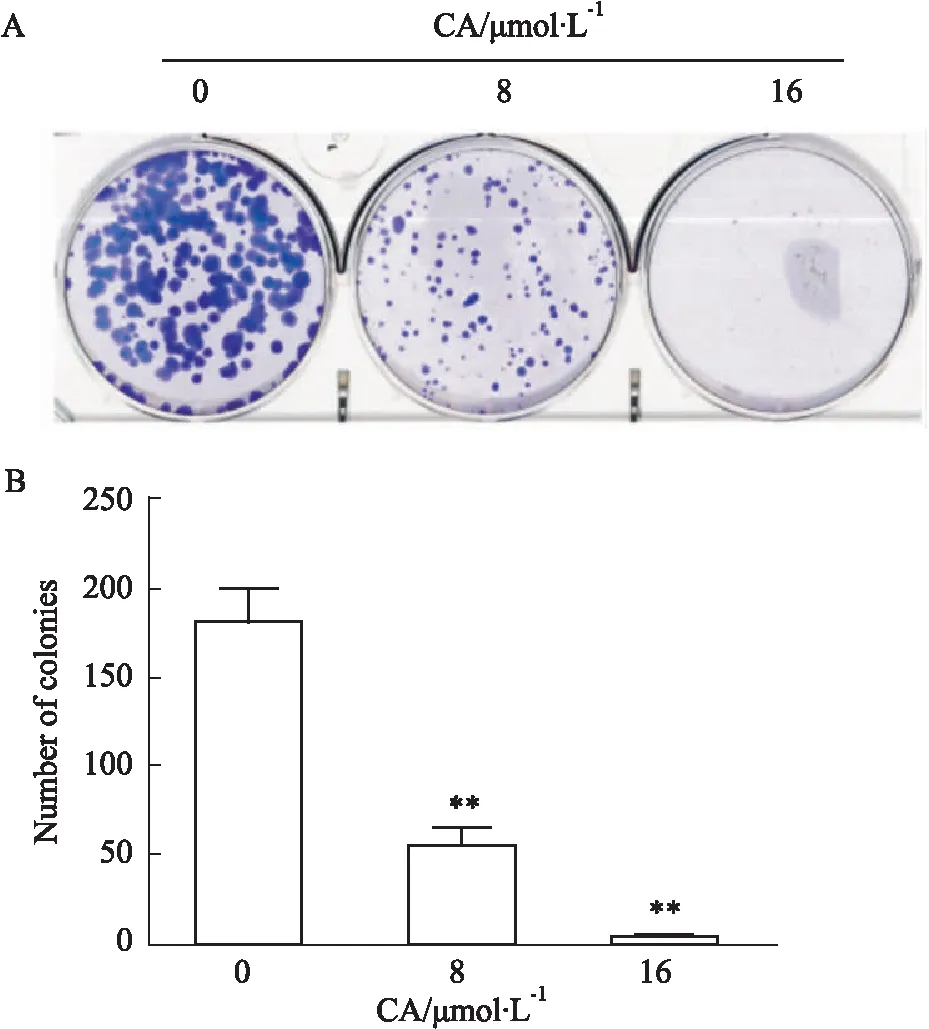
Fig 3 Effects of CA on colony formation of
2.4 CA抑制胰腺癌PANC-1细胞的干细胞成球能力干细胞悬浮成球能力是反映肿瘤干性的一项重要指标,肿瘤干细胞可耐受无血清培养基环境,而普通的肿瘤细胞在此环境中逐渐死亡,单个的肿瘤干细胞继续生长形成干细胞球。如Fig 4所示,CA可明显抑制胰腺癌细胞在无血清悬浮培养体系中的成球能力,使球体体积减小,数量变少。
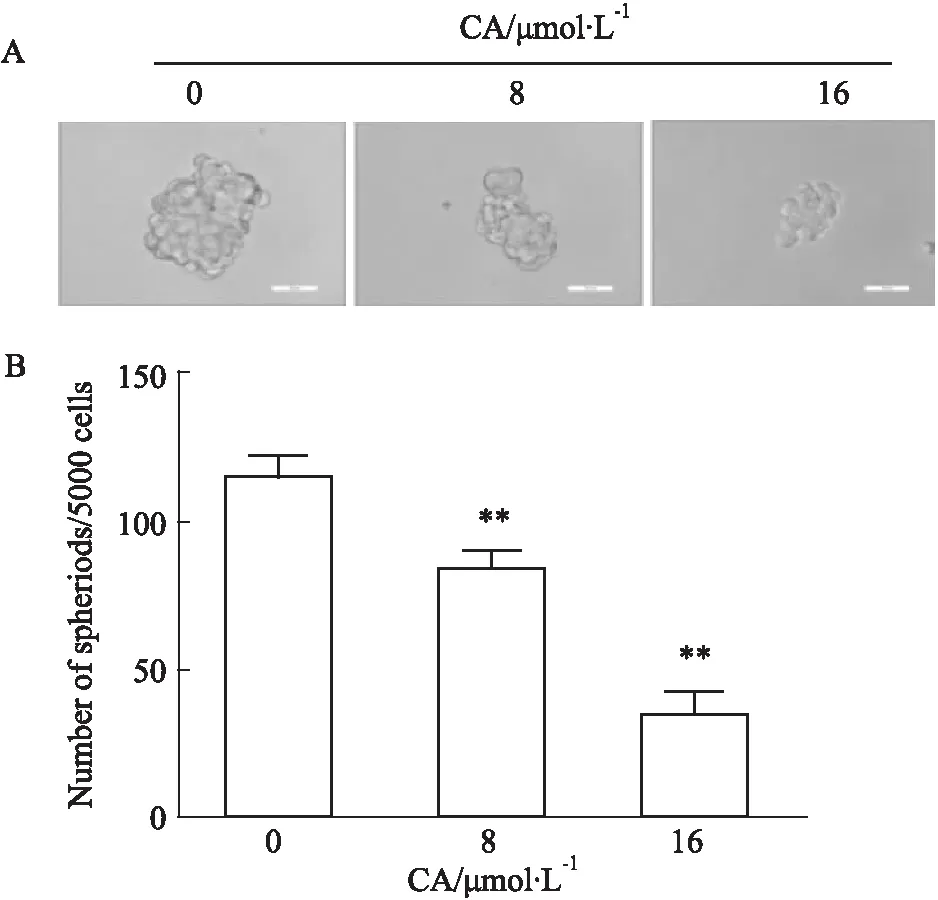
Fig 4 Effects of CA on sphere-forming ability in suspension culture of PANC-1 cells n=3)
2.5 CA抑制胰腺癌肿瘤干细胞相关基因的表达水平用指定浓度的CA处理PANC-1细胞48 h后,分别提取总RNA和总蛋白对干性相关基因Nanog、Sox-2及Oct-4的表达水平变化进行检测分析。如Fig 5A所示,在qRT-PCR结果中,与空白对照组相比,CA可呈浓度依赖性的抑制3种肿瘤干细胞相关基因的mRNA表达,结果具有统计学意义(P<0.05);同样,Western blot结果也表明,CA在蛋白水平对干性基因的显著抑制作用(Fig 5B)。
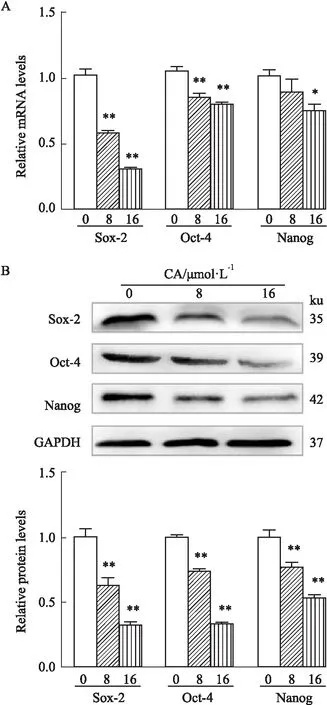
Fig 5 Effects of CA on stemness-related gene expression in PANC-1 cells n=3)
2.6 CA减少PANC-1癌细胞的CD44+CD24+干细胞亚群比例CD44+CD24+亚群是胰腺癌干细胞亚群之一,具有胰腺癌干细胞特性。用不同浓度的CA作用PANC-1细胞48 h后,对细胞进行CD44和CD24抗体染色,流式细胞术检测CD44+CD24+比例。如Fig 6所示,CA处理可减少细胞中的CD44+CD24+比例,差异具有统计学意义(P<0.01)。
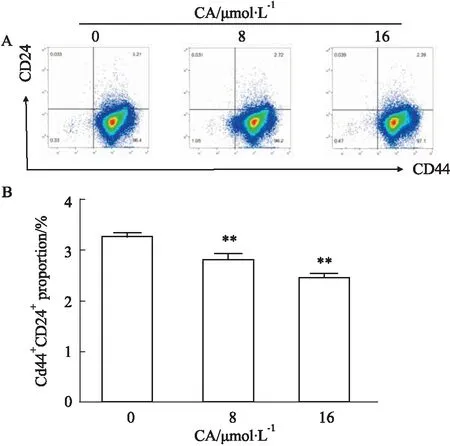
Fig 6 Effects of CA on CD44+CD24+proportion in PANC-1 cells n=3)
2.7 CA减少PANC-1癌细胞的ALDH+干细胞亚群比例ALDH+亚群是另一重要的胰腺癌干细胞亚群。如Fig 7所示,CA作用48 h后,PANC-1的ALDH+细胞比例明显下降,且效果随浓度的升高进一步加强。
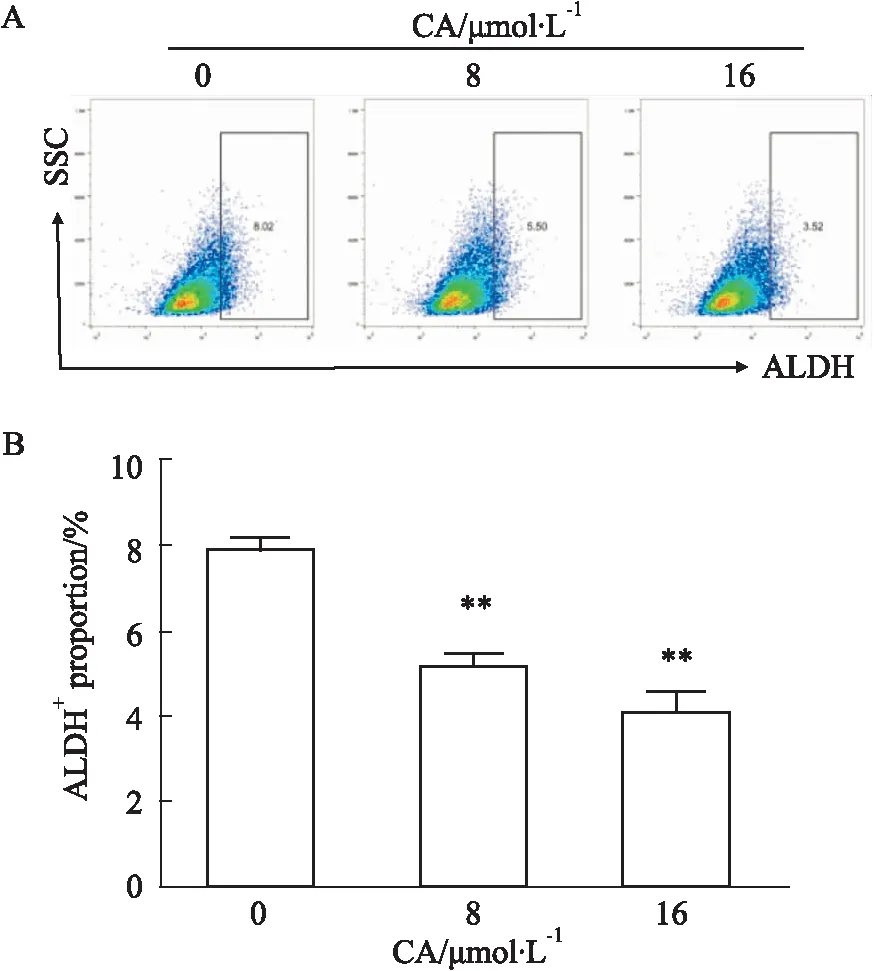
Fig 7 Effect of CA on ALDH+ proportion
2.8 CA对PANC-1癌细胞CD44s/STAT3通路的影响CD44是胰腺癌细胞干性相关的表面标志物之一,其中CD44s亚型与胰腺癌细胞干性功能密切相关,可使下游的信号分子STAT3磷酸化激活。如Fig 8A所示,CA可抑制CD44s的表达,同时,STAT3的磷酸化激活被抑制,而总STAT3表达几无变化;进一步采用STAT3激动剂Colivelin进行回复验证,发现当STAT3磷酸化增强后(Fig 8B),CA的抑制作用被部分回复(Fig 8C、D),提示CA可能通过调控CD44s/STAT3通路抑制PANC-1细胞的增殖和肿瘤细胞干性。
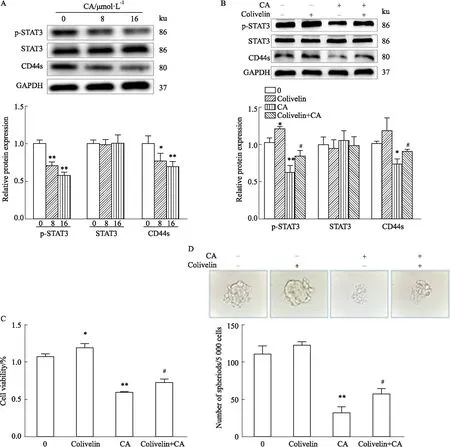
Fig 8 Pancreatic PANC-1 cell proliferation and stemness affected by CA via CD44s/STAT3 pathway n=3)
3 讨论
胰腺癌恶性程度高,预后极差,目前主要靠手术或化疗控制癌症进展,但由于发病隐匿,转移早,多数病人发现时已失去手术机会,只能采用全身治疗方案:5-氟尿嘧啶、叶酸、伊立替康和奥沙利铂四联方案(FOLFIRINOX)或吉西他滨联用紫杉醇[8];然而,这些治疗手段并未改变胰腺癌易转移复发、易耐药的治疗困境,也未能有效延长病人的生存时间,因此,研究发展新的安全有效的治疗策略非常重要。胰腺癌的发生发展非常复杂,一些癌症相关基因的改变会对胰腺癌进程产生影响,其中Kras是在胰腺癌中突变非常普遍的原癌基因,在早期就已出现,且参与胰腺癌生长、分化及转移过程[9],因此我们选择了携带Kras突变的胰腺癌细胞株PANC-1进行了研究。
从天然产物中挖掘活性成分是现代新药研发的重要途径之一。CA是主要来源于肉桂的天然产物,目前已被证明具有较为广泛的抗肿瘤作用,主要是通过抑制肿瘤细胞增殖、诱发凋亡发挥抗肿瘤效果,天然分子抑制细胞增殖是经典的抗胰腺癌研究方向之一[10]。已有研究表明,CA可通过PI3K/AKT通路抑制肠癌细胞的增殖和转移,诱导肠癌细胞凋亡[11];还可以通过Wnt/β-catenin通路诱导非小细胞肺癌发生凋亡,逆转上皮间质转化[12]。然而CA在胰腺癌的研究尚未见有研究报道。
本文首先通过CCK-8实验发现CA对PANC-1胰腺癌细胞存活率有显著影响,并进而通过CFSE细胞增殖荧光染色实验进一步证实了CA显著抑制PANC-1癌细胞的增殖,此外,克隆形成实验可反映癌细胞群体依赖性和增殖能力两个重要特性,我们的结果表明CA还可显著抑制PANC-1癌细胞的克隆形成能力。说明天然产物CA可抑制胰腺癌细胞PANC-1的生长增殖。
肿瘤干细胞(CSCs)是肿瘤中占比非常小的一个亚群,1997年首次在急性白血病中发现[13],随后在越来越多的肿瘤中被证实,胰腺癌干细胞(pancreatic cancer stem cells,PCSCs)在2007年被分离证实,研究者发现与普通肿瘤细胞相比,PCSCs具有更强的致瘤性、无限增殖能力及多向分化潜能,因此不易被清除,被认为是导致肿瘤发生、耐药及转移复发的重要原因之一[14]。现阶段针对PCSCs的研究主要是通过靶向PCSCs的表面标志物、靶向PCSCs的调控通路或诱导PCSCs分化来抑制PCSCs的生长,如采用单克隆抗体与表面标志物的结合来达到抗胰腺癌作用的CD44单抗;使用mTOR通路抑制剂雷帕霉素、SHH通路抑制剂联用吉西他滨也可有效抑制清除PCSCs,改善肿瘤复发转移和耐药[15]。然而临床上胰腺癌治疗目前仍缺乏针对PCSCs的安全有效药物,不仅如此,已有多项研究表明,临床使用的胰腺癌一线治疗药物吉西他滨还会增强胰腺癌的干性造成耐药[16],因此,研究发展能够抑制PCSCs的新治疗方略至关重要。本研究发现CA可抑制PANC-1胰腺癌干细胞的悬浮成球能力,可显著抑制胰腺癌干细胞干性相关的3种基因Nanog、Sox-2及Oct-4的表达水平;此外,通过流式检测细胞中2种不同的干细胞亚群(CD44+CD24+细胞和ALDH+细胞)比例,还发现CA可呈浓度依赖性的减少胰腺癌细胞的干细胞比例,上述结果都表明CA对PANC-1肿瘤细胞干性的抑制作用。
PCSCs的调控机制是非常复杂的,涉及多条信号通路的参与如SHH、Notch1、Wnt/β-catenin、PI3K/AKT/mTOR信号通路,CD44s/STAT3通路已被证实对胰腺癌增殖和干性的维持意义重大。研究表明采用单克隆抗体抑制CD44s可使下游的Nanog/Sox-2干性基因及p-STAT3被抑制,从而抑制胰腺癌的增殖和干性[8];与CD44-CD24-和ALDH-细胞相比,CD44+CD24+和ALDH+胰腺癌干细胞亚群的STAT3通路被异常激活,抑制STAT3通路可显著抑制胰腺癌细胞干性[17]。然而,由于成体干细胞等也表达CD44s,采用抗体治疗的策略可能会对正常干细胞产生伤害,且单克隆抗体价格昂贵,目前临床上也尚无成功上市的STAT3抑制剂,因此,仍需继续研究发现针对CD44s/STAT3信号通路的安全性好的新药物;而CA为传统中药单体,可作为食用香料使用,安全性较好。我们采用Western blot对CD44s/STAT3通路相关蛋白进行检测,结果发现,CA可降低p-STAT3和CD44s的表达,而STAT3蛋白表达几无变化,为进一步验证,我们采用STAT3的特异激动剂Colivelin TFA[18]进行回复实验,发现增强STAT3的磷酸化水平可部分回复CA对PANC-1细胞增殖和干性的抑制效果,说明CA可能通过CD44s/STAT3通路抑制PANC-1细胞的增殖和干性。
综上,CA可抑制胰腺癌细胞的增殖和肿瘤细胞干性,减少胰腺癌干细胞比例,其机制可能与调控CD44s/STAT3信号通路有关。后续研究将利用体内动物模型和临床样本继续对此深入探讨,为发展相关的胰腺癌新治疗药物提供更多科学依据。

