‘华仲6号’杜仲嫩枝扦插生根的解剖及生理变化*
吕庚鑫 孟益德 庆 军 何 凤 刘攀峰 杜庆鑫 杜红岩 杜兰英 王 璐
(1.中国林业科学研究院经济林研究开发中心 郑州 450003; 2.南京林业大学 南京 210037; 3.国家林业和草原局泡桐研究开发中心 经济林种质创新与利用国家林业和草原局重点实验室 郑州 450003)
杜仲(Eucommiaulmoides)是我国特有的国家战略储备资源,在我国29个省(区、市)均有分布(刘攀峰等, 2020)。杜仲高值化综合利用涉及到杜仲树皮、雄花、果实、叶片、木材等部位(杜庆鑫等, 2017),在航空航天、化工、医疗等多个领域具有巨大的开发潜能及应用前景(杜红岩等, 2020)。《全国杜仲产业发展规划(2016—2030)》明确规划,到2030年全国新造杜仲林面积333.35万hm2,发展潜力巨大。现有杜仲资源中约90%为实生林,良种资源规模小且普及率低,苗木供不应求,严重限制杜仲产业发展。
杜仲为雌雄异株,种子繁殖不能保持亲本的优良性状,因此杜仲良种繁育需采用无性繁殖的技术。杜仲良种繁育目前主要以嫁接为主(杜红岩等, 2020),但其成本较高、受季节限制。杜仲组培苗愈伤组织生根困难,褐化、玻璃化等现象严重,组培体系的建立未取得技术突破(李响等, 2019; 刘闵豪等, 2020)。楸树(Catalpabungei)、板栗(Castaneamollissima)、桑树(Morusalba)等树种都已通过扦插技术实现了良种的快速繁育(王新建等, 2009; 杜常健等, 2019; 杜伟, 2016)。扦插不仅能保持母本优良性状,而且操作简单、成本低、效率高,对于杜仲良种繁育具有重要意义(康向阳, 2017)。
许多研究证实: 扦插成功的关键在于不定根的形成和数量,而生长素被认为是诱导根原基发生的先决条件(Duetal., 2016; Druegeetal., 2016),氧化酶和营养物质对不同树种扦插生根也存在促进或抑制作用(欧阳芳群等, 2015)。近年来杜仲良种嫩枝扦插技术取得了较大突破,显著提高了杜仲良种嫩枝扦插的生根率(王高鹏等, 2018),但对于杜仲良种嫩枝扦插生根的相关机理尚未开展系统研究。鉴于此,本文以‘华仲6号’杜仲半木质化春梢为试材,对插穗基部进行生根解剖结构和形态观察,测定生根过程中内源激素、营养物质含量及氧化酶活性等相关生理指标,从解剖和生理学探讨杜仲良种嫩枝扦插不定根发生机制。
1 材料与方法
1.1 插穗制备与扦插
试验材料取自中国林业科学研究院经济林研究开发中心的河南孟州试验基地(112°33′E,34°50′N),以健壮、长势良好、无病虫害的国审良种‘华仲6号’杜仲3年生嫁接苗为母树,取上部当年生半木质化枝条制备插穗。
扦插池长8 m、宽1.5 m,下部铺15 cm厚的粗河砂、上部铺15 cm厚的基质。以草炭土∶珍珠岩(体积比3∶1)作扦插基质,扦插前用40%多菌灵可湿性粉剂500倍消毒。2020年4月28日早晨采集并制备插穗,插穗长度控制在10~15 cm,保留2~3个饱满芽和叶片。经杜仲专用生根剂快速浸蘸10 s的插穗作为处理组,清水处理作为对照组,每处理各扦插一池。扦插后每周用多菌灵消毒1次,依据天气情况合理调整喷雾间隔及时间,控制棚内温度20~29 ℃,空气相对湿度90%以上。
1.2 样品采集
外部形态观察的取样从扦插当天开始,每2天取样1次,直到有不定根生成。每次随机取20根,挑选生长状态一致的3~ 4根。取插穗基部1~3 cm长的茎段,放入装有70% FAA固定液中,实验室避光低温保存。
生理指标测定于扦插后的第0、6、12、18、22、26、32、39、46、53天取样,每次取样均在9:00—10:00,共采样10次。随机选取20根生长状态一致的插穗,取基部生根部位1~3 cm的韧皮部于50 mL试管中,立即放入液氮中冷冻,-80 ℃冰箱中保存待用。
1.3 插穗生根形态观察
取样时观察并记录插穗基部的外部形态变化,扦插60天后统计各处理生根率、生根数量、平均根长、最长根长等指标。长度精确到0.01 cm。生根率=生根插穗数/插穗总数×100%。
1.4 组织结构观察
将软化好的茎段流水冲洗 30 min,剪取基部1.0 cm左右材料,在真空组织脱水机(型号Excelsior AS)中脱水浸蜡,包埋机(型号JB-P5)中包埋,将修整好的蜡块置于石蜡切片机(型号RM2016)切片,切片厚5 μm,组织摊片机(型号KD-P)40 ℃温水展片,60 ℃烘箱(型号GFL-230)内烘干。依次在二甲苯、不同浓度的乙醇中脱蜡复水,用番红-固绿染色,扫描电子显微镜(型号SU8100)下观察采图。
1.5 生理指标测定
参考莫文娟等(2020)用高效液相-串联质谱法(High Performance Liquid Chromatography-tandem Mass Spectrometry,HPLC-MS/MS)测定茎段基部韧皮部中内源激素(IAA、 GA3、 ABA、 ZR)含量。测定参数为: BEH C18色谱柱(2.1 mm×100 mm,1.8 μm),流动相A为0.1%甲酸水溶液,B为乙腈,进行线性梯度洗脱,流速0.25 mL·min-1,进样量5 μL,柱温40 ℃。质谱条件为: 电喷雾电离源(ESI),正负离子电离模式; 离子源温度500 ℃,正负离子源电压分别为5 500 V和4 500 V,气帘气30 psi,雾化气和辅助气均为50 psi,采用多反应监测模式(MRM)进行扫描。吲哚乙酸氧化酶(IAAO)、多酚氧化酶(PPO)、过氧化物酶(POD)活性用比色法测定,可溶性糖、可溶性蛋白含量分别采用蒽酮法、考马斯亮蓝法测定(李合生等, 2000); 全氮含量采用凯氏定氮法(汪欣等, 2020)测定。每个指标均3次重复。
1.6 数据处理
采用Microsoft Excel 2016进行数据统计分析,利用SPSS20.0 for Windows(SPSS,USA)进行方差分析(ANOVA,P<0.05),使用Origin 2018软件制作图表。
2 结果与分析
2.1 杜仲良种嫩枝插穗生根的外部形态观察
杜仲嫩枝插穗不定根形成过程如图1所示。选取‘华仲6号’杜仲半木质化枝条作为插穗(图1A)分别浸蘸杜仲专用生根剂和清水(对照)后扦插。第12天,插穗基部伤口基本愈合,出现褐色瘤状突起,体积膨大(图1B); 第22天,大部分插穗基部距切口1.0~3.0 cm处皮层突起并裂开,突起顶部呈半透明状,其内部已诱导形成根原基(图1C); 第26天,可在大部分插穗基部观察到幼小白色不定根突破皮层,形成明显的不定根结构(图1 D); 扦插约40天,大多数插穗不定根已伸长至3.0~5.0 cm,并开始形成二级侧根,插穗地上部位顶芽舒展,嫩叶数量增多(图1E); 第53天,插穗新叶生长迅速,叶面积增加,不定根伸长速度加快,此时,插穗已经成为具有根、茎、叶的完整植株(图1F)。由表1可知,处理组与对照组的插穗生根效果差异显著(P<0.05)。处理组生根率为85.3%,比对照提高了60%; 平均每根插穗生根数达25.6根,比对照多20根; 平均根长8.41 cm,约为对照2倍。
2.2 杜仲良种嫩枝扦插不定根发育的解剖观察
对插穗生根过程进行解剖观察,扦插前杜仲茎的横切面初生构造由外向内依次为: 表皮、皮层、韧皮部、维管形成层、木质部及髓(图2A、E),未发现潜伏根原基,因此杜仲扦插生根属于诱导生根类型。处理组扦插12天左右,大部分插穗基部形成层部位出现排列紧密,细胞质浓、细胞核大的薄壁细胞(图2F),扦插18天进一步发育为团状分生组织,根原基原始细胞分化形成根原基结构(图2B); 扦插22~26天,根原基细胞继续增殖、生长(图2 G),形成圆锥状(图2C),发达的根冠为其内部分生组织提供保护,插穗基部切口以上3 cm范围内皮层有密集的突起; 扦插1个月左右,大部分插穗不定根突破皮层、表皮伸出体外,横切面为“个”字形(图2 D),此时不定根已分化形成维管系统,并与插穗茎内维管组织相连(图2 H)。
通过对杜仲生根解剖及形态变化观察,可确定杜仲不定根主要由维管形成层外薄壁细胞诱导分化形成的根原基发育而来,扦插生根过程划分为4个阶段: 不定根诱导期(扦插0~12天)、启动期(扦插12~22天)、表达期(扦插22~32天)和伸长期(扦插32~53天)。

图1 杜仲嫩枝扦插生根的外部形态变化

表1 外源激素处理对杜仲嫩枝扦插根系形态指标及生根时间的影响①
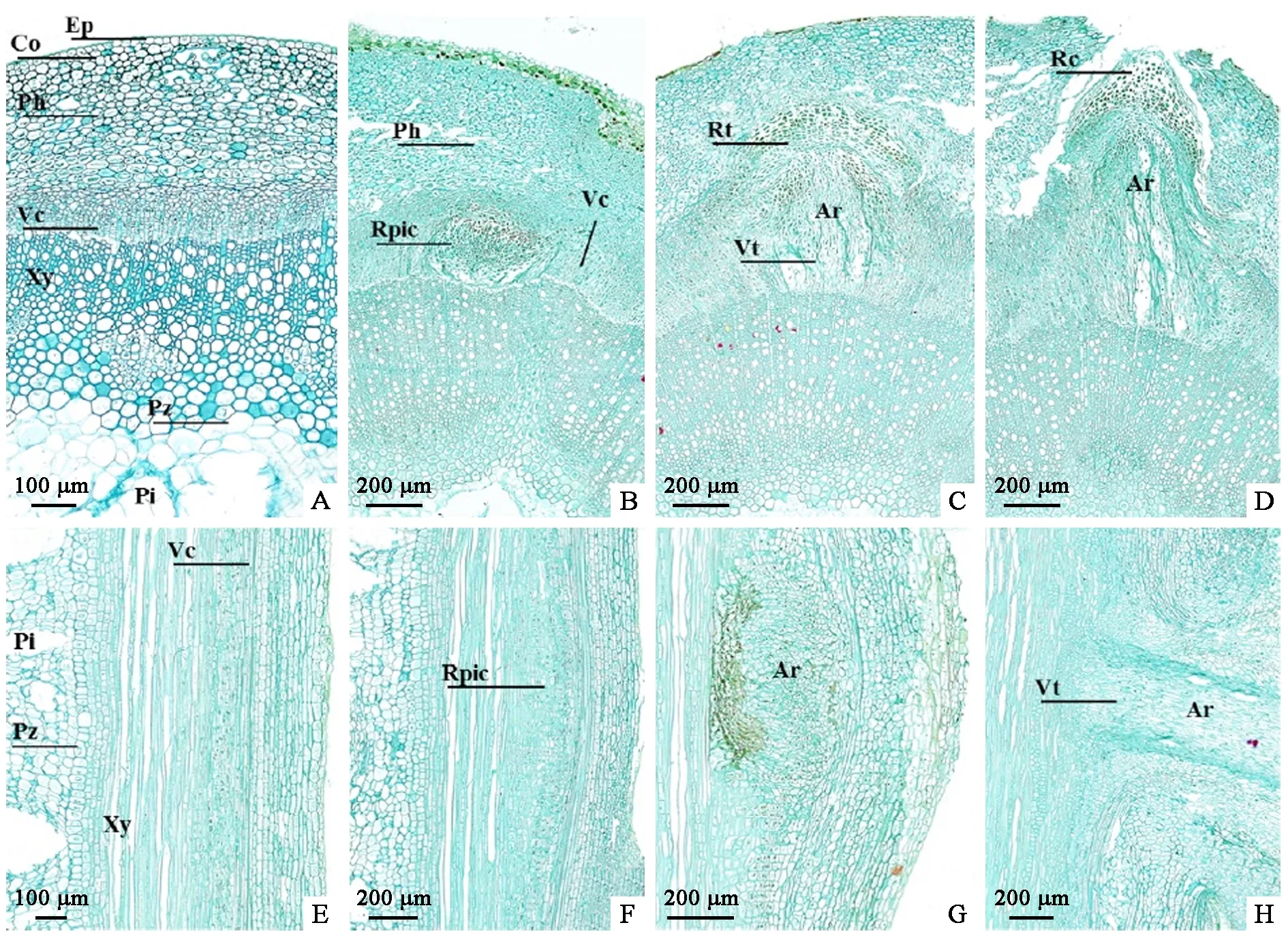
图2 杜仲嫩枝扦插不定根发生过程的解剖观察
2.3 杜仲扦插生根进程中内源激素含量变化
处理组生长素(IAA)含量呈“上升—下降”的单峰变化趋势,对照组峰值出现时间滞后(图3A)。处理组插穗自扦插日起IAA含量快速升高,22天形成峰值(30.12 ng·g-1FW)后开始降低; 而对照组直到39天形成峰值,比处理组推迟了17天。对照组IAA峰值出现较晚,可见,IAA是诱导杜仲插穗不定根形成的关键内源激素。
处理及对照组赤霉素(GA3)含量呈“上升—下降—上升”变化趋势(图3B)。GA3分别在不定根诱导期和伸长期显著升高,处理组GA3含量始终高于对照,有助于插穗抗性的提高和不定根的伸长。生根期间GA3浓度降低更利于根原基的形成和发育。GA3可促进水解酶的合成,有利于营养物质的供给,为不定根的启动及表达做好物质准备。因此处理组GA3含量较高。
处理组插穗的脱落酸(ABA)含量整体呈“上升—下降”变化趋势(图3C)。处理组ABA含量在不定根诱导期升高至峰值(107.0 ng·g-1FW),对照组则降低至谷值(44.15 ng·g-1FW); 启动期、表达期及伸长期,处理组ABA含量均持续降低; 对照组ABA含量在启动期(第22天)上升至峰值(73.06 ng·g-1FW),表达期及伸长期持续下降。ABA主要抑制杜仲插穗不定根的发育,在扦插初期含量升高可提高插穗的抗性。
处理组插穗玉米素核苷(ZR)含量整体呈“下降—上升—下降”变化趋势,且对照组始终低于处理组(图3D)。插穗刚脱离母体,ZR的供应通路被切断,而ZR的消耗利用正常进行,因此在扦插前期ZR含量逐渐下降; 处理组插穗ZR含量在表达期出现峰值,显著高于对照,这可能与前期外源激素处理有关; 不定根伸长期,处理组ZR含量平缓走低,而对照组ZR含量在第39天降至谷值(1.66 ng·g-1FW)后回升,可能是由于对照组插穗整体生根进程较晚,此时正处于不定根开始形成阶段。不定根形成前,ZR含量下降,而表达期ZR含量上升。说明根原基的诱导及分化需要低水平的ZR含量,而不定根的表达需要大量ZR参与。
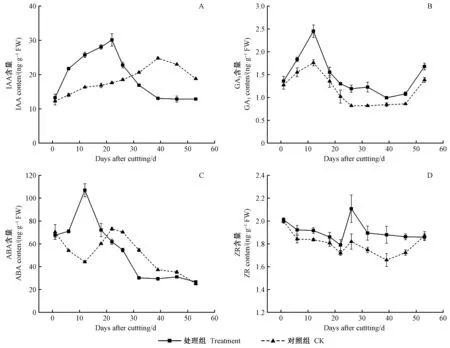
图3 杜仲嫩枝插穗生根进程中内源激素变化
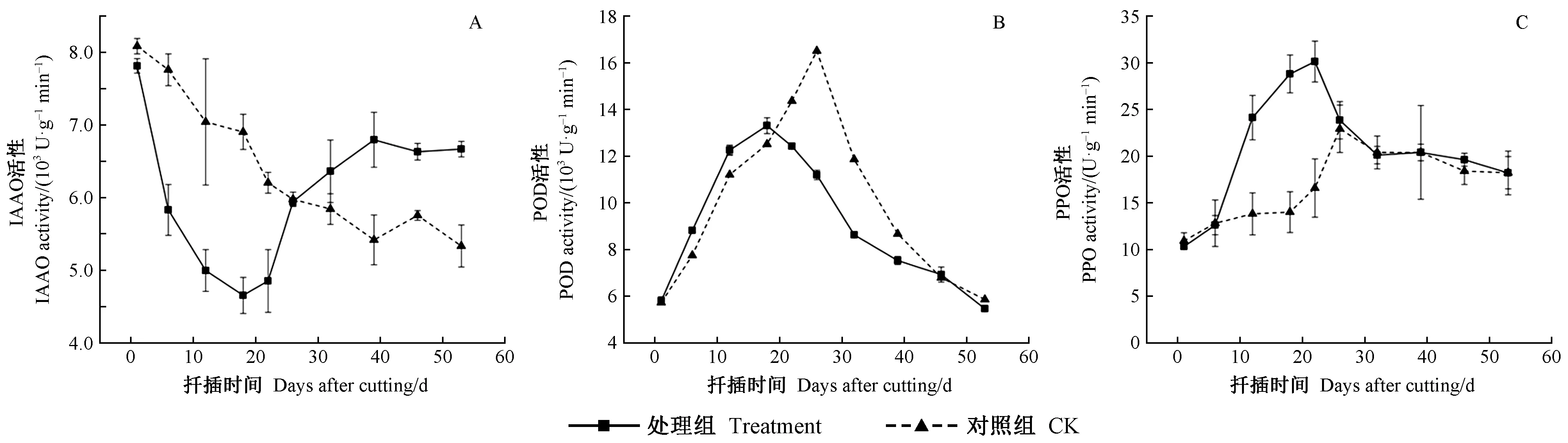
图4 杜仲嫩枝插穗生根过程中氧化酶活性的变化
2.4 杜仲生根过程中氧化酶活性的变化
处理组吲哚乙酸氧化酶(IAAO)活性呈“降低—升高”的变化趋势,对照组IAAO活性持续下降(图4A)。不定根诱导及启动期,处理组IAAO活性快速下降至谷值(4 654.52 U·g-1min-1),而对照组则下降趋势较平缓,说明外源激素抑制了IAAO活性,IAAO活性降低的同时对应IAA含量的显著升高,有利于根原基的诱导分化。在不定根表达及伸长期,处理组IAAO活性快速升高,39天达到峰值(6 795.12 U·g-1min-1); 对照组IAAO活性继续下降缓慢,最后趋于稳定水平。IAAO活性下降,IAA含量升高,有利于不定根的发生; IAAO活性升高,IAA含量降低,有利于不定根的伸长。
过氧化物酶(POD)活性呈“上升—下降”趋势,处理与对照变化趋势一致(图4B)。生根前,处理组插穗POD活性高于对照,生根后相反。杜仲生根剂处理在生根前显著提高了插穗POD活性,使POD活性提前达到峰值,生根后抑制POD活性。这说明较高活性的POD有利于根原基的诱导及分化,低活性的POD则有利于不定根的表达及伸长。
多酚氧化酶(PPO)活性整体呈“上升—下降”变化趋势,处理与对照组插穗中PPO变化趋势相同(图4C)。不定根诱导及启动期PPO活性升高,处理组在第22天达到峰值(30.12 U·g-1min-1),而对照组升高较为缓慢。不定根表达及伸长阶段(22~53天)PPO活性逐渐降低。扦插初期处理及对照插穗PPO活性无显著差异,随着不定根的发生,2组间达到显著差异水平(P<0.05)。这说明高活性的PPO与不定根的发生关系密切。
2.5 生根过程中营养物质含量的变化
由图5A可知,可溶性糖含量均呈“下降—上升—下降”的变化趋势,对照与处理变化趋势相同,但整体低于处理组。扦插前期,可溶性糖含量有下降趋势,这可能与插穗愈合伤口快速消耗自身糖类物质有关。不定根形成期,处理组插穗的可溶性糖含量持续增加,始终高于对照组,该过程中插穗的细胞分化和代谢能力旺盛,相关酶的活性升高,可溶性糖含量积累; 处理组插穗扦插第39天可溶性糖含量升高到峰值(72.60 mg·g-1FW)。在生根后期,生根效果较好的处理组可溶性糖含量下降幅度更大,可能是处理组插穗生根数量较多,幼根有较强的代谢和呼吸作用,对糖类物质消耗较多所致。
由图5B可知,可溶性蛋白含量整体呈“升高—下降”的变化趋势,处理组峰值在第26天出现,比对照组提前13天。不定根诱导及启动期,处理组插穗可溶性蛋白含量高于对照,这可能是由于插穗生理活动旺盛,需要大量蛋白酶类参与。表达及伸长期,处理组插穗可溶性蛋白含量快速下降,不定根的大量表达及伸长消耗了大量的可溶性蛋白。而对照组可溶性蛋白含量峰值出现时间较晚。调查发现处理组插穗多成爆发式根系,这可能与前期可溶性蛋白的积累有关。在生根前,经外源激素处理插穗可溶性蛋白含量升高较快,并提前达到峰值,可见可溶性蛋白的积累有利于插穗生根。
由图5C可知,处理组插穗在生根期间全氮含量呈“上升—下降—缓慢上升”的变化趋势,而对照整体变化不大。扦插后,处理组全氮含量快速升高,18天时达到峰值(6.06 mg·g-1FW),可能是外源激素的刺激提高了细胞代谢水平,从而促进氮素向下运输并在基部大量积累,氮元素含量升高; 表达期,处理组全氮含量显著降低至谷值(4.02 mg·g-1FW),氮素可合成蛋白质和核酸等物质为根原基细胞发育提供能量和物质,因此含量降低; 不定根伸长期,总氮含量略有上升,可能是插穗形成的新根能够吸收营养物质,对自身氮素消耗减少。可见杜仲不定根形成过程中氮素化合物最先被消耗。
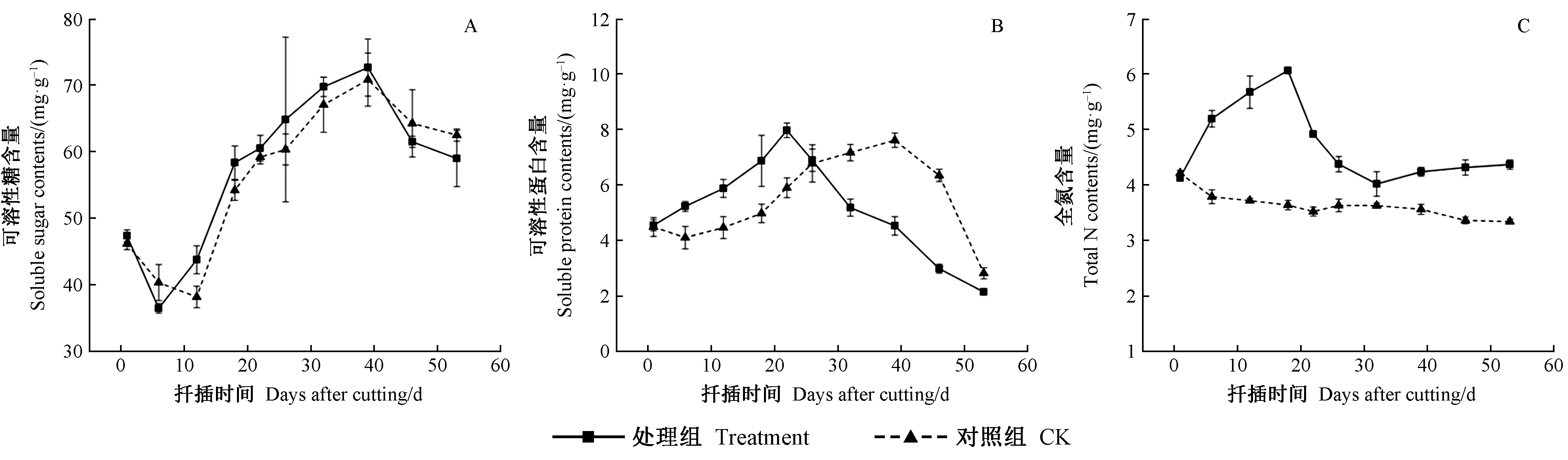
图5 杜仲嫩枝插穗生根过程中营养物质含量的变化
3 讨论
3.1 杜仲良种嫩枝扦插不定根发育特征
目前对扦插不定根发生形态解剖学研究主要集中在插穗的根原基类型、生根类型和茎的解剖结构3个方面(杜学梅等, 2019)。
根据插穗根原基形成方式及时间可分为潜伏根原基和诱导根原基(杜常健等, 2019a)。潜伏根源基在扦插前枝条本身就已存在,受离体刺激且条件合适时可继续发育为不定根,如欧美杂种山杨(Populustremula×P.tremuloides)(周容涛等, 2013); 诱导根源基是在扦插前枝条中不存在根原基,在扦插后经外源激素或适宜条件诱导方可产生(杜伟, 2016)。在杜仲枝条中未发现潜伏根原始体,不定根是由扦插后维管形成层外的薄壁细胞诱导分化形成的根原基发育而来,属于诱导根原始体类型。
根据插穗不定根形成部位可以划分为4种生根类型: 皮部生根型、愈伤组织生根型、侧芽或潜伏芽基部分生组织生根型和混合生根型(王涛, 1996)。杜仲插穗不定根绝大多数由基部皮层冒出,极少见到愈伤生根,杜仲以皮部生根为主,这与欧美杂种山杨(周容涛等, 2013)、侧柏(Platycladusorientalis)(杜常健等, 2019a)和小叶芳樟(Cinnamomumcamphoravar.linaloolifera)(梁晓静等, 2020)等结果相似。
根据生根解剖结构特征,通常把不定根的形成过程分为3个阶段: 诱导期、启动期、表达期(Danieletal., 2014; Lietal., 2008; Zhangetal., 2017; 张焕欣等, 2017; 周容涛等, 2013)。诱导期表示不定根起源细胞感知内外信号、提高代谢水平(Ahkamietal., 2009); 启动期以细胞分裂、分生组织形成、根原基的发育为特征(Ramirez-Carvajaletal., 2009); 而表达期的特征是根原基的生长并且伸出表皮层,形成肉眼可见不定根(Syrossetal., 2004; 张焕欣等, 2017)。有研究认为,插穗内部靠近韧皮部的皮层中存在数层纤维细胞构成的厚壁细胞,对根原基的生长有机械阻碍作用,导致插穗生根困难(杜常健等, 2019b; 梁晓静等, 2020; 张猛等, 2010)。王涛(1996)研究表明,在没有环状厚壁组织或厚壁组织不连续时,不定根发生较容易,反之生根困难。而厚壁组织可通过外源生长素刺激而打破(杜学梅等, 2019)。解剖发现在杜仲插穗皮层与韧皮部间存在连续的厚壁组织,阻碍生根。因此,杜仲皮层在生根前出现连续环状的厚壁组织和单一的生根方式可能是造成杜仲扦插生根困难和生根时间久的重要原因。
3.2 杜仲扦插生根生理学研究
3.2.1 内源激素与生根的关系 不定根的发生是受多种内源激素共同参与、共同调控的复杂过程(杜学梅等, 2019; 张焕欣等, 2017)。IAA在不定根生长发育过程中起着核心作用,国内外学者已经从多个角度进行了论证(Cibeleetal., 2013; 张晓平等, 2004)。Taramino 等(2007)研究认为,高浓度的IAA可使根系分生组织细胞分裂次数增加,而低浓度的IAA可加快根系伸长区细胞的分化。在麻楝(Chukrasiatabularis)、北美香柏(Thujaoccidentalis)等扦插生根试验中,均发现IAA含量在不定根形成的关键时期大幅度升高,在不定根长出后下降(王青, 2019; 刘明国等, 2010)。Naoki等(2011)发现蓝桉(Eucalyptusglobulus)品种体内IAA含量是难生根品种的2倍。IAA能促进插穗生根,具体作用主要体现在: 营养物质调配利用、调节酶活性及分子水平信号传导3方面(敖红等, 2002; 吴文浩等, 2016; 王青, 2019; 曹凡等, 2016)。本研究中,杜仲处理组插穗内IAA含量在不定根诱导及启动期大幅度升高,22天达到峰值,与解剖观察到的根原基出现时间基本一致,与对照比,处理组插穗IAA快速积累,达到峰值,有利于根原基的诱导分化。处理组插穗IAA峰值出现的时间比对照提前了17天,IAA含量提前快速升高可能是插穗提前生根的主要原因。因此认为IAA是促进杜仲插穗不定根形成的主要内源激素(欧阳芳群等, 2015)。
GA3主要促进细胞分裂和伸长,对不定根的形成有抑制作用。在不定根的诱导期下降明显(董胜君等, 2013; 刘明国等, 2010)。但也有研究认为GA3含量上升与插穗愈伤组织的诱导、不定根的形成呈正相关性(李朝婵等, 2012; 赵云龙等, 2013)。可见GA3对扦插生根的影响因树种差异而不同。本研究发现杜仲插穗GA3含量在不定根发生的关键时期呈下降趋势,这与山杏(Armeniacasibirica)、芽变毛白杨(Populustomentosa)、兴安圆柏(Juniperusdavurica)扦插过程中GA3的变化趋势(迟彦等, 2007; 董胜君等, 2013; 郭英超等, 2012)一致。生根过程中处理组插穗GA3含量始终高于对照,可能是外源激素处理在一定程度上提高了插穗基部GA3的含量,进而促进了淀粉、蛋白质的水解,促进不定根的生成。ABA可增强植物抗逆性,被称为胁迫激素,主要抑制扦插生根(侯江涛等, 2019)。在插穗刚脱离母体时,处理组ABA含量快速升高,而对照组含量却先降低后升高,处理组在不定根诱导期内ABA与GA3含量变化趋势一致,说明二者在感知受伤信号、提高插穗抗性方面具有协同作用,这与糙叶杜鹃(Rhododendronscabrifolium)结果(赵云龙等, 2013)一致。
ZR是木本植物体内细胞分裂素的主要运输形式,具有促进细胞分裂、分化和影响不定根形成的作用(Ramirez-Carvajaletal., 2009; Druegeetal., 2016)。许多研究认为,低浓度的ZR有利于插穗不定根的形成与发育,例如茶条枫(Acertataricumsubsp.ginnala)和北美香柏的嫩枝扦插(蔡楚恒, 2019; 刘明国等, 2010)。ZR对无患子(Sapindusmukorossi)扦插过程的生理作用较复杂,低含量的ZR有利于根原基的发生,但高含量的ZR促进不定根形成(韩继红等, 2019)。在杜仲插穗生根早期,ZR含量持续降低,有利于根原基的形成和分化。不定根表达期ZR含量大幅度升高有利于不定根的生长发育,这与无患子、长柄扁桃(Amygdaluspedunculata)等(韩继红等, 2019; 李斌, 2017)研究结果一致。
3.2.2 氧化酶活性与生根的关系 吲哚乙酸氧化酶(IAAO)、过氧化物酶(POD)、多酚氧化酶(PPO)是与植物扦插生根关系最为密切的3种氧化酶类(Naokietal., 2011; 杜伟, 2016; 侯江涛等, 2019)。IAAO通过调节插穗内IAA含量水平,从而影响其不定根的形成和发育(张焕欣等, 2017; 吴文浩等, 2016)。在不定根诱导阶段,较低活性的IAAO有利于插穗IAA的积累,以促进不定根的诱导和发生(Nagetal., 2001)。宋金耀等(2007)研究发现,易生根树种扦插后IAAO活性基本均呈下降趋势,而难生根树种则变化趋势相反,因此,IAAO活性的降低可使IAA含量升高,进而对根的形成过程有促进作用。本研究中,处理组杜仲插穗前期IAAO活性大幅度下降,正好对应IAA含量的大幅度升高。IAAO 活性变化与 IAA 含量变化高度吻合,呈此消彼长的关系,这与欧洲甜樱桃(Prunusavium)、北美香柏、茶树(Camelliasinensis)等扦插结果(刘明国等, 2010; 魏海蓉等, 2013; Rout, 2006)类似。PPO和POD参与植物体内多种生理生化过程。在细胞分裂分化、根原基的形成和生长以及逆境环境适应过程中起重要作用(Hayrullahetal., 2003)。POD参与生长素的代谢、呼吸、细胞壁的合成和伤害反应,与不定根的诱导和生长密切相关,活性升高是植物具有生根能力的标志(Barceloetal., 1990; 杜学梅等, 2019; Rout, 2006)。研究证明,在生根过程中,碱性和酸性POD先后被激活用于诱导生根和发育(Gasparetal., 1985; 杜学梅等, 2019)。扦插初期插穗感知受伤信号,POD活性升高,不仅响应逆境胁迫,还可清除插穗内部自由基等物质,由此认为扦插生根前高水平的POD活性对于生根有利(赵云龙等, 2013; 李斌, 2017; 魏海蓉等, 2013)。酚类物质抑制生根,PPO能够催化酚类物质合成一种生根的辅助因子—“IAA-酚酸复合物”以促进不定根形成(郑巧巧等, 2020)。PPO可在不定根起始部位影响细胞分裂分化及根原基的形成和生长(张焕欣等, 2017)。处理组杜仲插穗POD和PPO活性在前期升高,峰值出现时间正好对应插穗不定根发育的关键时期,不定根伸长阶段下降。说明杜仲生根剂提高了POD和PPO的活性,有效促进插穗生根(王新建等, 2009)。这与葡萄(Vitisvinifera)、欧洲甜樱桃扦插的结果(Hayrullahetal., 2003; 魏海蓉等, 2013)一致。
3.2.3 营养物质与生根的关系 插穗生根是一个需要消耗大量营养物质和能量的过程(张焕欣等, 2017)。可溶性糖、可溶性蛋白及含氮化合物作为能量及物质基础供应的主要来源,与根原基的形成关系密切(侯江涛等, 2019)。可溶性糖可直接作为呼吸底物被利用,为插穗生根提供必须的物质和能量(Husenetal., 2007; 张焕欣等, 2017); 可溶性蛋白为细胞生长提供物质基础,在扦插生根过程中一方面提供插穗生根所需的能量,另一方面在不定根发育过程中以蛋白酶类的形式参与调控多种生理生化过程(曹凡等, 2016; 王新建等, 2009); 氮元素化合物可诱导根原基的发生并为不定根的发育中核酸、蛋白质的合成提供原料(王青, 2019)。许多研究认为营养物质在生根前需要有一个积累的过程,在生根过程中被大量消耗(易咏梅, 2001; 陈宁, 2011; 许晓岗等, 2013)。杜仲插穗生根过程中全氮含量和可溶性蛋白含量先后在第18天和22天出现峰值,可能与氮类化合物是蛋白质的合成原料有关。可溶性糖含量在第39天达到峰值后才开始下降,生根数量较多的处理组下降幅度更大,可能与大量不定根自身较强的代谢和呼吸作用消耗大量糖类有关(王新建等, 2009; 陈宁, 2011)。
4 结论
杜仲不定根发生属于皮部诱导生根类型,根原基来源于形成层。其生根过程可划分为诱导期、启动期、表达期和伸长期4个阶段。杜仲扦插生根困难的主要原因之一是内源IAA含量低,抑制了根原基起始细胞的诱导。ABA虽抑制生根,但在不定根诱导期参与信号传导,提高插穗抗性; ZR在不定根表达期含量显著升高; GA3则主要在扦插初期和不定根伸长期发挥作用。POD和PPO活性整体呈“升高—下降”趋势,IAAO活性整体呈“下降—升高”趋势。杜仲生根剂可提高POD和PPO活性、抑制IAAO活性。可溶性糖、可溶性蛋白、氮素化合物主要表现为在生根前不断积累,含量升高,在生根后因大量消耗而含量降低。

