呼吸衰竭患者体外膜肺氧合治疗后心率、氧合指数改变及APACHEⅡ与SOFA评分对预后的预测价值
袁法伟 冯辉斌 尹欢 郑鲲 梅喜平 袁利学 祝小梅
1鄂东医疗集团黄石市中心医院(湖北理工学院附属医院)重症医学科,黄石 435000;2鄂东医疗集团黄石市妇幼保健院新生儿科重症监护室,黄石 435000
呼吸衰竭是严重呼吸功能障碍导致动脉氧分压(oxygen partial pressure,PaO2)下降,或是动脉二氧化碳分压增高而引起生理系统紊乱的临床综合征[1]。临床上大部分患者经传统治疗无效后应用体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)治疗,ECMO对肺功能有暂时性替代作用,对改善患者体积氧分压有重要作用,从而降低病死率[2]。陈海莉等[3]研究表明ECMO可以为呼吸衰竭患者给予氧供及血量,对心、肺、脑等重要器官均进行氧维持。但ECMO费用高,治疗难度较大,因此研究呼吸衰竭患者进行ECMO治疗后对其预后有预测价值的指标非常有必要。氧合指数(PaO2/FiO2)是常用评价氧合功能的指标[4];急性生理学及慢性健康状况评分系统(Acute Physiology and Chronic Health Evaluation,APACHEⅡ)及序贯器官衰竭评估(Sequential Organ Failure Assessment,SOFA)为国际通用重症患者病情程度、器官功能衰竭的评价指标[5]。基于此,本研究选取呼吸衰竭ECMO治疗患者为研究对象,分析心率、PaO2/FiO2改变及APACHEⅡ、SOFA评分对其预后的预测价值,具体研究报道内容如下。
资料与方法
1、一般资料
选取2016年2月至2021年2月在黄石市中心医院接受ECMO治疗的84例呼吸衰竭患者为研究对象。(1)适应证:①18周岁<年龄<65周岁;②导致重症急性呼吸衰竭的原发病具有潜在可逆性;③吸入纯氧且呼气末正压(PEEP)≥5 cmH2O(1 cmH2O=0.098 kPa)条件下,PaO2/FiO2<100 mmHg(1 mmHg=0.133 kPa);④肺泡动脉氧分压差>600 mmHg。(2)禁忌证:①有创机械通气时间>7 d[吸气峰压>30 cmH2O或吸氧浓度(FiO2)>80%];②有抗凝禁忌证;③存在不可逆的中枢神经系统损伤;④严重慢性肺疾病、终末期患者。
2、方法
ECMO建立:经皮穿刺建立。(1)本研究患者均选取静脉-静脉(V-V)模 式;(2)ECMO系统 离 心泵来 自 于MAQUET(德国);(3)调节好血流量,氧饱和维持在0.85~0.95,氧气流量∶血流量开始设置为1∶1,后逐步根据二氧化碳分压调整,使其维持在40 mmHg上下;(4)恒温水箱将体温维持在37℃,活化部分凝血活酶时间(APTT)维持在50~70 s;(5)患者在ECMO治疗中,呼吸机参数调节为“肺休息”,将吸气压减至20~25 cmH2O,PEEP调节至10~15 cmH2O,呼吸频率调至10次/min、FiO2<50%,密切观察患者肺功能恢复情况及病情改变,如ECMO血流量下降至2.0~2.5 L/min,可脱机。
通过查阅病历,并结合病案室电话进行随访整理出患者一般资料。包括体质量指数(BMI)、ECMO支持治疗时间、白细胞计数(white blood cell count,WBC)、PaO2、心率、APACHEⅡ评分、SOFA评分及PaO2/FiO2。
3、观察指标
(1)分析呼吸衰竭患者ECMO预后的影响因素。(2)观察心率、PaO2/FiO2改变及APACHEⅡ与SOFA评分对呼吸衰竭患者ECMO预后的预测价值[6-7]。
4、统计学方法
采用SPSS 22.0统计软件进行分析,计数资料以例(%)形式表示,行χ2检验,符合正态分布的计量资料用(±s)来表示,比较采用独立样本t检验;采用多因素logistic回归分析患者预后的影响因素;采用受试者工作特征曲线(ROC)评估各种指标对预后的预测价值,曲线下面积(area under the curve,AUC)≤0.8时诊断价值较低,AUC为0.8~0.9时具有中等诊断价值,AUC>0.9时具有较高诊断价值;以P<0.05为差异有统计学意义。
结 果
1、一般资料
84例接受ECMO支持的患者中,男45例、女39例,年龄为20~65(43.28±9.59)岁;病因:急性呼吸窘迫症(ARDS)68例、重症肺炎5例、中毒2例、心肌梗死3例、咯血6例。
2、患者不同预后单因素分析结果
84例接受ECMO支持的呼吸衰竭患者中,电话随访得知出院后180 d生存39例,为生存组;死亡45例,为死亡组。单因素分析结果显示,两组性别、年龄、BMI、体温、WBC及PaO2比较差异均无统计学意义(均P>0.05);ECMO支持治疗时间、APACHEⅡ评分、SOFA评分、PaO2/FiO2及心率差异均有统计学意义(均P<0.05)。见表1。
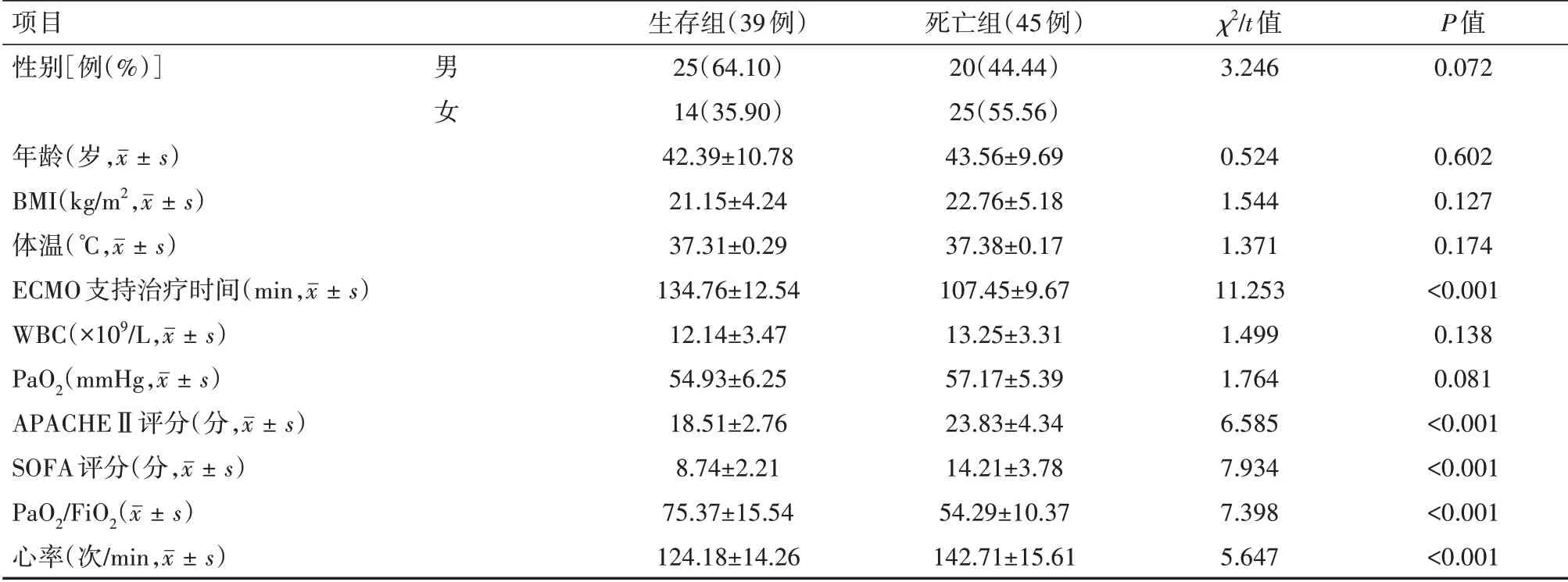
表1 不同预后的接受ECMO治疗的呼吸衰竭患者的单因素分析结果
3、患者预后多因素logistic回归分析
将单因素分析中差异有统计学意义的5项变量纳入多因素回归分析,以上述变量为自变量,死亡为因变量进行多因素logistic回归分析。结果显示,ECMO支持治疗时间过短、APACHEⅡ评分较高、SOFA评分较高、PaO2/FiO2降低及心率较快为患者死亡的影响因素,详见表2。

表2 接受ECMO治疗的84例呼吸衰竭患者预后影响因素的多因素logistic回归分析
4、心率、PaO2/FiO2、SOFA评分及APACHEⅡ评分对预后的预测价值分析
将心率、PaO2/FiO2、SOFA评分及APACHEⅡ评分指标纳入二元logistic回归模型行统计分析,得到四项指标回归的诊断概率,即四项联合指标。再建立各自ROC,见图1,ROC分析结果显示,心率、PaO2/FiO2、SOFA评分、APACHEⅡ评分及四项联合指标预测患者预后的AUC分别为0.855、0.858、0.863、0.857、0.991。可知,四项联合指标预测患者预后的价值高于单项指标,其灵敏度、特异度分别为95.6%、100.0%,详见表3。

图1 心率、PaO2/FiO2、SOFA评分及APACHEⅡ评分对接受ECMO治疗的84例呼吸衰竭患者预后的预测价值分析

表3 心率、PaO2/FiO2、SOFA评分及APACHEⅡ评分对接受ECMO治疗的84例呼吸衰竭患者预后的预测价值分析
讨 论
ECMO是通过一种特殊材料人工体外循环,从体内抽取静脉血,经氧合后注入患者的动静脉系统,起到部分心肺置换的作用,维持人体器官的氧合血供应,是一项常见的生命支持技术[8-9]。临床上针对呼吸衰竭和循环衰竭采取了相应的两种方式,分别是V-V和静脉-动脉(V-A)转流方式[10]。ECMO治疗呼吸衰竭最终目的是改善患者机体缺氧状态,而准确有效监测患者氧代谢变化是改善患者预后前提。近年来国外常用针对ECMO支持患者预后的评分系统进行预测[11],但效果不是很理想,因此,探讨相对成熟的指标或评分系统对ECMO支持治疗后患者预后的预测价值有一定临床意义,临床上广泛使用的危重症评分系统对患者预后有较好预测效果[12]。
既往有研究表明,呼吸衰竭患者ECMO支持治疗后病死率在50%左右[13],本研究通过回顾性分析84例经ECMO支持的呼吸衰竭患者,以接受ECMO支持后180 d为研究终点发现有45例患者死亡,病死率为53.6%。分析原因与性别、年龄、BMI、体温、WBC及PaO2等因素无关,多因素logistic回归分析显示,ECMO支持治疗时间过短、APACHEⅡ评分较高、SOFA评分较高、PaO2/FiO2较低及心率较快为患者180 d内死亡的影响因素。这说明ECMO支持治疗时间不足对患者预后影响较大,临床上应根据患者病情变化及撤机指征撤机。PaO2/FiO2是临床常用评价氧合功能的指标,陈智峰与贵春梅[14]研究指出早期获取的PaO2/FiO2对判断病情严重程度与评估预后作用不大,但其转变程度与患者预后有密切关系,这与本研究结论一致,PaO2/FiO2可影响患者预后。APACHEⅡ由急性生理学评分、年龄、既往健康评分组成,是世界重症监护室(ICU)普遍使用的评分系统[15]。此项指标对危重患者病情监测具有重要指导意义,同时是器官功能衰竭或是死亡的客观评价指标,多项研究表明APACHEⅡ评分对危重症患者ICU住院时间及预后能够有效预测[16]。APACHEⅡ评分越高,对患者预后越不利。SOFA可以快速评判患者血液循环、凝血功能、呼吸反应及神经功能,黄金桔等[17]研究指出SOFA对呼吸系统、心血管系统等危重疾病预后具有重要意义。呼吸衰竭患者因肺换气障碍,肺氧交换功能障碍,严重缺氧致患者心率加快,心率可以很好地反映患者机体氧状态[18-19]。本研究中死亡组患者心率较生存组快,说明其机体缺氧仍较严重。本研究ROC分析结果显示,心率、PaO2/FiO2、SOFA评分、APACHEⅡ评分及四项联合指标预测患者预后的AUC分别为0.855、0.858、0.863、0.857、0.991。可知,四项联合指标预测患者预后的价值高于单项指标,其灵敏度、特异度分别为95.6%、100.0%,在临床上应加强对以上指标及评分系统的监测,及时发现异常,及时纠正,以减少对患者预后的影响[20]。
综上所述,心率、PaO2/FiO2改变及APACHEⅡ与SOFA评分为呼吸衰竭患者ECMO治疗后预后的影响因素,同时对其预后有较好的预测价值,四项联合检测可以提高预测此类患者预后的准确度、灵敏度,值得在临床推广。但是本研究样本数较少、ECMO技术及后期管理尚存在争议,今后将扩大样本量,提高ECMO建立水平,研究出更多对患者预后有预测价值的指标及评分系统。
利益冲突 所有作者均声明不存在利益冲突

