血清和支气管肺泡灌洗液GM试验对非粒细胞缺乏患者不同类型肺曲霉病的诊断价值分析
张传明 曹泓宇 孙继德 牛司强 王詝 蒲姝丽 徐绣宇
(重庆医科大学附属第一医院检验科,重庆 400016)
肺曲霉病(pulmonary aspergillosis)是临床上常见的肺部真菌病之一,多见于免疫功能受损者或免疫功能正常但有潜在肺部病变者[1]。肺曲霉病通常分为三种类型[2]:变应性支气管肺曲霉病(allergic bronchopulmonary aspergillosis, ABPA)、慢性肺曲霉病(chronic pulmonary aspergillosis, CPA)和侵袭性肺曲霉病(invasive pulmonary aspergillosis, IPA)。肺曲霉病具体表现为何种类型在很大程度上取决于宿主的基本状态以及真菌与宿主之间的相互作用。肺曲霉病的临床症状缺乏特异性,其确诊标准为组织病理学找到曲霉侵袭组织的证据,但该方法在临床上实施较为困难;影像学检查、真菌培养等方法虽具有一定的辅助诊断作用,但其敏感性和特异性较低。近年来,有众多研究表明,检测血清和支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)中的半乳甘露聚糖(galactomannan, GM)含量对IPA的早期诊断具有良好的应用价值,但由于临床上纤维支气管镜灌洗操作缺乏统一的标准,BALF GM试验的最佳临界值(cut-off)仍存在一定的争议;此外,血清及BALF GM试验在其他类型肺曲霉病中诊断价值仍不明确,少量研究发现BLAF GM试验在CPA的诊断中同样具有良好的应用价值[3]。因此,本研究对我院近4年来同时送检过血清和BALF GM试验的不同类型肺曲霉病患者的资料进行分析,探讨血清和BALF GM试验在不同类型肺曲霉病中的诊断价值,并确定BALF GM试验对常见肺曲霉病的最优cut-off值,以期为临床诊断该类疾病提供辅助依据。
1 资料与方法
1.1 研究资料
选取重庆医科大学附属第一医院2017年1月至2021年3月同时送检过血清和BALF GM试验的肺部感染患者为研究对象,并剔除粒细胞缺乏者,收集患者的一般临床资料、基础疾病、临床诊断、真菌培养结果、GM试验结果等信息。
1.2 分组
研究组分为IPA组、CPA组和ABPA组。IPA诊断参考欧洲癌症研究和治疗组织/侵袭性真菌感染协作组(EORTC/MSG)2019年发布的标准[4],CPA诊断参考欧洲临床微生物学和感染性疾病联合会(ESCMID)2015年发布的《慢性肺曲霉病:理论基础和临床诊治指南》[5],ABPA诊断参考美国感染学会(IDSA)2008年制定的标准[6],但均不纳入仅依据GM试验阳性做出诊断的病例。对照组的纳入标准为同时期内无任何肺部曲霉感染证据(GM试验结果除外)但患有其他肺部疾病的病例,并且该病例在住院期间同时送检过血清和BALF GM试验。但由于符合纳入标准的病例较多,我们按月份每月随机选取2~3个病例纳入到对照组中。研究组和对照组的排除标准如下:粒细胞缺乏患者(中性粒细胞绝对数<0.5×109/L)或住院期间使用过免疫抑制剂的患者。
1.3 标本采集
宜采集患者空腹状态下的血清标本,并及时离心,如不能及时检测可置于2~8℃冷藏保存。支气管肺泡灌洗操作参照我国2017年发布的专家共识[7],BALF标本采集完成后应及时送检,如不能及时检测可置于2~8℃冷藏保存。
1.4 GM检测
采用Bio-Rad公司的曲霉抗原检测试剂盒(ELISA法)进行血清和BALF GM试验,操作严格按照说明书进行,最终用酶标仪读取每个样本的OD值,并计算GM指数(GMI),GMI为样本OD值/临界值对照OD值均值。
1.5 统计学分析
使用SPSS 25.0统计学软件进行数据分析,计量资料组间比较采用秩和检验,计数资料组间比较采用卡方检验,以P<0.05为差异具有统计学意义;使用MedCalc软件绘制ROC曲线,并计算最优cut-off值;计算选用不同cut-off值时GM试验的诊断性能。
2 结 果
2.1 临床资料
根据纳入标准,共筛选出146例肺曲霉病患者,其中IPA 97例(确诊5例,临床诊断53例,拟诊39例),CPA 39例(确诊2例,临床诊断19例,拟诊18例),ABPA 10例(确诊0例,临床诊断4例,拟诊6例);并随机选取132例同时期患有其他类型肺部疾病者作为对照组。ABPA组由于病例数较少,且血清和BALF GM试验在诊断ABPA时的曲线下面积均分别为<0.5和0.648,故未进行差异性比较和后续的诊断性能分析。与对照组相比,IPA组中男性患者、细菌性肺炎、糖尿病和低蛋白血症的比例均高于对照组,差异均有统计学意义(P<0.05);CPA组中男性患者、肺结核、尘肺和糖尿病的比例均高于对照组,差异均有统计学意义(P<0.05);在预后方面,IPA组住院期间死亡率高于对照组,差异有统计学意义(P<0.05),但CPA组住院期间死亡率与对照组相近,差异无统计学意义(P>0.05);IPA组和CPA组的血清、BALF GM结果均高于对照组,差异同样有统计学意义(P<0.05)。见表1。

表1 不同类型肺曲霉病患者的临床资料
呼吸道标本(痰或BALF)真菌培养结果显示,IPA组中有45例(46.4%)培养出曲霉,其中以烟曲霉最为常见,其次为黄曲霉;而CPA组中仅有4例(10.3%)培养出曲霉,鉴定结果均为烟曲霉;ABPA组也仅有1例(10.0%)培养出烟曲霉。由此可见,真菌培养在IPA组中的阳性率明显高于CPA组和ABPA组(P<0.05),但阳性率均<50%。见表2。
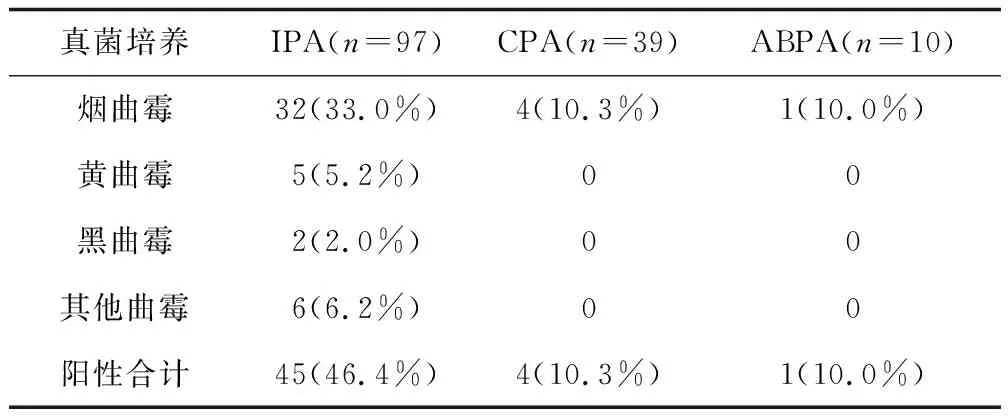
表2 不同类型肺曲霉病患者的真菌培养结果
2.2 ROC曲线
对血清和BALF GM结果在不同水平下诊断IPA和CPA的效能分别做ROC曲线分析,结果见图1和图2。在诊断IPA时,血清GM试验的最优cut-off值为0.43,曲线下面积(AUC)为0.707,敏感性为43.3%,特异性为93.9%;BALF GM试验的最优cut-off值为1.0,AUC面积为0.842,敏感性为74.2%,特异性为83.3%。在诊断CPA时,血清GM试验的最优cut-off值为0.15,AUC面积为0.688,敏感性为69.2%,特异性为65.2%;BALF GM试验的最优cut-off值为0.91,AUC面积为0.826,敏感性为74.4%,特异性为81.1%。
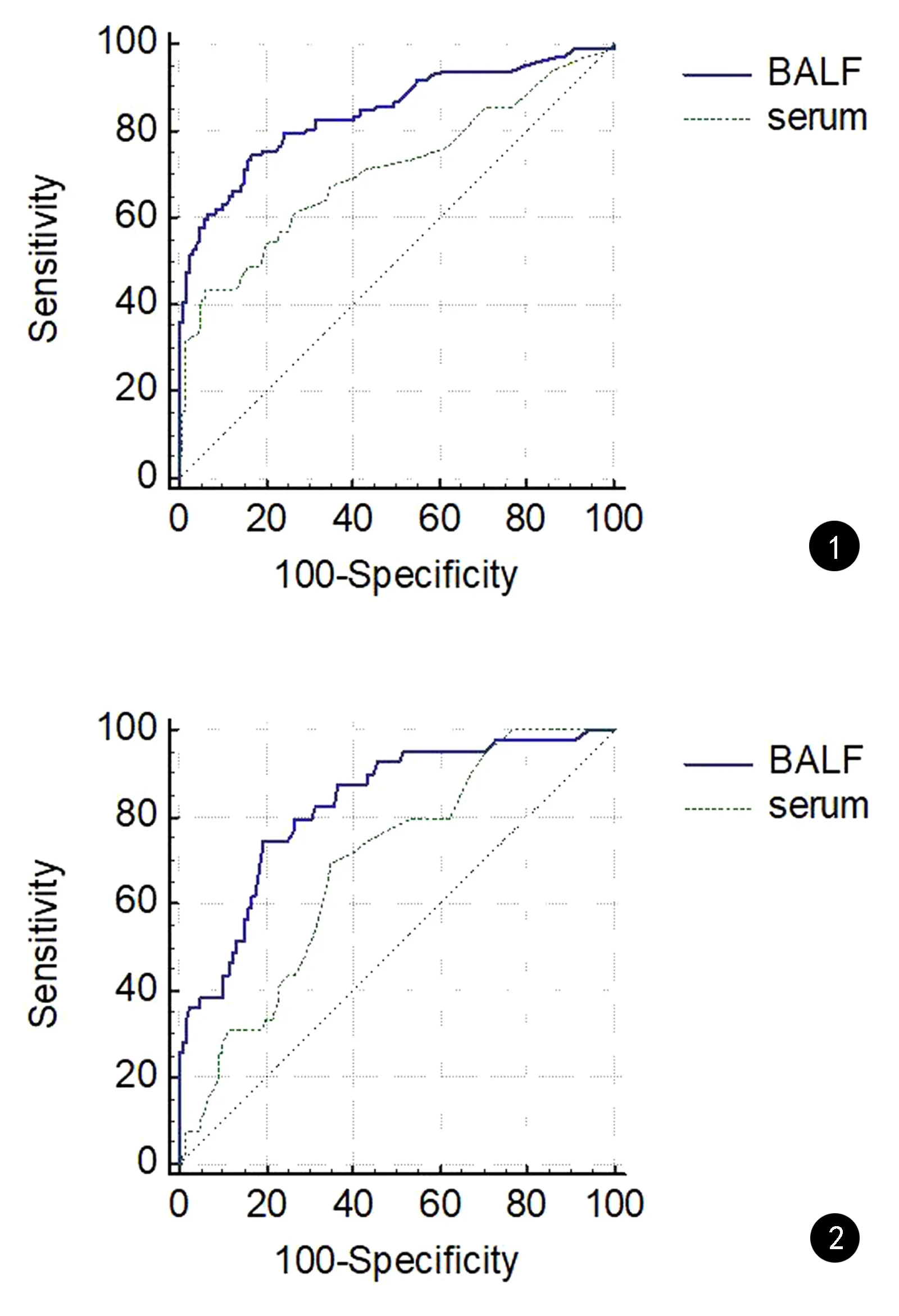
图1 血清和BALF GM试验诊断IPA的ROC曲线 图2 血清和BALF GM试验诊断CPA的ROC曲线
2.3 诊断性能
分别计算BALF GM试验在cut-off值分别为0.8、1.0、1.5和2.0时诊断IPA和CPA所对应的敏感性、特异性和约登指数;并计算血清GM试验在cut-off值分别为0.5和0.7时诊断IPA和CPA所对应的敏感性、特异性和约登指数。当血清GM试验cut-off值为0.5时,其诊断IPA的敏感性和特异性分别为41.2%和94.7%,诊断CPA的敏感性和特异性分别为10.3%和94.7%。当BALF GM试验cut-off值为1.0时,其诊断IPA的敏感性和特异性分别为74.2%和83.3%,诊断CPA的敏感性和特异性分别为61.5%和83.3%。增加血清和BALF GM试验的cut-off值可使该试验的特异性升高,但敏感性降低。见表3。
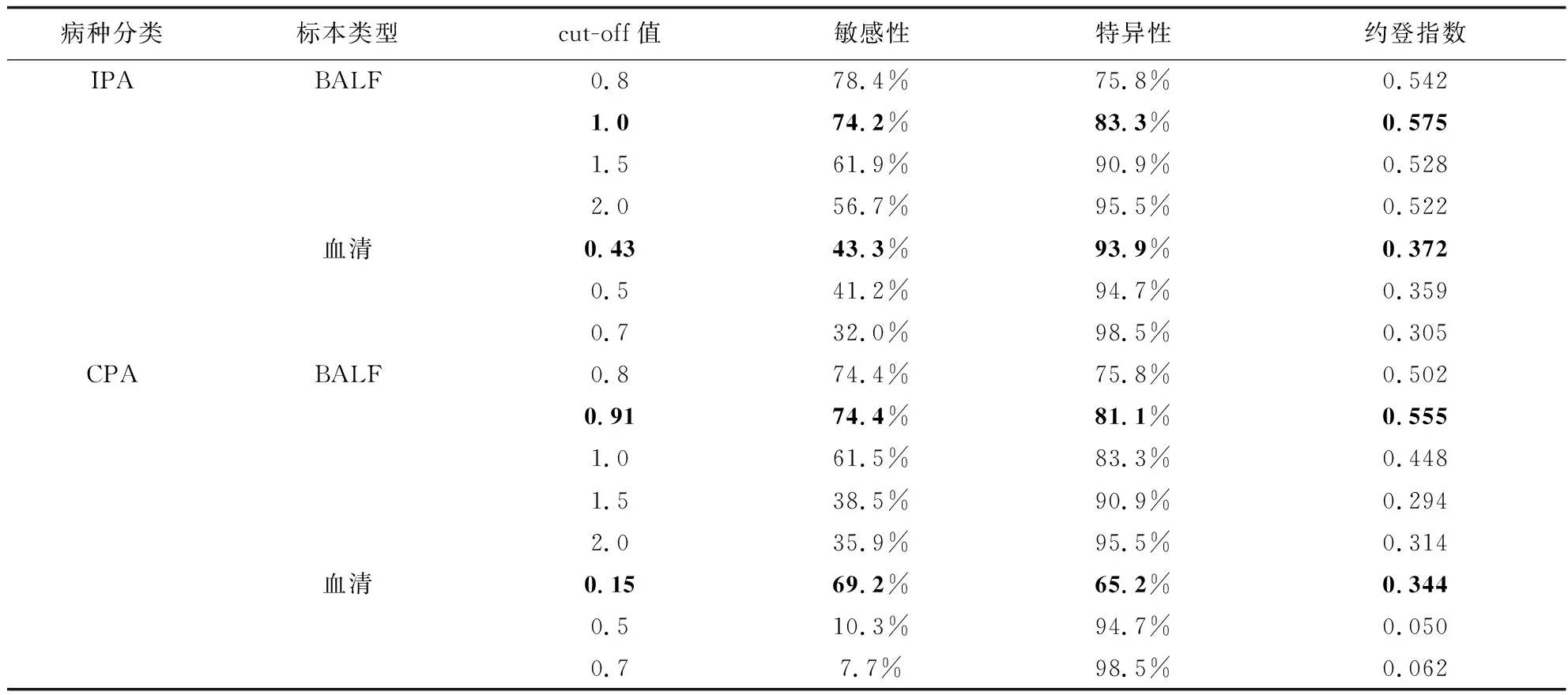
表3 血清和BALF GM试验不同cut-off值对IPA和CPA的诊断性能
3 讨 论
IPA是肺曲霉病中最常见的类型,且危害最为严重,好发于免疫功能低下的患者中。由于免疫抑制剂的大量使用、造血干细胞和实体器官移植的数量增加,IPA发病率持续增加。IPA的临床表现无特异性,可表现为干咳、胸痛、咯血等,因此诊断相对困难;影像学检查、痰涂片、真菌培养的敏感性和特异性较差,本研究中仅有46.4%的患者真菌培养阳性,如单纯依靠真菌培养来诊断IPA将会导致大量患者被漏诊。
半乳甘露聚糖(GM)抗原是曲霉细胞壁的特有成分,血清和BALF GM检测已被纳入IPA的诊断标准中。血清GM试验对不同人群的诊断性能也存在一定差异,例如其对免疫抑制患者的IPA诊断敏感性为71%、特异性为89%[8],而对非粒细胞缺乏患者的IPA诊断敏感性仅为38%、特异性为87%[9]。本次研究人群为非粒细胞缺乏患者,在cut-off值为0.5时,血清GM试验诊断IPA的敏感性为41.2%,特异性为94.7%,结果与文献[9]基本一致,但特异性略高。BALF GM试验对免疫抑制和非免疫抑制患者的诊断性能相似,例如其对免疫抑制患者的IPA诊断敏感性为84%、特异性为88%[8],对非粒细胞缺乏患者的IPA诊断敏感性为65%、特异性为90%[9]。本研究中,在cut-off值为1.0时,BALF GM试验诊断IPA的敏感性为74.2%,特异性为83.3%,结果也与文献[9]基本一致,但特异性略低。BALF GM试验结果易受灌洗量、回收量、标本性状(血性、黏稠状)等因素影响,正确且标准化进行支气管肺泡灌洗可提高该试验的敏感性。
CPA是一种侵袭肺实质的慢性曲霉感染,好发于患有肺部基础疾病者中,如肺结核、慢性阻塞性肺疾病(COPD)、支气管扩张等[10]。CPA患者的临床症状和影像学表现多为非典型性,因此CPA的诊断较为困难。此外,CPA病原学培养的敏感性较低[11],本研究发现仅有10.3%的患者真菌培养阳性,提示病原学培养对CPA的诊断作用较低。
目前,大量研究表明血清和BALF GM试验在IPA诊断中具有早期诊断作用, 其在CPA诊断中的作用也有少量报道,有研究[12]表明BALF GM试验在非免疫抑制患者CPA诊断中的敏感性为77.8%、特异性为90%。本研究中,BALF GM试验诊断CPA的最优cut-off值为0.91,其敏感性为74.4%,特异性为81.1%,结果与文献报道基本一致。但血清GM试验在CPA诊断中的作用有限,有研究发现[13]仅有23%的CPA患者血清曲霉抗原为阳性。本研究中,在cut-off值为0.5时,血清GM试验诊断CPA的敏感性仅为10.3%,特异性为94.7%。国内一项研究[14]也发现血清GM试验在CPA诊断中敏感性较低的现象。与GM试验相比,血清特异性曲霉IgG抗体在CPA的诊断中具有重要作用,有研究报道[10]其在CPA诊断中的敏感性为84.1%,特异性为89.6%。
ABPA是一种由机体对寄生于支气管内的曲霉产生超敏反应而导致的感染性肺疾病,主要发生于哮喘和囊性纤维化(cystic fibrosis, CF)患者中[15],主要症状有发热、咳嗽、喘息等。由于临床表现与哮喘和CF相似,ABPA的诊断率较低(尤其在发展中国家中)。ABPA患者可出现外周血嗜酸性粒细胞增多以及血清总IgE水平升高。特异性曲霉IgE抗体是ABPA的最佳筛选试验,当其>0.35 kUA/L时敏感性为100%[16]。有关GM试验在ABPA诊断中的作用研究较少,Agarwal等[17]研究发现血清GM试验对诊断ABPA的敏感性仅为25.7%。本研究中ABPA病例数较少,血清和BALF GM试验在诊断ABPA时的曲线下面积均<0.65,可能提示GM试验对ABPA的诊断作用非常有限。
综上所述,在非粒细胞缺乏患者中,BALF GM试验对IPA和CPA的诊断均有良好辅助诊断作用,其最优cut-off值分别为1.0和0.91,对ABPA的诊断作用有限;血清GM试验对IPA和CPA的诊断敏感性较低,对ABPA的诊断作用更差。

