麻风树叶提取物多酚与黄酮分析及对肉鸡盲肠微生物多样性的影响
和贵文 和云凤 陈粉粉 李恩良 李青青 郭爱伟
摘要:通过在肉鸡饲粮中添加麻风树叶提取物( Jatropha curcas leaves extract,JCLE),探讨JCLE对肉鸡肠道微生物多样性的影响,为JCLE在家禽生产中应用提供理论依据。试验选取健康的1日龄铁脚麻肉仔鸡300羽(公母比为 1 ∶1),随机分为5组,分别为ACG(对照组,基础饲粮+15 mg/kg杆菌肽锌)、JCLE20(基础饲粮+200 mg/kg JCLE)、JCLE60(基础饲粮+600 mg/kg JCLE)、JCLE100(基础饲粮+1 000 mg/kg JCLE)、JCLE140(基础饲粮+1 400 mg/kg JCLE),每组5个重复,每个重复12羽,试验期为42 d。在试验结束后屠宰,取盲肠内容物,对样品进行16S rRNA基因的V3~V4区测序,阐明麻风树叶提取物对肉鸡肠道微生物多样性的影响。结果表明,麻风树提取物中多酚含量高于黄酮,提取的麻风树提取物中多酚为(544.31±17.11) mg/g,黄酮为(482.21±12.58) mg/g。饲粮中添加JCLE可提高拟杆菌门(Bacteroidetes)、互养菌门(Synergistetes)相对丰度,并降低变形菌门(Proteobacteria)丰度;在属水平上提高了拟杆菌属( Bacteroides)和Odoribacter 的丰度( P <0.05),降低了弯曲杆菌属( Campylobacter )、大肠埃希杆菌_志贺氏杆菌属( Escherichia_Shigella )的丰度。乳酸杆菌属( Lactobacillus )的丰度在ACG和JCLE100中较高,但差异不显著( P >0.05)。表明添加JCLE对于改善家禽肠道健康、维持家禽的可持续生产具有非常重要的意义,但JCLE-肠道微生物-宿主内在机制还有待于进一步研究。
关键词:麻风树叶;提取物;肉鸡;盲肠;微生物多样性
中图分类号:S831.5 文献标志码: A
文章编号:1002-1302(2022)07-0165-07
收稿日期:2021-06-21
基金项目:国家自然科学基金(编号:3140609、31860650);云南省优势特色重点学科生物学一级学科建设项目(编号:50097505)。
作者简介:和贵文(1996—),男,云南丽江人,硕士研究生,主要从事家禽营养与肠道健康方面的研究。E-mail:963052726@qq.com。
通信作者:郭爱伟,硕士,副教授,主要从事家禽营养与肠道健康方面的研究。E-mail:g.aiwei.swfu@hotmail.com。
麻风树( Jatropha curcas L.)为大戟科(Euphorbiaceae)膏桐属( Jatropha )植物,别称小桐子、膏桐、黄肿树等,起源于墨西哥及中美洲,在我国主要分布于广东、广西、云南、贵州、四川、台湾、福建、海南等省份的热带及干热河谷地区,其中,云南主要栽培在滇西、滇西南、滇中及红河、金沙江、澜沧江、小绿汁江流域[1-2]。麻风树在热带地区常作为民间用药,主治胃肠炎、肿痛、皮肤瘙痒等疾病。借助于现代分析技术,科研人员已从麻风树中分离得到了许多生物活性物质如黄酮类、木脂素类、香豆素类等多酚类化合物,而植物多酚具有抗肿瘤、抗氧化、抗肥胖、抗菌消炎等多种生物活性功能[2]。目前,麻风树提取物已被证实在体外具有抑菌、杀虫等作用,有些活性成分还具有一定的抗HIV病毒和抗肿瘤活性[3]。麻风树的有效成分主要存在于种子、皮、叶、根中,范树国等研究表明,麻风树茎、根、叶的总黄酮含量分别为0.42%、3.05%、4.87%,表明麻风树叶是黄酮含量最高的部位[4]。刘娟等报道,麻风树提取物对细胞的毒性较小,既能抑制单纯疱疹病毒在胞内的增殖,又能直接灭活该病毒,对白色念珠菌、金黄色葡萄球菌和大肠杆菌具有极强的杀灭作用[3,5]。曾礼华等研究表明,麻风树叶提取物在体外对鸡大肠杆菌( Escherichia coli)、金黄色葡球菌(Staphylococcus aureus )抑菌结果表明,麻风树叶提取物对鸡大肠杆菌、金黄色葡萄球菌均有抑制作用,对大肠杆菌的抑菌作用优于对金黄色葡萄球菌[6]。
目前,关于麻风树提取物的体外抗菌方面有些零星的报道,但多数是从抑菌效果方面探讨的,没有在家禽体内探讨其对家禽肠道微生物的影响规律,因此,本研究在前人研究麻风树提取物化学成分的基础上,以肉鸡为研究对象,将麻风树提取物添加到肉鸡饲粮中,探讨麻风树提取物对肉鸡肠道微生物的影响规律,为开发绿色的植物提取物生长促进剂和免疫增强剂提供理论依据,同时有望将其开发成为抗生素的替代品。
1 材料与方法
1.1 试验时间和地点
试验于2018年9—11月在云南省昆明市西南林业大学生命科学学院动物养殖房进行。
1.2 麻风树叶提取物(JCLE)制备
采集新鲜麻风树叶(云南省墨江县)陰干后用中药粉碎机进行粉碎,过40目筛,收集样品置于 -20 ℃ 冰箱贮存,备用。JCLE提取方法参照杨帆[7]提取植物多酚的方法。
1.3 主要试剂和设备
芸香苷标准品(纯度>98%)、没食子酸标准品(纯度>98%)为Sigma试剂。
中草药粉碎机,RV8 S96旋转蒸发仪(德国IKA),超声波清洗器(上海冠特),TU-1901紫外可见分光光度计(北京普析)。台式高速离心机(Centrifuge 5418,Eppendorf),PCR 仪(Bio-rad),凝胶成像仪(Tanon),电泳仪(Tanon)。
1.4 试验设计
选取健康的1日龄铁脚麻肉仔鸡300羽(公母比为1 ∶1),随机分为5组,分别为ACG(基础饲粮+15 mg/kg杆菌肽锌)、JCLE20(基础饲粮+200 mg/kg JCLE)、JCLE60(基础饲粮+600 mg/kg JCLE)、JCLE100(基础饲粮+1 000 mg/kg JCLE)、JCLE140(基础饲粮+1 400 mg/kg JCLE),每组5个重复,每个重复12羽,各组初始体质量差异不显著( P >0.05),试验共42 d。
1.5 试验饲粮
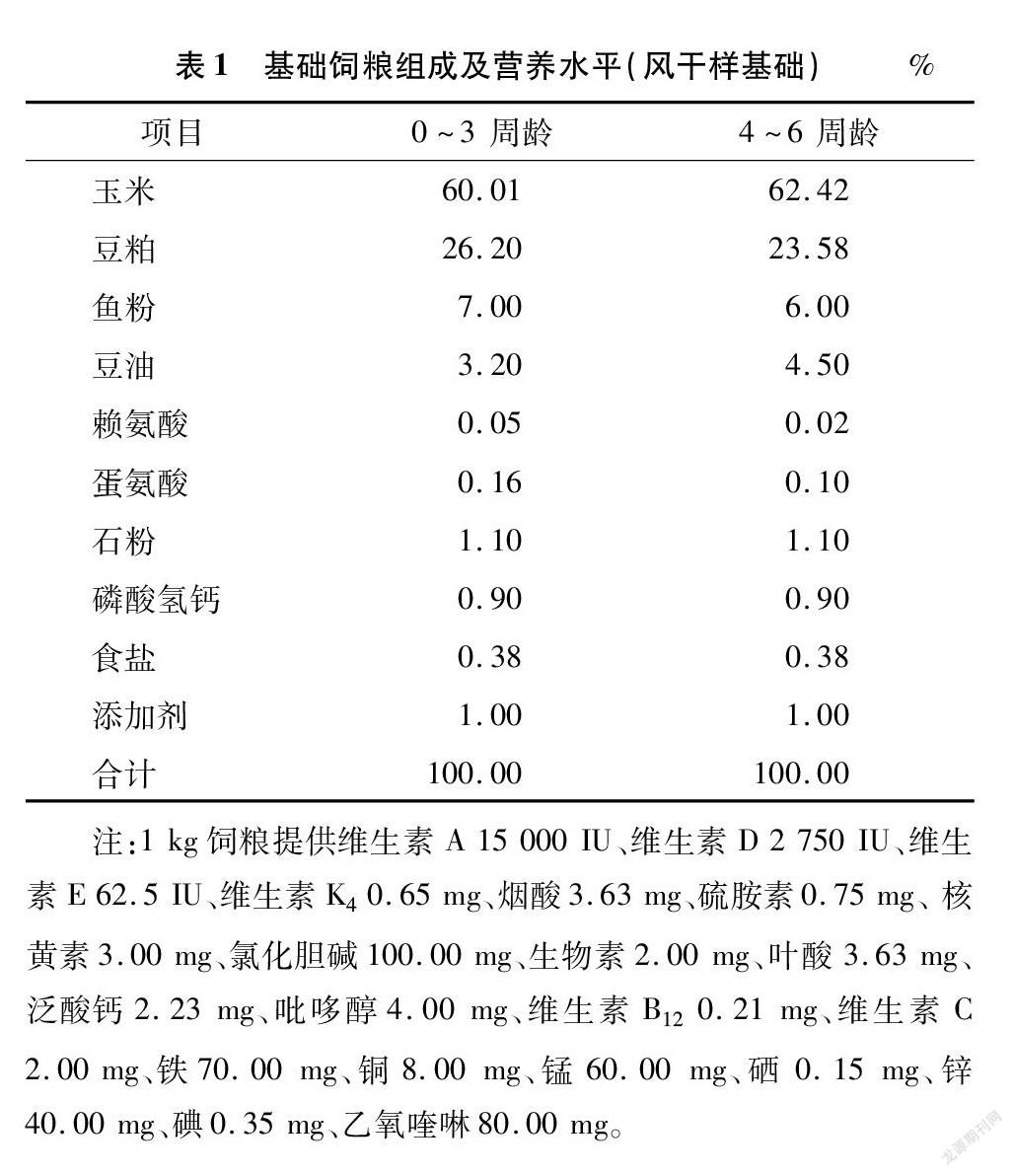
饲粮参照NRC(1994)家禽营养需要配制[8],主要原料有玉米、豆粕、鱼粉、豆油、赖氨酸、蛋氨酸、石粉、磷酸氢钙等,饲粮组成及营养水平见表1,饲料为粉料。
1.6 试验动物的饲养管理
采用舍内3层笼养,自由饮水、采食,试验期间光照采用24 h连续光照法,1~6日龄保持舍内为32~35 ℃,7~10 日龄保持舍内为30~32 ℃,11~21 日龄保持舍内为25~29 ℃,22 日龄至试验结束保持舍内为25 ℃。按肉鸡的饲养规范进行常规免疫。
1.7 主要的测定指标
1.7.1 JCLE中黄酮和多酚含量的测定
1.7.1.1 多酚含量测定
精确称取没食子酸 10 mg,用蒸馏水溶解并定容到100 mL(0.1 mg/mL标准溶液),用95%乙醇稀释成0.000、0.004、0.008、0.012、0.016、0.020 mg/mL,取不同濃度溶液各1 mL加1 mL Folin-Ciocalteu(0.25 mol/L)后混匀,静置3 min后加入2 mL 15% Na 2CO 3溶液,混匀,静置30 min,4 000 r/min 离心3 min,取上清液在波长760 nm测定吸光度,每个浓度重复4次,制作标准曲线。将JCLE进行梯度稀释(103、105、107),重复以上步骤测定吸光度,并通过吸光度和标准曲线计算多酚含量[7]。
1.7.1.2 黄酮含量测定
准确称取芸香苷标准品10 mg,加体积分数60%乙醇溶液(无水乙醇 ∶蒸馏水=6 ∶4)定容于25 mL容量瓶中,得质量浓度为0.4 mg/mL对照品溶液,并配置好5% NaNO 2溶液、10% Al(NO 3) 3溶液、4% NaOH溶液待用。移取对照品溶液7份,分别稀释成0.00、0.05、0.10、0.15、0.20、0.25、0.30 mg/mL的对照品溶液。分别吸取5 mL上述稀释后对照品溶液置于10 mL比色管中,加5% NaNO 3 0.5 mL,放置6 min,加10% Al(NO 3) 3 0.5 mL,放置6 min,再加4%氢氧化钠 4 mL,摇匀,放置15 min后于510 nm处测定吸光度,绘制标准曲线。将JCLE进行梯度稀释(103、104、105),重复以上步骤测定吸光度,并通过吸光度和标准曲线计算黄酮含量[9]。
1.7.2 盲肠微生物16S rRNA 基因测序
42 d时每组随机选择5羽健康公鸡静脉放血处死,剖开腹腔,采用75%乙醇对盲肠外壁消毒,用灭菌手术刀切断盲肠,取靠近盲肠末端的肠道食糜1 g到已灭菌冻存管中,液氮速冻保存,-80 ℃冰箱中保存。提取细菌总DNA,利用Illumina MiSeq平台进行Paired-end 150测序,对样品进行16S rRNA的 V3-V4区测序。按照97%的相似度归类操作分类单元(OTUs),去除序列数量少的OTUs,然后进行生物信息学分析,主要包括细菌Alpha多样性和Beta多样性,并分析了各组微生物在门、属水平上的差异。获得分类学信息并分别在门(phylum)和属(genus)分类水平统计各样本的群落组成。
1.8 数据统计分析
试验数据采用 SPSS 22.0进行单因素方差分析(one-way ANOVA),数据结果以“平均值±标准误”表示。差异显著性比较采用Duncan s法多重比较法。
2 结果与分析
2.1 JCLE中多酚和黄酮含量的比较
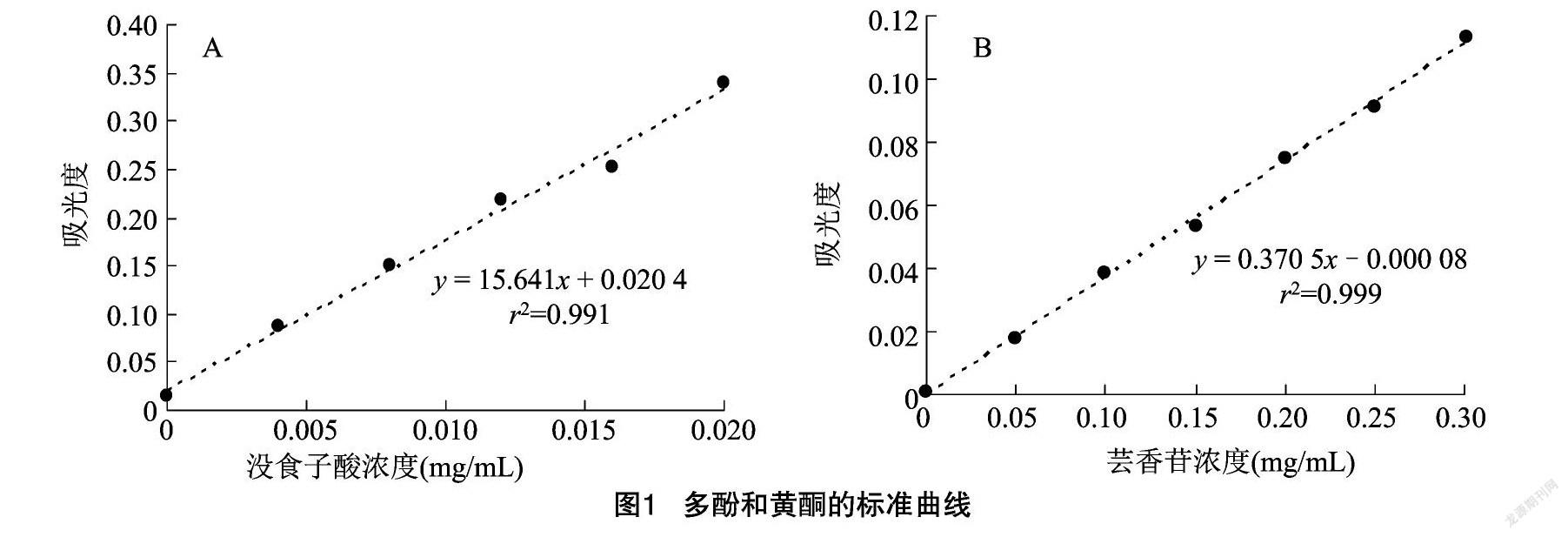
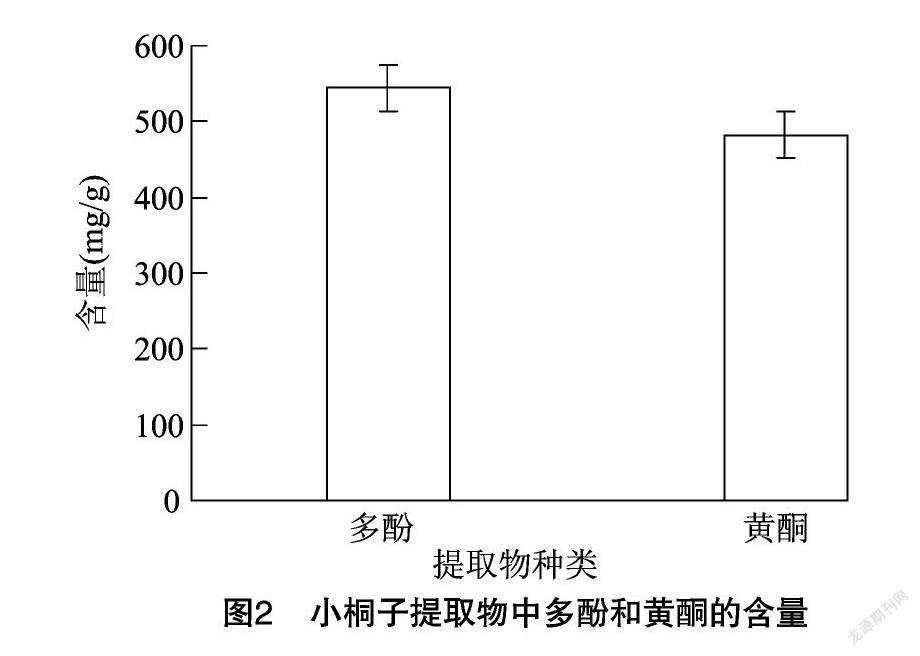
以质量浓度( C )对吸光度(Abs)进行回归分析,获得芸香苷标准曲线方程 y=0.370 5x -0.000 08( r 2=0.999);没食子酸标准曲线方程为 y=15.641x +0.020 4( r 2=0.991)(图1)。通过标准曲线计算麻风树提取物中的多酚和黄酮,由图2可知,麻风树提取物中多酚含量高于黄酮,提取的麻风树提取物中多酚为(544.31±17.11) mg/g,黄酮为(482.21±12.58) mg/g。
2.2 饲粮中添加JCLE对肉鸡盲肠微生物多样性的影响
2.2.1 测序深度和OTU分析
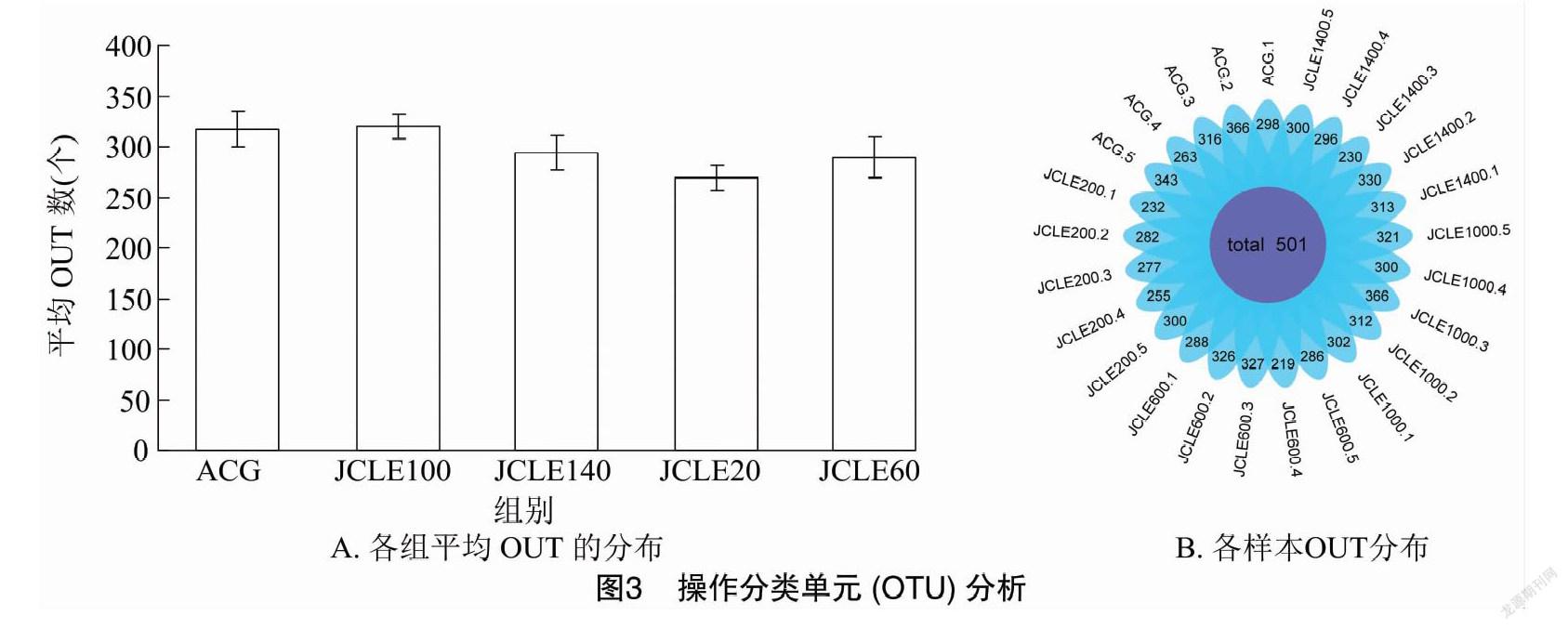
由图3可知,对30羽肉鸡(每组5羽)盲肠食糜进行16S rRNA的 V3-V4区测序,所有试验样品共得到有效序列 750 052 条,平均每个样品含(30 002±1 464) 条。获得的有效序列在不同分类水平上进行物种注释,共获得501个OTU,属10个门、19个纲、26个目、43个科、97个属。其中,各组间共有OTU数为345个,ACG、JCLE20、JCLE60、JCLE100、JCLE140平均OUT数分别为(317±40)、(269±26)、(289±44)、(320±27)、(294±38)个。
2.2.2 物种α多样性的影响
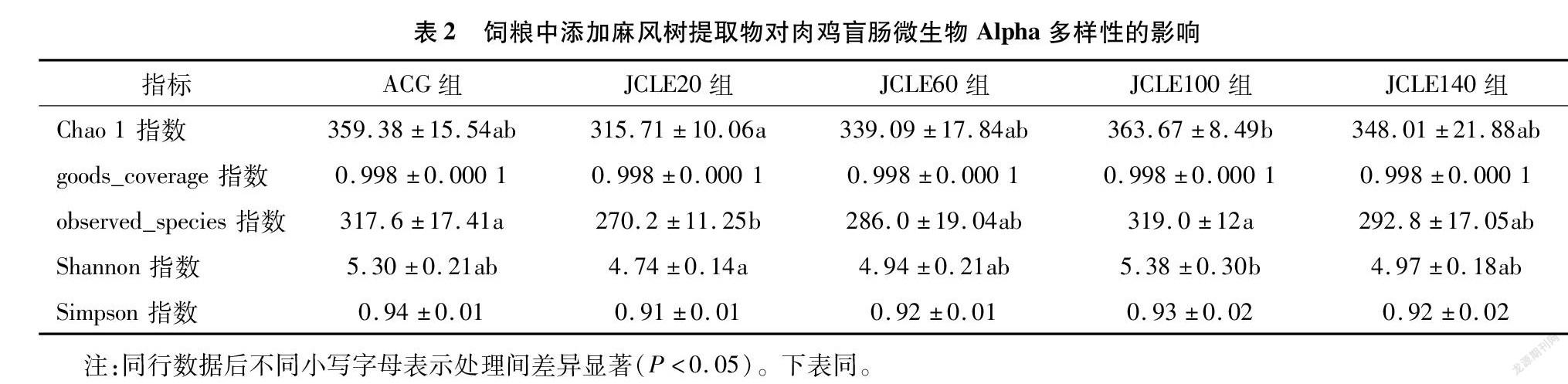
由表2可知,各组 α 多样性指数覆盖率(goods_coverage)接近1.00,表明每组的数据可反映真实的盲肠微生物群水平。从goods_coverage和Simpson指数来看,试验组和对照组间差异不显著( P >0.05)。从Chao 1指数来看,JCLE20显著低于JCLE100( P <0.05),JCLE140、JCLE60、JCLE20与ACG差异不显著( P >0.05);observed_species指数JCLE100显著高于JCLE20( P <0.05),JCLE60、JCLE100、JCLE140与ACG差异不显著( P >0.05);Shannon指数JCLE100显著高于JCLE20( P <0.05),JCLE60、JCLE100、JCLE140与ACG差异不显著( P >0.05)。以上 α 多样性指数(Observed_species指数、Chao1指数、Shannon指数、Simpson指数)共同表明,添加抗生素的对照组与JCLE60、JCLE100、JCLE140盲肠微生物物种丰度和多样性接近,而JCLE20盲肠微生物物种丰度和多样性都较低。
2.2.3 物种β多样性的影响
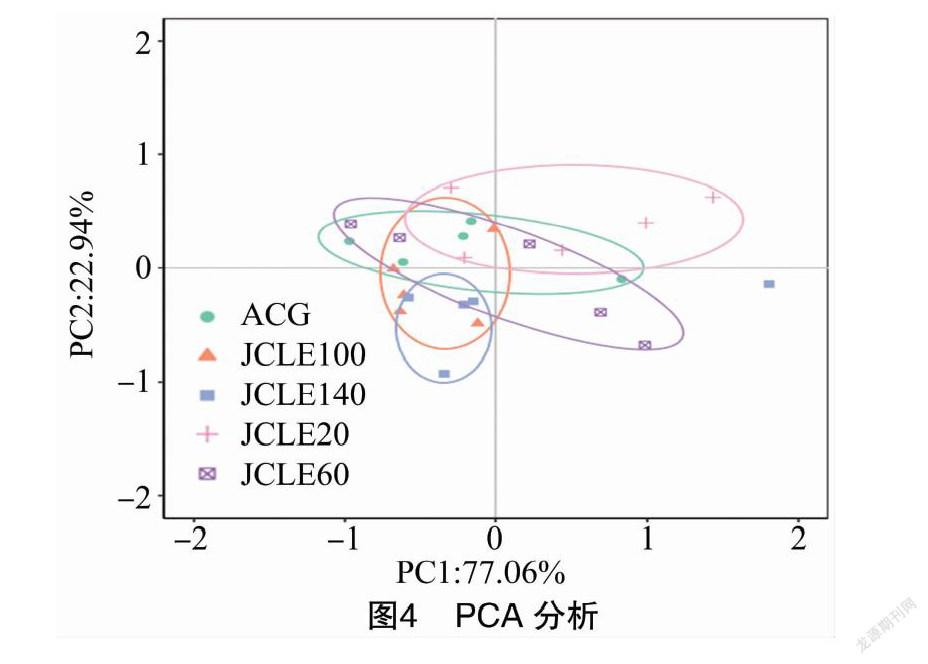
由图4可知不同样品间相对距离,ACG和JCLE20、JCLE60和JCLE100盲肠内容物的β多样性接近,而与JCLE140的β多样性差异较大。
2.2.4 门和属水平上的微生物物种相对丰度
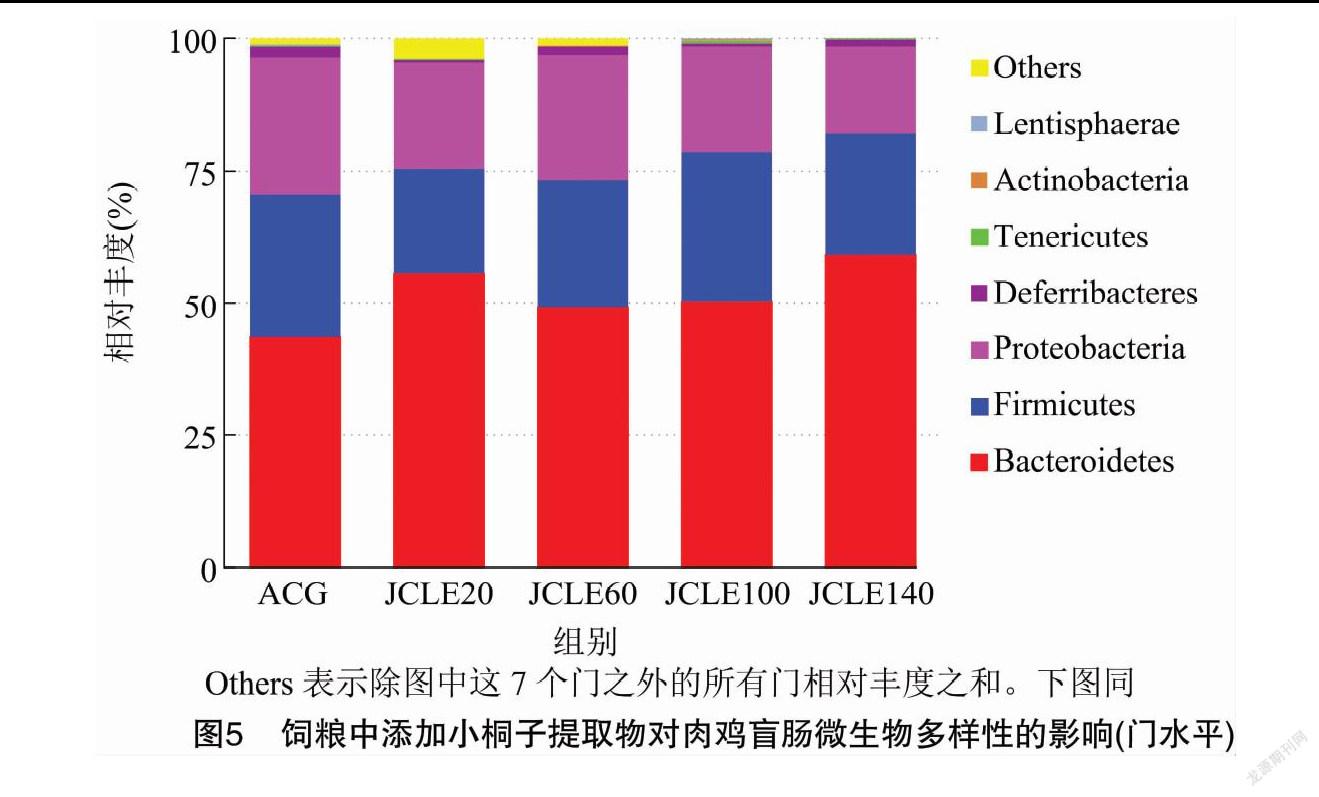
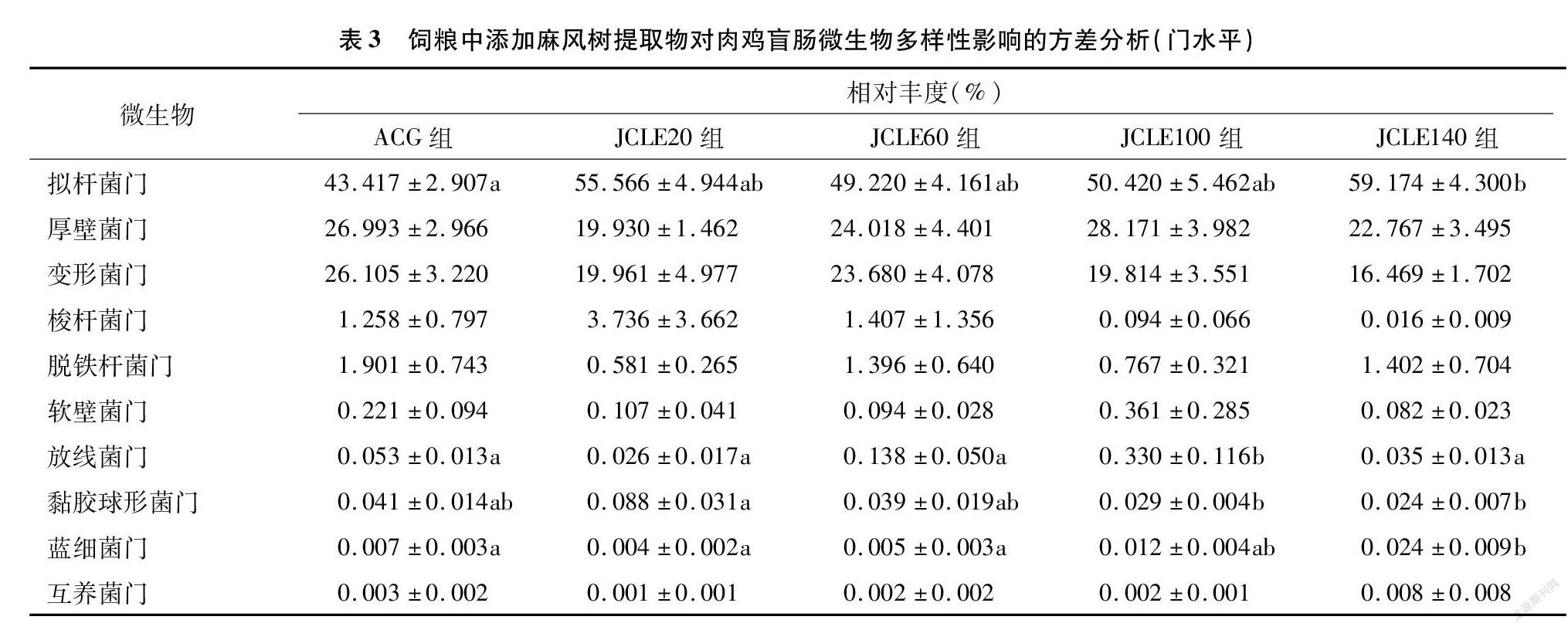
从门水平观察,由图5和表3可知,各组盲肠菌群在门水平主要以厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)为主。与ACG相比,添加JCLE提高了拟杆菌门(Bacteroidetes)相对丰度,而降低了厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)的丰度。从添加的剂量来看,JCLE140提高了拟杆菌门(Bacteroidetes)、蓝细菌门(Cyanobacteria)、互养菌门(Synergistetes)相对丰度,并降低变形菌门(Proteobacteria)丰度。JCLE100则提高了厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、软壁菌门(Tenericutes)丰度。
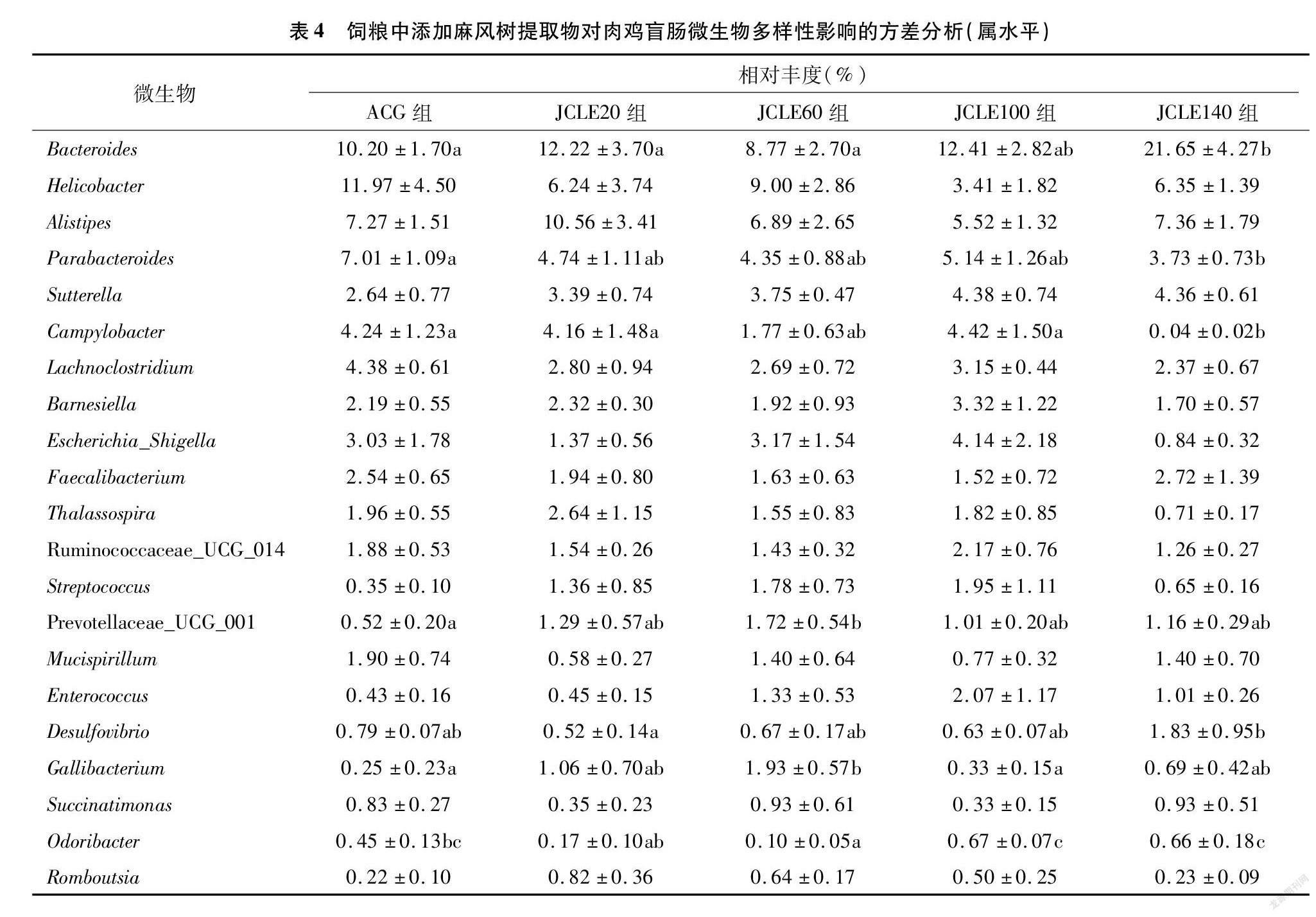
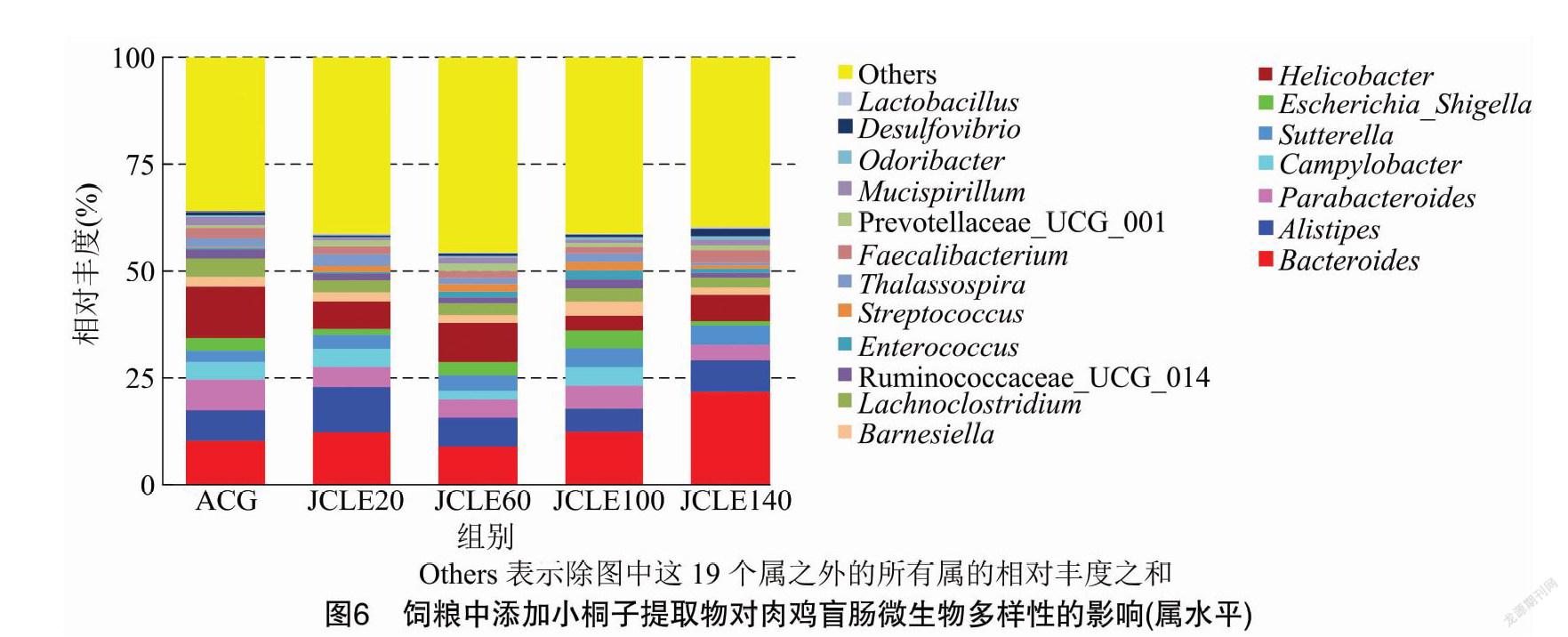
从属水平观察,由图6和表4可知,42日龄铁脚麻肉鸡盲肠微生物主要是拟杆菌属( Bacteroides)、另枝菌属(Alistipes)、副拟杆菌属(Parabacteroides)、巴恩斯氏菌属(Barnesiella)、粪杆菌属(Faecalibacterium) 为主。添加JCLE可以改变肠道菌群结构,JCLE140显著增加了拟杆菌属( Bacteroides) 的丰度( P <0.05),降低了弯曲杆菌属( Campylobacter) 的相对丰度( P <0.05)。与ACG相比,JCLE降低了幽门螺杆菌属( Helicobacter) 的丰度,JCLE20和JCLE140降低大肠埃希杆菌_志贺氏杆菌属( Escherichia_Shigella )的丰度。添加JCLE后,JCLE60 Prevotellaceae_UCG_001丰度显著高于ACG。JCLE100和JCLE140具有提高 Odoribacter 丰度的作用。
3 讨论与结论
肠道不仅是机体营养物质消化、吸收、代谢的重要场所,也是机体最大的免疫器官,禁抗后维护肠道健康对家禽的健康养殖至关重要。目前很多研究表明,肠道微生物菌群结构的变化会影响家禽肠道健康和生产性能。肠道菌群被认为是维持宿主肠道健康的重要因素,通过调节营养、代谢和免疫等多种生理功能发挥重要的作用,被称为机体的第二大脑[10-12]。鸡肠道内存在的微生物群包括数百种细菌,在门水平上主要有厚壁菌门、拟杆菌门、变形杆菌门和放线杆菌门等[13]。肠道中的微生物通过与宿主相互作用影响宿主的许多生理功能,乳酸杆菌属( Lactobacillus)、 瘤胃球菌属(Ruminococcus) 和梭菌属( Clostridium) 中的几种细菌类型与动物生产性能的改善有关[14]。
植物中含有丰富的酚类化合物,目前研究表明,植物多酚具有抗氧化、抗肿瘤、抗炎、抗肥胖、降血脂和抗菌等功效[15-16],还可以通过调控肠道微生物来改善机体的健康,有研究表明,肠道微生物一方面通过将植物多酚转化为活性更高的酚类代谢物来提高其生物活性[17-18],另一方面可促进或阻止微生物的生长来调控肠道健康,对肠道致病性细菌发挥类似益生元的作用或抗菌活性来调节肠道微生态平衡[19]。Sun等研究表明,乌龙茶、绿茶和红茶中的多酚提取物通过增加双歧杆菌属( Bifidobacterium spp.)、乳杆菌属( Lactobacillus spp.)、肠球菌属( Enterococcus spp.)显着影响鸡肠道微生物组成来改善家禽的健康[20]。此外,有研究表明,红葡萄提取物促进了 Alistipes、克雷伯氏菌属(Klebsiella)、Cloacibacillus、Victivallis 和Akkermansia 的生长,而拟杆菌属(Bacteroides)、Bifidobacteria、Blautia coccoides、Subdoligranulum 和Anaeroglobus 等菌的生长减少[21]。许多研究表明,拟杆菌门是肠道内的有益菌,可直接介导碳水化合物、类固醇、胆汁酸和糖类的代谢,而厚壁菌门则与体内的能量代谢和脂质沉积有关[22-23]。有研究表明, Odoribacter 和Bacteroides 是家禽肠道中2种常见的细菌,属于与营养代谢正相关的拟杆菌科,这些微生物具有维持肠道完整性和提高免疫力等多种生理功能。 Parabacteroides distasonis 被认为是肠道中的有益细菌,可通过产生琥珀酸和胆汁酸来调节宿主的新陈代谢并减轻新陈代谢的功能障碍[23-24]。研究表明,鸡盲肠群落的优势菌门是厚壁菌门(Firmicutes),但也有报道称其优势菌门是拟杆菌门(Bacteroidetes)。本试验结果表明,Bacteroidetes是42日龄肉仔鸡盲肠微生物群落的优势菌门,与张雪等报道的结果[25-26]一致。Claesson等在人类上的研究表明,低剂量的抗生素降低了Bacteroidetes( Bacteroides and Parabacteroides )比例,增加了Firmicutes ( Alistipes )的比例,高剂量的抗生素增加了Bacteroidetes( Parabacteroides) 的比例,降低了Firmicutes( Alistipes )的比例[27-28],这与本研究添加的高、中、低的JCLE的结果类似,表明JCLE具有与抗生素类似的作用效果。
本研究在肉鸡饲粮中添加JCLE可提高拟杆菌门(Bacteroidetes)、互养菌门(Synergistetes)相对丰度,并降低变形菌门(Proteobacteria)丰度,提高拟杆菌属( Bacteroides)和Odoribacter 的丰度,降低弯曲杆菌属( Campylobacter)、大肠埃希杆菌_志贺氏杆菌属(Escherichia_Shigella )的丰度,对于改善家禽肠道健康、维持家禽的可持续生产具有非常重要的意义,但JCLE-肠道微生物-宿主内在机制還有待于进一步研究。
JCLE中多酚含量高于黄酮,多酚为(544.31±17.11) mg/g,黄酮为(482.21±12.58) mg/g。
饲粮中添加JCLE可提高肉鸡盲肠拟杆菌门(Bacteroidetes)、互养菌门(Synergistetes)相对丰度,并降低变形菌门(Proteobacteria)丰度;提高肉鸡盲肠拟杆菌属( Bacteroides)和Odoribacter的丰度,降低弯曲杆菌属(Campylobacter)、大肠埃希杆菌_志贺氏杆菌属(Escherichia_Shigella) 的丰度。
参考文献:
[1]刘泽铭,苏光荣,杨 清. 云南省麻疯树资源调查分析[J]. 林业科技开发,2008,22(1):37-40.
[2]雷福红,李青青,刘莉莉,等. 麻疯树籽仁粕多酚提取工艺优化研究[J]. 西南林业大学学报,2019,39(1):178-183.
[3]李 星,唐 琳,雷 蕾,等. 麻疯树叶提取物对恶性黑色素瘤A375细胞增殖抑制及诱导凋亡作用的研究[J]. 时珍国医国药,2010,21(9):2291-2293.
[4]范树国,陈安林,邱 璐,等. 3种方法测定麻疯树中总黄酮的含量[J]. 江苏农业科学,2010,38(2):290-291,404.
[5]刘 娟,雷 蕾,唐 琳,等. 麻疯树提取物体外抗病毒和杀菌作用的初步研究[J]. 时珍国医国药,2009,20(8):1890-1893.
[6]曾礼华,严 钫,陈 放. 麻疯树叶提取物对鸡大肠杆菌、金黄色葡萄球菌的体外抑菌作用[J]. 中国家禽,2004,26(增刊1):35-37.
[7]杨 帆. 麻疯树叶多酚提取物抗氧化活性研究[D]. 硕士学位论文,昆明:西南林业大学,2016.
[8]Pesti G M. Nutrient requirements of poultry[J]. Animal Feed Science and Technology,1995,56(1):177-178.
[9]王靜霞,黄艳菲,赵小燕,等. 荞麦和商品苦荞茶中总黄酮的含量测定[J]. 食品工业科技,2013,34(2):58-60.
[10] Diaz Carrasco J M,Casanova N A,Fernández Miyakawa M E.Microbiota,gut health and chicken productivity:what is the connection?[J]. Microorganisms,2019,7(10):374.
[11]杨亚晋,郭爱伟,韩明升,等. 家禽肠道健康的生物标志物研究进展[J]. 动物营养学报,2020,32(5):1980-1988.
[12]Roberts T,Wilson J,Guthrie A,et al. New issues and science in broiler chicken intestinal health:intestinal microbial composition,shifts,and impacts[J]. World s Poultry Science Journal,2015,71(2):259-270.
[13]Clavijo V,Flórez M J V.The gastrointestinal microbiome and its association with the control of pathogens in broiler chicken production:a review[J]. Poultry Science,2018,97(3):1006-1021.
[14]Stanley D,Geier M S,Denman S E,et al. Identification of chicken intestinal microbiota correlated with the efficiency of energy extraction from feed[J]. Veterinary Microbiology,2013,164(1/2):85-92.
[15]Pandey K B,Rizvi S I.Plant polyphenols as dietary antioxidants in human health and disease[J]. Oxidative Medicine and Cellular Longevity,2009,2(5):270-278.
[16]郭爱伟,刘莉莉,杨亚晋,等. 植物多酚的生物活性及其在家禽生产中的应用[J]. 动物营养学报,2019,31(2):491-499.
[17]Jamar G,Estadella D,Pisani L P.Contribution of anthocyanin-rich foods in obesity control through gut microbiota interactions[J]. BioFactors,2017,43(4):507-516.
[18]Gowd V,Karim N,Shishir M R I,et al. Dietary polyphenols to combat the metabolic diseases via altering gut microbiota[J]. Trends in Food Science & Technology,2019,93:81-93.
[19]Ozdal T,Sela D A,Xiao J B,et al. The reciprocal interactions between polyphenols and gut microbiota and effects on bioaccessibility[J]. Nutrients,2016,8(2):78.
[20]Sun H Y,Chen Y H,Cheng M,et al. The modulatory effect of polyphenols from green tea,oolong tea and black tea on human intestinal microbiota in vitro [J]. Journal of Food Science and Technology,2018,55(1):399-407.
[21]Sánchez-Patán F,Cueva C,Monagas M,et al. In vitro fermentation of a red wine extract by human gut microbiota:changes in microbial groups and formation of phenolic metabolites[J]. Journal of Agricultural and Food Chemistry,2012,60(9):2136-2147.
[22]Hu J L,Nie S P,Wu Q M,et al. Polysaccharide from seeds of Plantago asiatica L. affects lipid metabolism and colon microbiota of mouse[J]. Journal of Agricultural and Food Chemistry,2014,62(1):229-234.
[23]李泽民. 苜蓿多糖对沙门氏菌感染肉鸡肠道微生物组的调控机制研究[D]. 泰安:山东农业大学,2020.
[24]Wang K,Liao M F,Zhou N,et al. Parabacteroides distasonis alleviates obesity and metabolic dysfunctions via production of succinate and secondary bile acids[J]. Cell Reports,2019,26(1):222-235.e5.
[25]張 雪,张 珊,钟 光,等. 枯草芽孢杆菌对肉鸡生长性能、肠道组织形态和盲肠微生物组成的影响[J]. 动物营养学报,2020,32(11):5195-5208.
[26]廖 娟,王 钢,喻世刚,等. 利用Illumina MiSeq测序平台分析沐川乌骨黑鸡空肠微生物多样性[J]. 江苏农业科学,2020,48(24):178-182.
[27]Claesson M J,Cusack S,O Sullivan O,et al. Composition,variability,and temporal stability of the intestinal microbiota of the elderly[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108 (Suppl 1):4586-4591.
[28]Voreades N,Kozil A,Weir T L.Diet and the development of the human intestinal microbiome[J]. Frontiers in Microbiology,2014,5:494.

