绣球叶斑病病原鉴定及其生物学特性
陈慧杰 邓衍明 齐香玉 陈双双 冯景 韩勇 王华娣 秦紫艺



摘要:绣球叶片对植物病原体的入侵非常敏感,极易发生病害,尤其是叶斑病,其发生会引起叶片呈现大小不一的病斑,严重时会导致叶片病死、脱落,甚至整株死亡,严重影响绣球的生长及开花质量。为明确引起绣球叶斑病的病原菌种类,在对绣球叶斑病田间发病症状进行观察的基础上,采用组织分离培养法从绣球Bailer的病叶上获得5种病原真菌分离物;通过致病力检测试验,从5种病原真菌分离物中筛选到强致病力菌株H-3-1;采用形态学观察结合rDNA-ITS基因序列系统发育分析法对病原菌H-3-1进行鉴定,表明其为棒孢属多主棒孢菌;进一步通过菌落生长法测定H-3-1的生物学特性,发现病原菌H-3-1菌丝生长的最适温度为28 ℃,最适pH值为8,最适碳源为乳糖,最适氮源为蛋白胨。结果为绣球棒孢叶斑病的病原学研究提供依据,也可为该病害的科学防治提供参考。
关键词:绣球;叶斑病;病原菌鉴定;生物学特性
中图分类号: S436.8+1 文献标志码: A
文章编号:1002-1302(2022)07-0106-06
收稿日期:2021-09-07
基金项目:国家自然科学基金(编号:31901359);江苏省苏州市科技计划(编号:SNG201923);江苏省林业科技创新与推广项目(编号:SYF2021C0029)。
作者简介:陈慧杰(1989—),女,河南周口人,博士,助理研究员,从事观赏植物栽培与植物病理学研究。E-mail:chenhuijie2020@163.com。
通信作者:邓衍明,博士,研究员,从事花卉遗传育种与栽培技术研究。E-mail:nksdym@163.com。
绣球品种繁多、株型优美、花期较长,极具应用价值和经济价值,不仅能用于园林绿化和家庭美化,还可作为盆花、鲜切花、插花、干花及药用植物,被誉为世界三大花园植物之一,在花卉产业中占有重要地位[1-2]。但关于绣球的研究主要集中于栽培技术、杂交育种和分子生物学特性等方面,较少涉及病害[3-5]。事实上,绣球叶片对植物病原体的侵染非常敏感,极易发生各种病害,尤其是叶斑病[6]。绣球叶斑病发生时,叶片呈现圆形或近圆形的叶斑,严重时会出现叶片病死、脱落,甚至整株死亡的现象,很大程度上影响绣球的生长及开花质量[1,7]。
叶斑病是一类世界范围内常见的植物真菌病害[8],主要由真菌门(Eumycota)半知菌亚门(Deuteromycotina)丝孢纲(Hyphomycetes)丝孢目(Hyphomycetales)暗色孢科(Dematiaceae)棒孢属( Corynespora )致病真菌引起[9]。叶斑病于1906年在欧洲种植的黄瓜上被首次发现并报道[10],1936年在非洲发现它能够引起橡胶落叶[11]。此后,該病害在包括我国在内的70多个国家中均有发生,给300多个属的500多种植物带来了危害[12-13]。虽然叶斑病在绣球属植物上发现的相对较晚,但在我国多地均有发生,尤其在长江中下游地区夏季高温高湿的环境下极易暴发,成为危害最严重的病害,极大地降低了绣球产品的观赏价值和经济价值[6,14]。
迄今为止,与黄瓜[15-17]等蔬菜植物相比,观赏植物上有关叶斑病病原鉴定及病原生物学特性的研究均较少,关于绣球叶斑病的研究更少且不够深入系统,多集中在病害调查及自然条件下绣球品种的叶斑病抗性比较等方面[1]。因此,本研究通过对江苏省南京地区绣球叶斑病的病原菌进行分离、鉴定,以及对病原菌rDNA的ITS区序列进行分析,从而明确了南京地区绣球叶斑病的病原菌为棒孢菌,并进一步研究了该病原菌菌丝生长的相关生物学特性,旨在为绣球棒孢叶斑病的病原学研究提供依据,也为该病害的科学防治提供参考。
1 材料与方法
1.1 绣球叶斑病症状观察与病样采集
2020年9月于江苏省农业科学院绣球种质资源圃中进行绣球叶斑病的症状观察、记录和拍照,重点观察病害部位、病斑大小、形状和颜色,并采集具有叶斑病典型特征的病叶样品,供下一步进行病原菌的分离使用。
1.2 病原菌分离、纯化与保存
用自来水冲洗采集的叶片,在超净工作台上剪取病健交界处的小块组织(约2 mm×2 mm),浸入70%乙醇中消毒10 s,再转入15%过氧化氢(H 2O 2)中消毒15 min,随后在无菌水中冲洗,并重复此消毒过程2次。将叶片置于灭过菌的滤纸上,吸干水分,接种于马铃薯葡萄糖琼脂(PDA)培养基上。将接种后的培养基置于25 ℃恒温培养箱中倒置培养 2~3 d,当培养基上植物材料周围出现小菌落时,在菌落边缘切取小圆饼(直径约5 mm),接种于新的PDA培养基上,进一步挑单孢培养直至纯化。纯化后,将菌株再次接种到新的PDA平板培养基上备用。保存时,沿菌落边缘切取直径约为5 mm的菌饼3个,置入装有30%甘油(500 μL)和马铃薯葡萄糖液体(PDB)培养基(500 μL)的2 mL离心管中[18]。
1.3 病原菌致病力检测
采集绣球Bailer( Hydrangea macrophylla ‘Bailer’,商品名为Endless Summer,中文译为无尽夏)相同叶位(从上往下数第3叶位)、大小相似、新鲜健康的叶片,置于自来水下流水冲洗30 min进行表面消毒。然后将叶片置入铺有2层湿润滤纸(无菌水润湿)的培养皿中,再在叶面的相同位置接种直径 5 mm 的菌饼,每个菌株5次重复。取相同大小的PDA培养基圆饼置于健康叶片相同部位作为对照。将接种后的培养皿放入25 ℃培养箱中先进行暗培养,48 h后置于温度周期为25 ℃/18 ℃、光周期为16 h/8 h的条件下培养。在接种后0、5、10、15 d分别观察并记录叶片的发病情况,根据叶片的发病程度和病斑直径筛选出致病力最强的菌株[18]。
1.4 病原菌形态观察与分子鉴定
观察强致病力菌株在PDA培养基上的菌落形态,并在显微镜下观察孢子形态和子实体的有无、大小等。将筛选出的强致病力菌株接种于PDA培养基上,于25 ℃恒温培养箱培养7 d;在无菌操作台上用灭过菌的牙签刮取少量表面菌丝,采用真菌DNA提取试剂盒(广州欧米伽生物科技公司)提取其基因组DNA。将提取后的DNA用引物ITS1F/ITS4进行PCR扩增,产物通过2%琼脂糖凝胶电泳检测,切胶、纯化后进行测序。采用NCBI-Blast进行序列比对,并用Mega 5.05软件构建Neighbor Joining系统进化树[19]。
1.5 病原菌生物学特性研究
1.5.1 碳源对病原菌菌丝生长的影响
以Czapek培养基为基础,将其中的蔗糖分别等量替换成葡萄糖、果糖、淀粉和乳糖等不同碳源;取直径约5 mm的菌饼置于不同碳源的培养基上,25 ℃恒温培养 7 d 后,用十字交叉法[20]测定菌落直径,每个处理重复3次。
1.5.2 氮源对病原菌菌丝生长的影响
以Czapek培养基为基础,将其中的硝酸钠分别等量替换成蛋白胨、酵母浸粉、磷酸氢二胺和甘氨酸等不同氮源;取直径约为5 mm的菌饼置于不同氮源的培养基上,25 ℃恒温培养7 d后,用十字交叉法测定菌落直径,每个处理重复3次。
1.5.3 温度对病原菌菌丝生长的影响
取直径约为5 mm的菌饼置于PDA培养基上,分别置于25、28、37、42 ℃条件下恒温培养,7 d后用十字交叉法测定菌落直径,每个处理重复3次。
1.5.4 pH值对病原菌菌丝生长的影响
用 0.1 mol/L 盐酸溶液和0.1 mol/L氢氧化钠溶液调节pH值分别为5、6、7、8、9、10的PDA培养基,取直径约5 mm的菌饼置于各培养基上,25 ℃恒温培养,7 d后用十字交叉法测定菌落直径,每个处理重复3次。
1.6 数据统计与分析
采用Excel 2007对试验所得数据进行统计与整理,并采用SPSS 20.0软件进行单因素方差分析和差异显著分析(SSR法, P <0.05)。
2 结果与分析
2.1 绣球叶斑病症状
绣球叶斑病主要危害绣球的叶片,在绣球的全生育期均可发病,且老叶发病更为严重。发病叶片初始时呈褪绿色小点;中期时逐渐形成直径一般为 2~3 mm 的圆形或近圆形病斑,病斑边缘呈灰紫色;发病后期,病斑连成一片,叶片变黄、脱落,甚至整株枯死(图1)。
2.2 绣球叶斑病主要病原菌
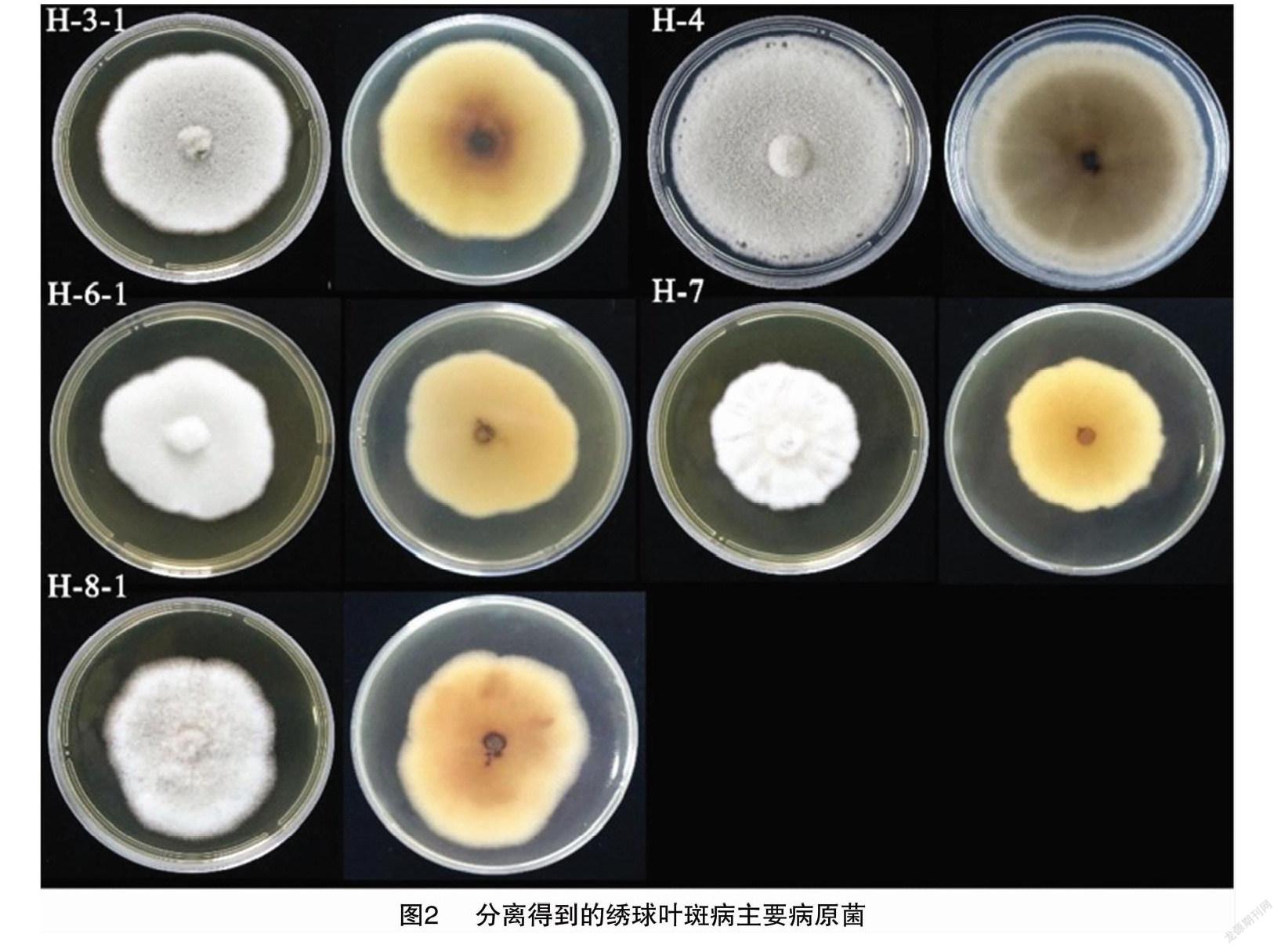
将绣球Bailer叶斑病发病叶片组织中分离到的菌株进行科赫法则验证,得到5种绣球叶斑病的病原菌:H-3-1、H-4、H-6-1、H-7、H-8-1。将这些菌株接种到PDA平板培养基上,由图2可知,各菌落突起絮状,由大量孢子生成而呈粉质。其中,H-3-1和H-4菌落正面颜色呈灰色,H-6-1、H-7、H-8-1菌落正面颜色呈白色。
2.3 强致病力菌株的筛选
由图3可知,分别用菌株H-3-1、H-4、H-6-1、H-7、H-8-1侵染绣球Bailer健康离体叶片10 d时,病斑直径开始呈现明显差异;侵染 15 d 时,菌株H-3-1侵染离体叶片的病斑平均直径最大,为4.60 cm,而其他4个菌株的叶片病斑平均直径分别只有2.75、3.07、1.23、1.38 cm,故H-3-1 的致病力最强。
2.4 强致病力菌株H-3-1的形态特征
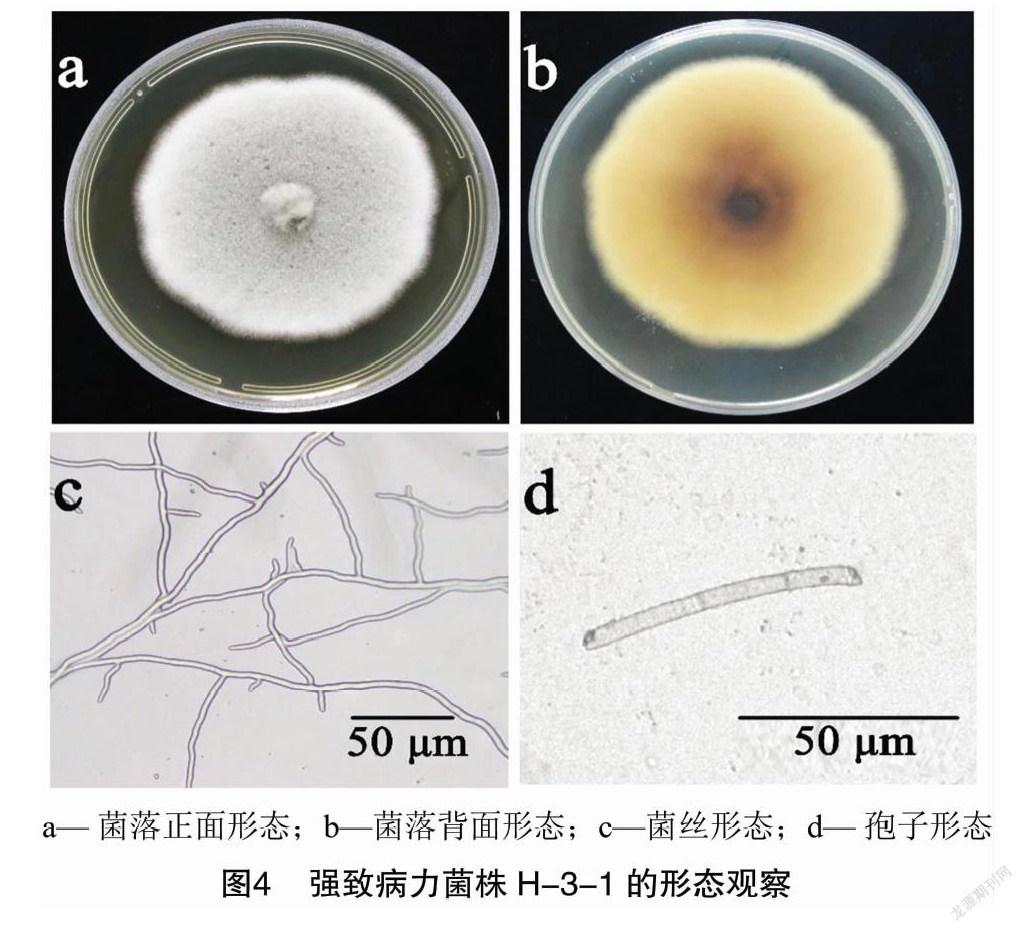
绣球叶斑病强致病力菌株H-3-1的菌落在PDA平板培养基正面呈灰褐色,突起絮状,由大量孢子生成而呈粉质(图4-a);菌落背面呈浅黄至黄褐色(图1-b)。在显微镜下观察,可见菌丝致密、有分枝(图4-c);分生孢子形态呈圆柱形或倒棍棒形,半透明至浅褐色,具有假隔膜(图4-d)。故从形态学特征的角度,绣球叶斑病强致病力菌株H-3-1 符合棒孢属( Corynespora spp.)菌株特征。
菌株H-3-1的ITS基因测序结果与NCBI核酸序列比对后结果表明,该菌株与多主棒孢菌( Corynespora cassiicola )(KF928286.1)菌株的相似性为100%,且在系统发育树上聚为一支(图5)。结合菌株形态特征,确定该菌株为多主棒孢菌( C. cassiicola ),命名为H-3-1。
2.5 强致病力菌株H-3-1的生物学特性
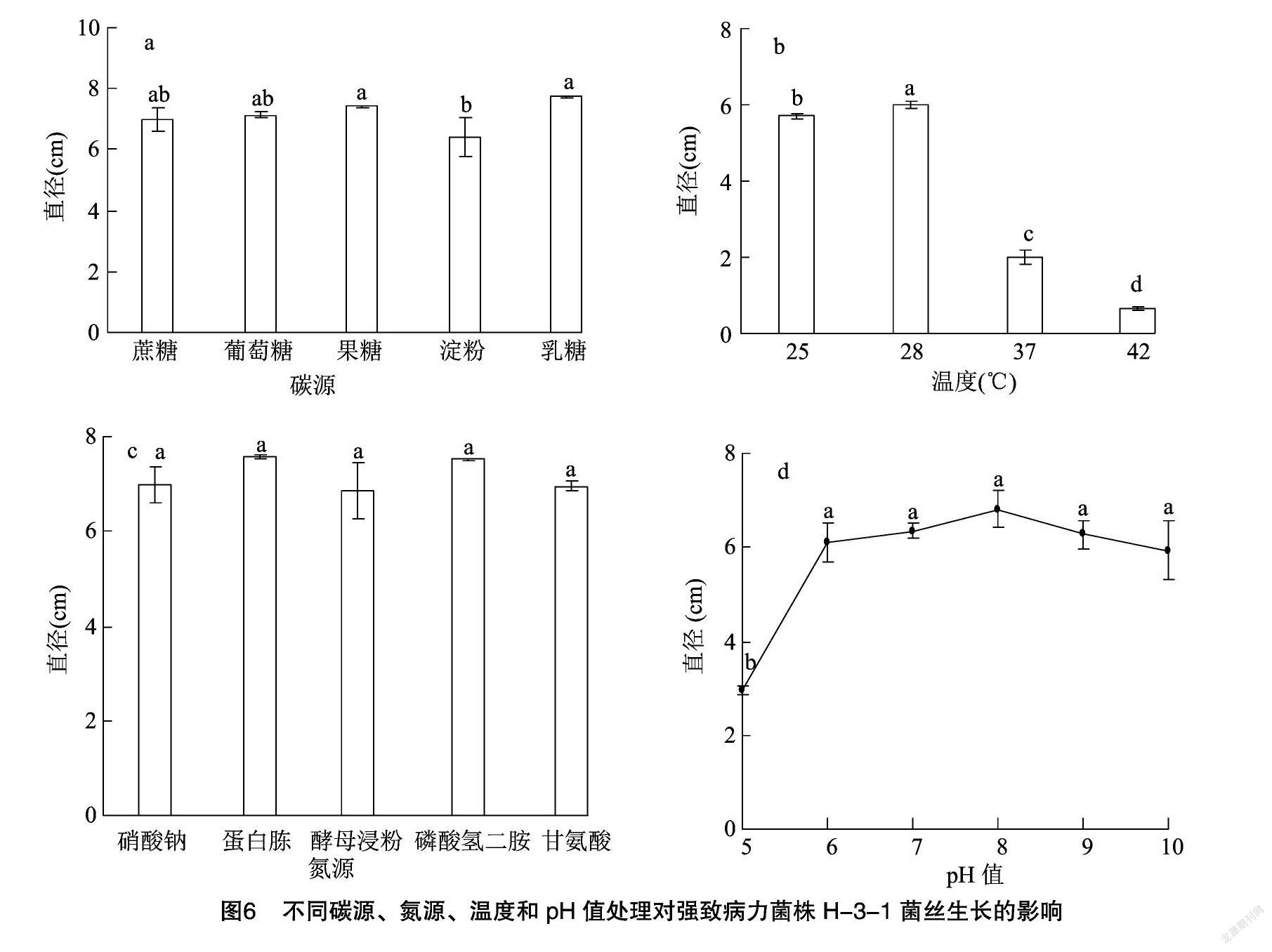
绣球叶斑病强致病力菌株H-3-1在不同碳源、氮源、温度和pH值条件下的菌丝生长情况如图6所示。H-3-1在不同碳源条件下的菌丝生长速度依次表现为乳糖 > 果糖 > 葡萄糖 > 蔗糖> 淀粉,但在前4种碳源中菌丝的生长速度无显著差异,只有淀粉中菌丝生长速度显著低于果糖和乳糖处理处理;H-3-1在不同氮源条件下的生长速度表现为蛋白胨>磷酸氢二铵>硝酸钠>甘氨酸>酵母浸粉,但5种处理间差异并不显著;H-3-1在不同温度条件下的生长速度依次表现为28 ℃>25 ℃>37 ℃>42 ℃,其中28 ℃培养下的生长速度显著快于其他温度,故28 ℃是最适生长温度;H-3-1的最快生长pH值为8,在该pH值下的生长速度显著快于pH值为5的生长条件,但与其他处理间无显著差异。
3 结论与讨论
关于植物病原真菌的鉴定,传统形态学方法常通过菌株和孢子形态特征的观察进行[21]。由于寄主、培养条件等因素的变化,病原真菌的形态特征也会发生一定程度的改变,这给传統形态学鉴定方法带来了一定困难[22]。然而,病原真菌rDNA的ITS区段序列既具保守性,又在科、属、种水平上具有特异性[23]。因此,随着生物技术的不断发展,通过rDNA-ITS序列分析技术进行植物病原真菌的诊断、检测及系统进化分析,使得病原真菌的分类与鉴定更加准确[24]。如崔晓霞等在对甜叶菊叶斑病病原菌分离、鉴定的研究中,采用了形态学观察和系统进化分析相结合的方法,确定了甜叶菊叶斑病的致病菌株为炭疽菌( Colletotrichum spp.)和链格孢菌( Alternaria spp.)[25];钟文文等通过形态学特征观察和rDNA-ITS基因序列系统发育分析,结合科赫法则和叶部解剖特征观察,明确剑兰叶斑病的病原真菌为葡萄壳小圆孢菌( Coniothyrium vitivorum Miura)[26]。本研究在形态观察的基础上,结合rDNA-ITS序列分析及致病力检测,从绣球‘Bailer’的发病叶片中成功分离并鉴定了绣球叶斑病强致病力菌株多主棒孢菌H-3-1。
关于叶斑病主要病原菌的研究表明,多主棒孢菌、 Cercosospora spp.、 Myrothecium roridum、Glomerella cingulata、Phoma exigua、Botrytis cinerea 均能引起叶斑病的发生,其中,多主棒孢菌占叶斑病分离菌株的一半以上,是叶斑病最主要的病原菌之一[27]。本研究中,通过致病力检测、形态学观察和分子鉴定,表明分离出的绣球叶斑病强致病力菌株H-3-1为多主棒孢菌。这是首次分离鉴定出绣球叶斑病强致病力病原菌株并明确其分类学地位。已有研究表明,病原菌多主棒孢菌入侵叶片不需要伤口,可通过叶片气孔自然侵入,还可通过空气或雨水传播,且寄主范围广,对不良环境的抵抗力强,能够以菌丝、厚垣孢子、分生孢子等形态在土壤、种子、保护地的越冬植物上过冬[12,28]。因此,應根据病原物的这些特点,有针对性地采取绣球叶斑病科学的防治措施。
本研究发现,绣球叶斑病强致病力菌株H-3-1菌丝生长的最适温度是28 ℃,最适pH值为8,这些研究结果与张笛等在甜瓜、黄瓜上分离出的棒孢叶斑病菌的研究结果[20,29]一致。此外,本研究还发现以乳糖为碳源、蛋白胨为氮源的培养基更有利于病原菌H-3-1菌丝的生长,这一点与已有报道不同。王爽等在甜瓜棒孢叶斑病菌的研究中发现,菌丝生长的最适碳源为乳糖,最适氮源为硝酸钠[29];张笛等在黄瓜棒孢叶斑病菌的研究中发现,菌丝生长的最适碳源为甘露醇,最适氮源为甘氨酸[20]。这部分研究结果与已有报道的差异可能与病原菌对不同地理环境和不同来源寄主的适应性不同有关[30]。通过对病原菌生物学特性及该病害的流行、蔓延时间可以推测出,该病菌具有喜温好湿的特点。因此,本研究中分离与鉴定出的绣球棒孢叶斑病病菌强致病力菌株H-3-1及其生物学特性的研究,不仅为该病的诊断与防治提供了科学的理论依据,也为今后开展绣球棒孢叶斑病病菌致病物质和致病机制研究提供了重要的参考。
参考文献:
[1]邓衍明,韩 勇,齐香玉,等. 绣球属植物种质资源分析及其花色可调性和叶斑病抗性比较[J]. 植物资源与环境学报,2018,27(4):90-100.
[2]孙晓波,苏家乐,陈双双,等. 大花绣球‘无尽夏’组培苗叶片再生植株的研究[J]. 中国农学通报,2020,36(16):67-72.
[3]贾新平,孙晓波,梁丽建,等. 绣球SSR-PCR反应体系的建立与优化[J]. 华北农学报,2016,31(4):68-73.
[4]陈双双,齐香玉,冯 景,等. 基于流式细胞术和基因组Survey的绣球基因组大小及特征分析[J]. 江苏农业科学,2021,49(12):39-44.
[5]陈双双,齐香玉,冯 景,等. 铝处理下绣球实时荧光定量PCR内参基因筛选及验证[J]. 华北农学报,2021,36(2):9-18.
[6]Zhu J Z,Chen J,Wang Y,et al. Leaf spot of Hydrangea macrophylla caused by Corynespora cassiicola in China[J]. Canadian Journal of Plant Pathology,2020,42(1):125-132.
[7]Mmbaga M T,Kim M S,Mackasmiel L,et al. Differentiation of Corynespora cassiicola and Cercospora sp. in leaf-spot diseases of Hydrangea macrophylla using a PCR-mediated method[J]. Canadian Journal of Plant Science,2015,95(4):711-717.
[8]李明远. 试谈棒孢叶斑病[J]. 蔬菜,2020(6):81-83.
[9]李宝聚,高 苇,石延霞,等. 多主棒孢和棒孢叶斑病的研究进展[J]. 植物保护学报,2012,39(2):171-176.
[10]Güssow H. Uber eine neue krankheit an gurken in England[J]. Ztschsb Pflanzenkrankheiten,1906,16(1):10-13.
[11]Deighton F C. Preliminary list of fungi and diseases of plants in sierra leone[J]. Bulletin of Miscellaneous Information,1936,1936(7):397.
[12]李 晗,冉 茂,陈海涛,等. 植物棒孢霉叶斑病的发生及防治研究进展[J]. 植物医生,2020,33(1):15-20.
[13]MacKenzie K J,Sumabat L G,Xavier K V,et al. A review of Corynespora cassiicola and its increasing relevance to tomato in Florida[J]. Plant Health Progress,2018,19(4):303-309.
[14]Li Y H,Mmbaga M T,Zhou B R,et al. Diseases of Hydrangea [M]//Handbook of Plant Disease Management.Cham:Springer International Publishing,2016:1-19.
[15]王翔宇. 黄瓜响应棒孢叶斑病菌侵染的转录组和microRNAs解析[D]. 沈阳:沈阳农业大学,2018:1-18.
[16]张自心,谢学文,傅俊范,等. 黄瓜棒孢叶斑病病原学和抗性基因研究进展[J]. 生物技术进展,2016,6(3):169-173.
[17]于广招. CsMLO1和CsMLO2在黄瓜抗棒孢叶斑病中的功能分析[D]. 沈阳:沈阳农业大学,2019:1-19.
[18]柳丽娜,刘 晔,李媛媛,等. 38个茶用菊品种苗期对黑斑病的抗性鉴定[J]. 南京农业大学学报,2021,44(1):68-77.
[19]陈慧杰,赵 爽,张凯凯,等. 菊花枯萎病病原菌的分离和鉴定及其粗毒素对切花菊‘神马’幼苗生长的影响[J]. 南京农业大学学报,2018,41(4):662-669.
[20]张 笛,刘齐月,刘 东,等. 黑龙江省黄瓜棒孢叶斑病分布及病菌生物学特性[J]. 北方园艺,2020(21):7-14.
[21]楊 俊,芦文博,费利旺.一种基于病原真菌孢子形态快速鉴定植物真菌病害的方法:CN111235210A[P]. 2020-06-05.
[22]李俊香,洪 霓,洪日新,等. 甜瓜靶斑病病原菌鉴定[J]. 中国瓜菜,2019,32(3):8-12.
[23]赵 杰. ITS序列分析及其在植物真菌病害分子检测中的应用[J]. 陕西农业科学,2004,50(4):35-37.
[24]王惠哲,邓 强,曹明明,等. 黄瓜棒孢叶斑病菌的分子鉴定及rDNA-ITS序列分析[J]. 华北农学报,2015,30(3):175-179.
[25]崔晓霞,束红梅,倪万潮,等. 甜叶菊叶斑病病原真菌的分离及分子生物学鉴定[J]. 江苏农业科学,2020,48(14):117-124.
[26]钟文文,葛朝晖,许俊杰. 剑兰叶斑病病原菌的分离与鉴定[J]. 江苏农业科学,2020,48(14):131-138.
[27]Mmbaga M T,Kim M S,Mackasmiel L,et al. Evaluation of Hydrangea macrophylla for resistance to leaf-spot diseases[J]. Journal of Phytopathology,2012,160(2):88-97.
[28]杨双娟,顾兴芳,张圣平,等. 黄瓜棒孢叶斑病( Corynespora cassiicola) 的研究概况[J]. 中国蔬菜,2012(4):1-9.
[29]王 爽,黄贵修,李博勋,等. 甜瓜棒孢叶斑病病原菌鉴定及其生物学特性研究[J]. 热带作物学报,2013,34(12):2446-2452.
[30]孙会杰,高德学,程洪森,等. 芝麻棒孢根腐病原菌生物学特性研究[J]. 沈阳农业大学学报,2020,51(4):506-511.

