核心蛋白聚糖在胰腺癌beta细胞功能中的作用及对线粒体分离融合的影响*
张 荣,吕海龙,杨一邨,王浩斌,黄江涛,张 抒
(四川省成都市第三人民医院普外科 610031)
胰腺癌是消化道常见恶性肿瘤之一。其预后差,生存率低[1]。随着我国人口老龄化和糖尿病发病率的升高,胰腺癌将成为危害我国国民健康的重大疾病之一[2]。然而,目前关于胰腺癌依旧缺乏行之有效的诊断和治疗手段[1-2]。胰腺癌常分为胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)和胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors,PNET)。最新证据显示,占据胰腺癌95%的PDAC与代谢紊乱导致的骨骼肌、脂肪和肿瘤细胞消耗增加密切相关[3-4]。但目前对胰腺癌的代谢和分子机制尚未阐明。
核心蛋白聚糖(decorin,DCN)是富含亮氨酸的小蛋白聚糖家族的重要成员[5]。研究报道,DCN具有调控癌细胞和内皮细胞增殖、凋亡,巨噬细胞极化和小鼠糖耐受等作用[6-7]。DCN通过过氧化物酶体增殖物激活的受体γ共激活分子-1α(peroxisome proliferator-activated receptor gamma coactivator-1α,PGC1-α)调控米托他汀诱导乳腺癌细胞的线粒体自稳[8]。DCN可诱导血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)依赖性的线粒体片段化和线粒体膜电位的丧失[5]。DCN介导的抑癌作用作为上皮癌潜在的未来辅助疗法具有重要价值[9]。线粒体的分离融合是细胞生长及其功能的代谢基础。然而,DCN与线粒体的分离融合在胰腺癌发生发展中的作用尚未见报道。本研究通过研究胰腺癌组织中DCN的表达和其对胰岛β细胞线粒体的分离融合的影响与分子机制,以揭示DCN和胰腺癌胰β细胞岛线粒体的分离融合失衡间的关系。
1 资料与方法
1.1 一般资料
征集2018年6月至 2021 年2月本院诊断为PDAC患者21例(PDAC组),PNET患者25例(PNET组)及健康志愿者4例(健康组)。收集患者肿瘤组织及健康志愿者胰腺组织。(1)PCAC及PENET患者诊断和纳入标准:手术前未经放化疗等任何形式的治疗;经影像学诊断且肿瘤标志物CA19-9阳性。(2)排除标准:合并其他恶性肿瘤及存在严重器质性疾病者;伴精神疾病者或认知障碍者。PDAC组患者年龄(49.65±5.85)岁;PNET组患者年龄(52.96±8.85)岁。健康组人群的年龄(40.21±4.33)岁。本文研究经本院伦理委员会审核批准,所有患者、志愿者均对本研究知情并签署知情同意书。
1.2 免疫组织化学检测
组织置于4%多聚甲醛溶液固定,常规脱水、包埋并切片、脱蜡和水化。采用柠檬酸缓冲液高温修复30 min。加入兔抗人DCN多克隆抗体(1∶200,武汉三鹰生物技术有限公司),4 ℃过夜,PBS漂洗3次,每次5 min。加入辣根过氧化物酶标记的二抗(1∶500,武汉Abclonal公司),室温孵育 1 h,PBS漂洗3次,每次5 min。DAB显色液(北京中杉金桥生物技术有限公司)显色1 min,自来水冲洗5 min。ddH2O漂洗5 min。常规复染,脱水,透明和封片。采用Image-Pro Plus 6.0分析其染色情况。
1.3 免疫荧光检测
组织置于4%多聚甲醛溶液固定,常规脱水、包埋并切片、脱蜡和水化。采用柠檬酸缓冲液高温修复30 min。加入兔抗人MFN2多克隆抗体和小鼠抗人DRP1多克隆抗体(1∶200,武汉三鹰生物技术有限公司),4 ℃过夜,PBS漂洗3次,每次5 min。加入FITC和CoraLite594标记的二抗(1∶500,武汉三鹰生物技术有限公司),室温孵育1 h。PBS漂洗3次,每次5 min。DAPI染色30 s,PBS漂洗3次,每次5 min。抗荧光淬灭剂(武汉塞维尔生物科技有限公司)封片,荧光显微镜拍照,采用Image-Pro Plus 6.0分析其染色面积。
1.4 小鼠胰岛β细胞培养及分组
小鼠胰岛β细胞NIT-1在含10% 胎牛血清的RPMI-1640培养基中培养。胰酶消化重悬,悬液500×g 4 ℃离心10 min后计数并接种至细胞培养板中,置于37 ℃ 5% CO2孵箱培养24 h后,更换2% 胎牛血清培养基培养6 h同步化,更换完全培养基,依次加入0、1、10、100和200 nmol/L DCN处理0、12、24和48 h。或更换为含0 nmol/L或100 nmol/L的DCN(D8428,美国Sigma-Aldrich)的正常葡萄糖培养基或高糖(HG)培养基(武汉塞维尔生物科技有限公司)培养24 h,分为正常糖条件下的0 nmol/L DCN组、10 nmol/L DCN组和高糖条件下的0 nmol/L DCN组、10 nmol/L DCN组。
1.5 CCK-8实验
细胞增殖实验采用CCK-8比色法检测,参照CCK-8试剂盒说明书,细胞经消化计数后,以2×103/孔的细胞数接种细胞至96孔培养板中,每孔加入10 μL的CCK-8溶液,混匀后培养2 h后于450 nmol/L处检测各孔光密度(OD)值,绘制细胞增殖曲线图。
1.6 流式细胞实验
对数生长期的细胞经消化计数后,以5×104/孔的数接种细胞至12孔培养板中,37 ℃ 5% CO2培养24 h后,更换为HG培养基(武汉塞维尔生物科技有限公司)和(或)100 nmol/L的PCN培养24 h。每孔细胞以乙二胺四乙酸(EDTA)消化液消化收集细胞,冷PBS洗涤3次,细胞沉淀加入1% BSA 400 μL重悬后,加入2.5 μL Annexin V-FITC抗体(上海碧云天生物科技有限公司),室温孵育30 min,PBS洗涤1次,400 μL PBS重悬后加入2.5 μL 碘化丙啶(PI)染料(武汉塞维尔生物科技有限公司),并使用LSR-Ⅱ流式细胞仪(美国BD Biosciences公司)进行检测。使用FlowJo软件对结果进行分析。
1.7 胰岛素检测实验
取细胞培养上清液100 μL,按胰岛素ELISA检测试剂盒(上海碧云天生物)使用说明书操作,使用BioTek 5.0酶标仪在450 nm波长处测定各孔的OD值。
1.8 Western blot检测
取组织加入1 mL含蛋白酶抑制剂和磷酸化酶抑制剂的RIPA裂解液(武汉塞维尔生物科技有限公司),组织置于玻璃组织匀浆器中,于冰上充分碾碎组织,冰上孵育10 min。收集至1.5 mL Ep管中,超声10 s,2个循环。14 000×g 4 ℃离心 20 min后收集上清。细胞加入0.5 mL含蛋白酶抑制剂和磷酸化酶抑制剂的RIPA裂解液,冰上孵育10 min,收集至1.5 mL Ep管中,超声 10 s,2个循环。14 000×g 4 ℃离心 20 min后收集上清液。上清液采用BCA法检测蛋白浓度并95 ℃干热变性10 min。组织以60 μg总蛋白,细胞以30 μg总蛋白上样量行10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,200 mA恒流湿转2 h至聚偏氟乙烯膜(PVDF)上,5% BSA的TBST溶液室温封闭1 h,加入一抗DCN、线粒体分裂因子(MFF)、线粒体融合蛋白1(MFN1)、MFN-2、视神经萎缩症蛋白1(OPA1)、动力相关蛋白1(DRP1)、线粒体分裂蛋白1(FIS1)、烟酰胺腺嘌呤二核苷酸磷酸氧化酶(P22phox)、丝裂原活化蛋白激酶p38亚基(p38)、胰岛素样生长因子Ⅰ受体蛋白(IGFIR)、蛋白激酶B(AKT)和β-actin(1∶500、1∶500、1∶1 000、1∶1 000、1∶1 000、1∶1 000、1∶1 000、1∶1 000、1∶1 000、1∶1 000、1∶1 000、1∶1 000,武汉三鹰生物技术有限公司)及磷酸化AKT(p-AKT)和p-p38(1∶500,1∶500,武汉Abclonal公司)于4 ℃摇床孵育12 h,第2天TBST室温漂洗3次,每次5 min。室温孵育二抗(1∶5 000,武汉三鹰生物技术有限公司)2 h,TBST室温漂洗3次,每次5 min。ECL(武汉塞维尔生物科技有限公司)发光显影。蛋白表达ImageJ软件分析灰度值,以β-actin为内参。
1.9 统计学处理
2 结 果
2.1 胰腺癌患者组织中DCN的表达比较
免疫组织化学染色结果显示,与健康组[(47.34±8.21)%]比较,PDAC组 [(36.81±11.15)%] 和PNET组 [(8.02±1.19 )%] 患者癌组织中DCN表达水平明显降低,差异有统计学意义(P=0.008,P=0.003),见图1A、B。Western blot结果显示,PDAC组(3.23±0.75)和PNET组(1.20±0.37)患者癌组织中DCN表达水平和明显低于与健康组(5.22±1.21),差异有统计学意义(P=0.009,P=0.002),见图1C、D。
2.2 胰腺癌患者组织中线粒体功能比较
免疫荧光结果显示PDAC组和PNET组患者胰腺癌组织胰岛中MFN2表达水平分别为(22.64±8.34)%和(75.89±9.37)%,明显高于健康组胰腺组织(9.73±0.51)%(P=0.042,P=0.010);DRP1表达水平分别为(38.31±5.97)%和(19.93±7.21)%,明显低于健康组(50.23±11.90)%(P=0.039,P=0.022),见图2A、B。Western blot结果显示,线粒体融合相关蛋白MFN1、MFN2和OPA在PNET组胰腺癌组织(1.15±0.5,1.68±0.2和1.01±0.10)和PDAC组胰腺癌组织(1.19±0.40,0.79±0.30、0.65±0.20)中的表达水平明显高于健康组胰腺组织(0.56±0.20,0.58±0.10、0.25±0.05),其中PNET组vs.健康组P=0.045、0.047、0.041;PDAC组vs.健康组P=0.042、0.049、0.024;线粒体分裂相关蛋白DRP1、FIS1和MFF在PNET组胰腺癌组织(0.82±0.12,0.68±0.15、0.95±0.13)和PDAC组胰腺癌组织(0.79±0.34,0.67±0.22、1.85±0.49)中的表达水平明显低于健康组胰腺组织(1.52±0.18、1.98±0.20和2.64±0.40),其中PNET组vs.健康组P=0.035、0.021、0.044;PDAC组vs. 健康组P=0.039、0.025、0.047。见图2C、D。
2.3 DCN对胰岛β细胞增殖的影响
在正常糖条件下,相较于24和48 h的0 nmol/L DCN组(增殖倍数均为1),100 nmol/L DCN组(3.75±0.18,3.96±0.16)和200 nmol/L DCN组(2.21±0.18,2.36±0.16)的细胞增殖倍数明显增加(24 h:P=0.035、0.016;48 h:P=0.045、0.033),见图3A。在正常糖条件下,100 nmol/L DCN组的(5.22±0.42)细胞增殖倍数明显高于0 nmol/L DCN组(3.96±0.42),P=0.012。在HG条件下,100 nmol/L DCN组的(2.16±0.16)细胞增殖倍数明显高于0 nmol/L DCN组(1.36±0.16),P=0.009,见图3B。
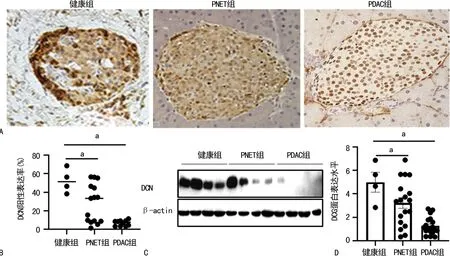
A:DCN表达免疫组织化学代表图(200×);B:免疫组织化学统计分析图;C:DCN Western blot图;D:Western blot统计分析图;a:P<0.01。
2.4 DCN对胰岛β细胞凋亡的影响
在正常糖条件下,100 nmol/L DCN组[(1.54±0.16)%]的AnnexinV+PI-细胞比例与0 nmol/L DCN组[(1.25±0.15)%]比较无明显变化(P=0.165)。在HG条件下,100 nmol/L DCN组(1.65±0.16)%的AnnexinV+PI-细胞比例与0 nmol/L DCN组[(2.68±0.56)%]比较,差异无统计学意义(P=0.472),见图4A、B。
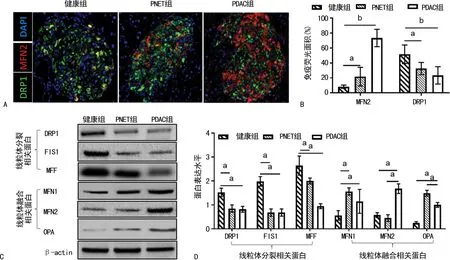
A:MFN2和DRP1免疫荧光染色图(100×);B:免疫荧光分析统计图;C:Western blot代表图;D:Western blot统计分析图;a:P<0.05;b:P<0.01。
2.5 DCN对胰岛β细胞胰岛素分泌和线粒体分裂、融合的影响
在正常糖和HG条件下,100 nmol/L DCN组细胞培养上清液中的胰岛素分泌量分别为(4.65±0.25)μg/mL和(1.75±0.18) μg/mL,分别高于正常糖条件下[(3.75±0.25) μg/mL]和HG条件下[(1.21±0.18) μg/mL]0 nmol/L DCN组,差异有统计学意义(P=0.042,P=0.049),见图5A。在正常糖条件下,相较于0 nmol/L DCN组(0.85±0.15、0.68±0.15、1.32±0.12),100 nmol/L DCN组(2.58±0.16、1.71±0.16、2.50±0.25)的线粒体分裂相关蛋白DRP1、FIS1和MFF表达水平明显增加(P=0.012、0.034、0.013)。在正常糖条件下,相较于0 nmol/L DCN组(1.15±0.15、1.68±0.14、1.16±0.12),100 nmol/L DCN组(0.56±0.20、0.58±0.10、0.25±0.05)的线粒体融合相关蛋白MFN1、MFN2和OPA表达水平明显减少(P=0.042、P=0.015、P=0.024)。在HG条件下,相较于0 nmol/L DCN组(1.45±0.43),100 nmol/L DCN组(1.12±0.18)的线粒体分裂相关蛋白DRP1表达水平明显减少(P=0.048);在HG条件下,相较于0 nmol/L DCN组(2.45±0.20、1.19±0.10),100 nmol/L DCN组(0.62±0.26、0.82±0.16)的线粒体融合相关蛋白MFN2和OPA表达明显减少,差异有统计学意义(P=0.014和P=0.041),见图5B、C。
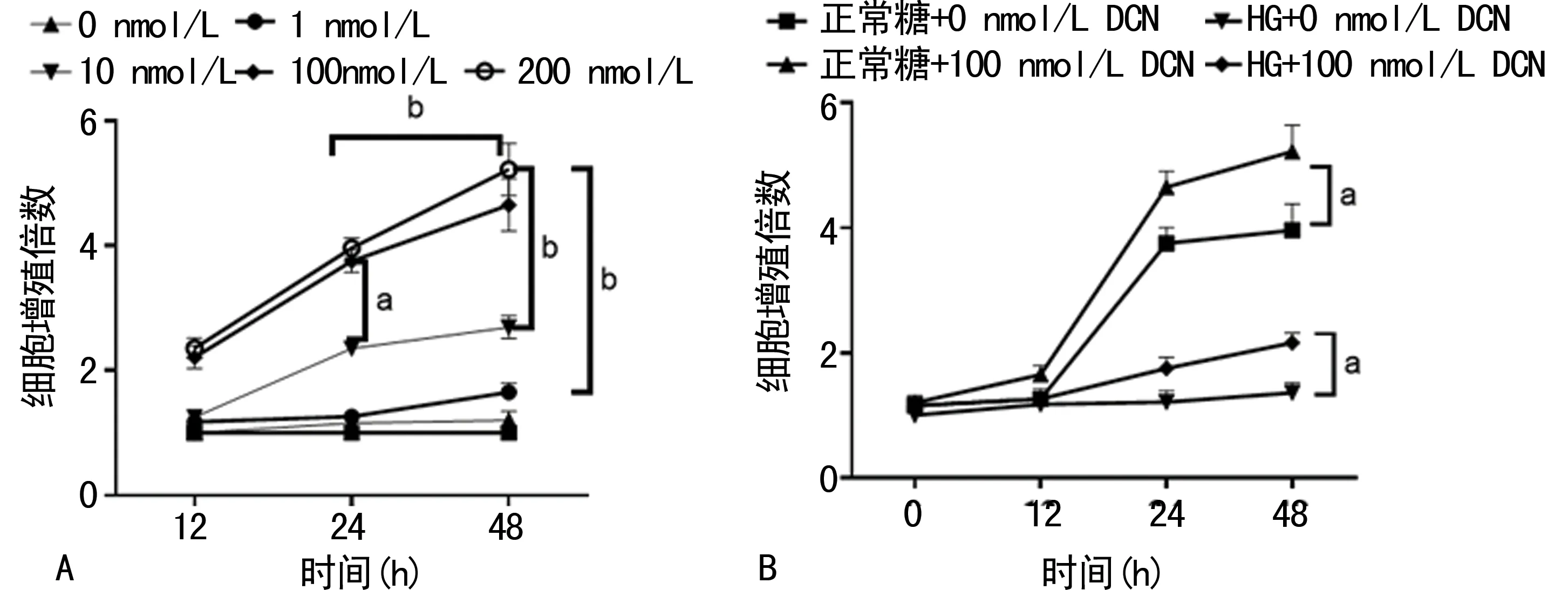
A:细胞增殖倍数统计图;B:正常糖和HG条件下细胞增殖倍数统计图;a:P<0.05;b:P<0.01。
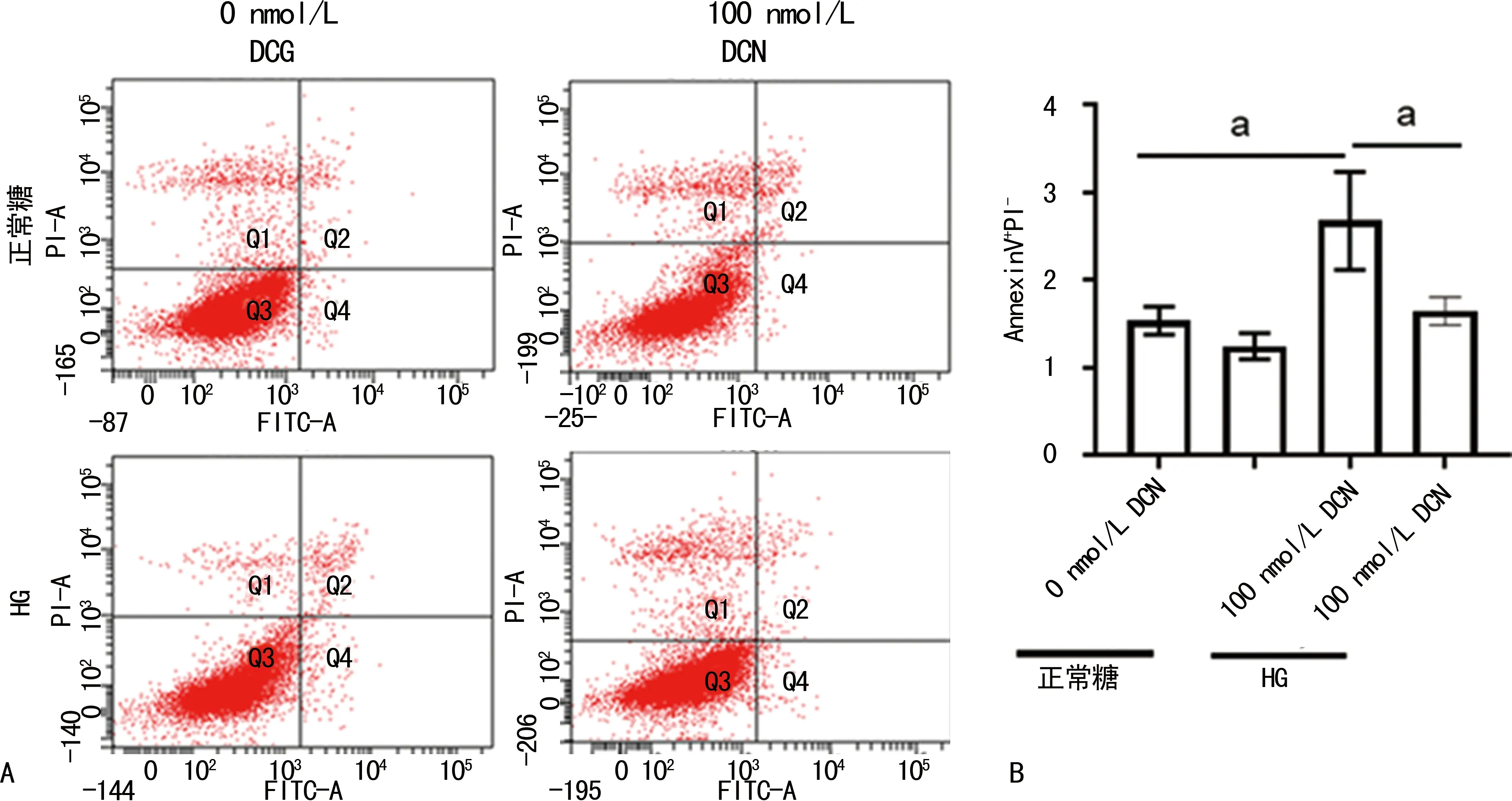
A:流式细胞图; B:流式细胞统计图;a:P<0.05。
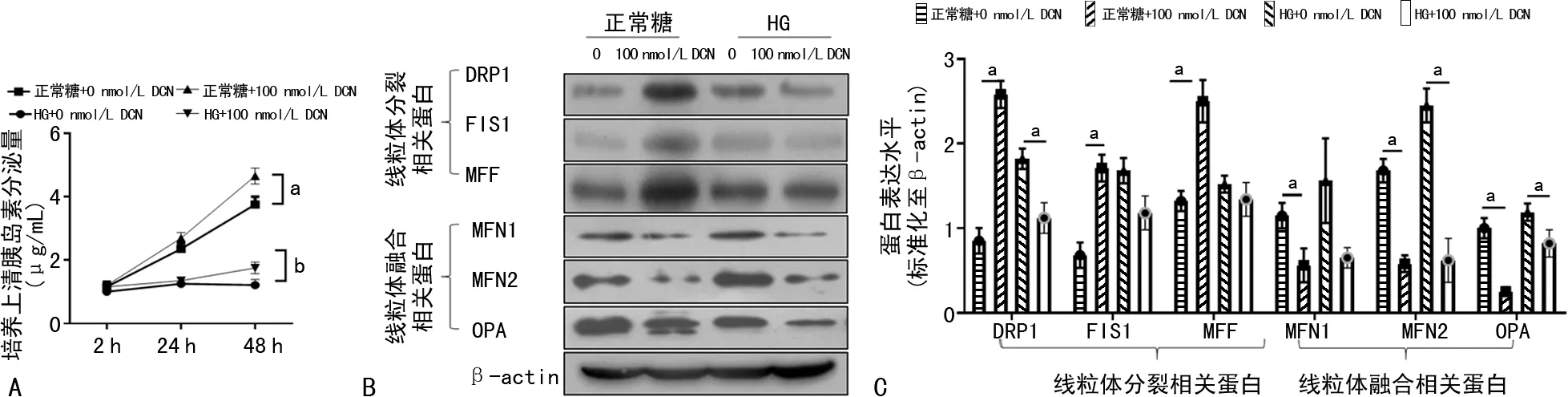
A、C:Western blot图;B、D:Western blot统计分析图;a:P<0.05;b:P<0.01。
2.6 DCN对P22phox/MAPK通路和IGFIR/AKT通路的影响
在正常糖和HG条件下,相较于0 nmol/L DCN组,100 nmol/L DCN 组的P22phox[正常糖条件:1.52±0.18vs.2.58±0.16,P=0.031;HG条件:0.22±0.12vs.0.55±0.05,P=0.024)和p-p38(正常糖条件:1.08±0.20vs.1.91±0.16,P=0.024;HG条件:0.48±0.15vs. 0.98±0.15,P=0.025)表达水平明显增加,差异有统计学意义,见图6A、B。在正常糖和HG条件下,0 nmol/L DCN组和100 nmol/L DCN 组的IGFIR蛋白表达水平无明显变化(正常糖条件:P=0.961;HG条件:P=0.879),见图6C、D;在正常糖下,100 nmol/L DCN组p-AKT蛋白(1.56±0.15)表达水平明显高于0 nmol/L DCN组(0.56±0.20),差异有统计学意义(P=0.019),见图6C、D。
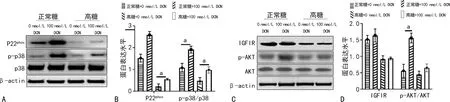
A、C:Western blot图;B、D:Western blot统计分析图;a:P<0.05。
3 讨 论
近年来,越来越多的证据表明,重新编程的代谢可能在胰腺癌的发生发展、治疗和预后中起关键作用[10]。研究报道,线粒体融合过程可以使胰腺癌破碎的线粒体正常化,并降低氧化磷酸化,从而抑制肿瘤生长和改善患者的存活率[11]。在哺乳动物中,线粒体是众所周知的重要细胞器,线粒体的分裂融合在能量代谢和细胞存活中具有重要作用[12]。且人重组DCN能够抑制胰腺癌细胞的生长[13]。然而,胰腺癌中DCN的表达变化及DCN对胰岛细胞线粒体的分裂、融合的影响目前尚未见报道。
本研究证明了PDAC和PNET患者癌组织中DCN表达水平明显降低,并且,主要定位表达于胰岛部位。因此,DCN可能与胰岛β细胞的生长和功能密切相关。其次,通过检测线粒体融合相关蛋白(MFN1、MFN2和OPA)和线粒体分裂相关蛋白(DRP1、FIS1和MFF)表达发现,PDAC和PNET患者胰岛可能存在线粒体融合增加和线粒体分裂减少。这可能导致胰岛细胞生长和功能受损,胰岛素分泌不足,这与早期报道的MFN2抑制胰腺癌细胞的增殖和促进细胞凋亡结果一致[14-15]。MFN2将线粒体和内质网功能与胰岛素信号传导联系在一起,对于正常的葡萄糖稳态是必不可少的[16]。本研究发现,DCN可促进胰岛β细胞增殖,并在HG条件下,抑制胰岛β细胞凋亡。同时,DCN在正常糖条件下促进线粒体分裂,抑制线粒体融合,而在HG条件下,DCN抑制线粒体分裂和线粒体融合。提示,DCN可能通过调控线粒体分裂融合影响胰岛β细胞生长和胰岛素释放。在HG中,胰岛β细胞呈现高度的胰岛素抵抗、糖耐受和AKT表达水平下调。因此,DCN可能进一步下调HG环境线粒体分裂、融合。研究报道,DCN可调控P22phox/MAPK通路和IGFIR/AKT通路影响细胞生长和功能[5,17]。本研究结果显示,在正常糖条件下,DCN上调胰岛β细胞P22phox/MAPK通路和p-AKT表达,但不影响IGFIR表达。在HG条件下,DCN上调胰岛β细胞P22phox/MAPK通路,但不影响IGFIR/AKT通路。说明,DCN具有调控胰岛β细胞P22phox/MAPK通路介导线粒体分裂、融合的作用,继而在正常糖和HG条件促进胰岛β细胞增殖。提示,在胰腺癌中下调的DCN可能参与调控线粒体分裂、融合影响胰岛β细胞功能,继而影响胰腺癌的发生发展。
综上所述,DCN低表达于PDAC和PNET患者胰岛β细胞,且与胰岛β细胞线粒体融合分裂失衡密切相关。DCN可激活P22phox/MAPK通路,调控线粒体分裂、融合参与胰岛β细胞的胰岛素分泌和细胞增殖。从蛋白水平可知,DCN促进正常糖条件下胰岛β细胞的线粒体分裂并抑制融合,同时,DCN抑制HG条件下胰岛β细胞的线粒体分裂、融合,且DCN对正常糖和HG条件下均激活P22phox/MAPK信号。但在HG条件下DCN介导的P22phox/MAPK通路激活如何同时影响调控胰岛β细胞的线粒体分裂、融合尚需进一步研究。

