基于kV-CBCT图像验证非小细胞肺癌立体定向放疗的照射剂量
段宇新,邓祯祥,刘溪,朱宗达
1.南部战区空军医院肿瘤科,广东广州510600;2.厦门大学附属翔安医院肿瘤放疗科,福建厦门361101;3.广东药科大学医学信息与工程学院,广东广州510006
前言
近年来,立体定向放疗(Stereotactic Body Radiation Therapy,SBRT)已被广泛应用于Ⅰ/Ⅱ级及手术不能切除的非小细胞肺癌(Non-Small Cell Lung Cancer,NSCLC)的放疗,是一种对小靶区肿瘤实行短程超高分次剂量放疗的新型技术[1-3],因此,精准的照射剂量是治疗成功的关键[4-6]。目前,千伏级锥形束CT(Kilovoltage Cone-Beam Computed Tomography, kV-CBCT)已被广泛应用于直线加速器系统[7-8]。kV-CBCT图像不仅能用于验证治疗位置,还能用来监测肿瘤的退化与进展[9-12]。本研究通过验证单次照射剂量来分析NSCLC 的SBRT剂量分布的合理性,同时反映治疗响应中的剂量分布。
1 资料与方法
1.1 一般资料
选取2017~2019年于南部战区空军医院行SBRT的20例NSCLC患者,其中男16例,女4例,中位年龄65岁。
1.2 定位与扫描
本研究回顾性选取20 例行SBRT 的NSCLC 病例,每一次治疗前扫描的CBCT 图像可用于剂量计算,共收集100 张CBCT 图像。患者使用Bodyfix(Elekta, Crawley, UK)系统固定,从而提高摆位的重复性。采用飞利浦大孔径CT(Philips Brilliance,Cleveland,OH)1 mm层厚来扫描并获得4D CT图像。每次治疗前使用Elekta Synergy 机载CBCT 扫描获得kV-CBCT 图像。将所有4D CT 图像和kV-CBCT 图像传输到Pinnacle 9.8 治疗计划系统(Treatment Planning System)。
1.3 结构勾画与计划设计
肿瘤大体靶区(Gross Target Volume,GTV)是由一名资深放疗医师在标准肺窗水平下勾画。通过4D CT扫描得到的肿瘤运动幅度,以此作为患者运动外扩边界,生成内靶区(Internal Target Volume,ITV)。ITV到计划靶区(Planning Target Volume,PTV)的外扩边距设为3 mm。在CT图像上逐层勾画危及器官,主要包括左右肺、脊髓、胸壁、食管、心脏。CBCT图像上的感兴趣区域(包含靶区与危及器官)通过两种方式获得,分别为(1)CBCT图像与CT图像经过刚性配准后将原CT图像上的结构直接复制到CBCT图像,获得相应的感兴趣区域;(2)CBCT图像与CT图像经过形变配准后得到原CT图像上的感兴趣区域。
本研究使用Pinnacle 9.8 治疗计划系统(Philips)对20 例患者进行计划设计,共获得20 个照射的CT计划(Pct)、100个通过形变配准后重新优化计算获得的CBCT计划(Pdcbct)以及100个没有经过形变配准直接重新优化计算的CBCT 计划(Pcbct)。对于Pct计划,根据肿瘤位置生成两个全弧或部分弧的计划;对于Pcbct 计划和Pdcbct 计划,根据与原计划结构进行形变配准或者直接将原计划结构复制到CBCT 图像上优化生成两组计划。为进行剂量比较,所有计划处方归一为6 MV的X线能量,总剂量为50 Gy/5 F。所有计划都优化达到临床可接受的PTV 覆盖率和危及器官的控制量。
1.4 计划评估与比较
治疗计划的定量评估通过剂量体积直方图(Dose-volume Histogram, DVH)来完成。对于PTV,靶区覆盖率定义为PTV 体积接受的处方剂量;适形度指数(Conformity Index,CI)定义为100%等剂量线覆盖的体积与PTV体积的比值:CI=V100/PTV;梯度指数(Gradient Index, GI)定义为50%等剂量线覆盖的体积与PTV 体积的比值:GI=V50/PTV。对于正常组织,比较Pct、Pdcbct 和Pcbct 计划之间肺V10Gy、V15Gy、V20Gy,脊髓D2,胸壁V20Gy、V30Gy、V40Gy,其中,VxGy表示xGy剂量所覆盖的体积。
1.5 统计学分析
结果采用均值±标准差描述,计划之间采用单因素方差分析(One-way ANOVA)进行比较,两两比较采用SNK 法。所有统计学分析使用R 语言完成。P<0.05表示差异有统计学意义。
2 结果
与Pct 相比,20 例患者Pcbct 计划及Pdcbct 计划中靶区体积的覆盖率(V100%)平均误差分别为0.35 和0.63。ANOVA分析发现,只有一名患者的Pct、Pcbct、Pdcbct 计划的V100%具有明显差异(P<0.05),该患者3组计划的靶区剂量学参数比较见表1。

表1 1名患者的PTV剂量参数比较Table 1 Comparison of dosimetric parameters of PTV in a patient
在无结构改变的情况下,CI 和GI 在计划剂量和已执行的患者剂量分布之间显示出良好的一致性,单因素方差分析结果显示差异无统计意义,20 例患者的CI和GI的P值分别为0.73±0.09和0.58±0.22。
比较20 例患者3 种计划方式对危及器官的保护。结果发现所有指标仅在一名患者中差异有统计意义(表2);而在其他患者中,只有少数指标差异有统计学意义。
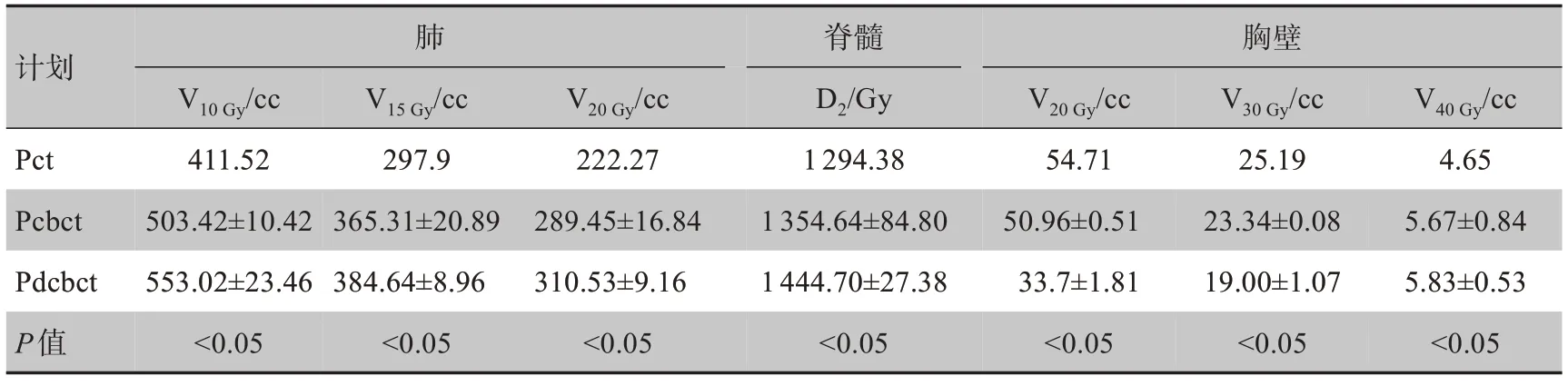
表2 1名患者的危及器官剂量参数比较Table 2 Comparison of dosimetric parameters of organs-at-risk in a patient
3 讨论
使用基于在治疗室中获取的CBCT 图像进行治疗验证是可行的,并且可以为行SBRT 的NSCLC 患者提供独立的验证。本研究回顾性研究了20 例行SBRT 的NSCLC 患者的非形变配准和形变配准计划的剂量学影响,分析了20 例患者的220 个治疗计划,包括20 个Pct、100 个Pdcbct、100 个Pcbct 计划。结果发现3种治疗方式下的PTV体积基本相同,这是可以预料的,因为与计划的CT 图像相比,这些患者仅有很小的解剖结果的变化。对于PTV 指标,发现V100%仅在一名患者中有明显差异,而CI 和GI 没有发现任何明显差异,这表明大多数患者的治疗计划都能得到准确的执行。
使用治疗前获取的信息进行剂量验证具有很多优势。首先,在治疗的第一天,用治疗室内的图像引导放疗技术扫描获得患者的解剖结构,在本研究中,采用了kV-CBCT。在首次治疗前几天或几周获得治疗计划CT(4D)图像;在此期间,患者的解剖结构可能会发生一些变化,如果确实发生了这些可能的变化,则在患者摆位时进行IGRT 得到的CBCT 图像中将可见。4D CBCT 技术不仅可用于发现解剖结构的改变,而且还可以得到呼吸运动引起的位置改变[13]。
其次,本研究采用了Pinnacle TPS 的动态模块,在每一次的CBCT上使用相同的射野参数、优化参数来生成计划。它有两种实现方式,一种是用非形变配准的方式将原始CT图像的结构放置到CBCT图像中;另一种是用形变配准的方式将原始CT 图像的结构放置到CBCT 图像中,也称为自适应放疗。Pct、Pdcbct、Pcbct 计划都仅在原始CT 中勾画外轮廓,射野和优化参数相同,因此可以最大程度地减少差异。
已有研究表明CBCT 计算剂量的可行性。Yoo等[14]研究了Catphan 模体的CT 和CBCT 图像之间的HU 值差异(纽约模体实验室)。Yang 等[15]评估了CT计划和CBCT计划之间的剂量差异,发现两者之间的剂量差异在2%以内,但是,由于呼吸运动,肺的剂量差异可能更高,可达3%。两项研究均表明,CBCT 可直接用于剂量计算。
本研究中,仅在一名患者中发现靶区覆盖率(V100%)差异具有统计学意义(P=0.03),而在其他患者中未观察到任何差异。Qin 等[16]对靶区大小变化的研究表明,靶区大小对肺癌SBRT 自适应性计划的剂量学有重要的影响。靶区变化小的患者很少能从自适应计划中获得预期的小剂量变化。本研究中,所有患者均没有发现CI和GI有显着性差异。
3D剂量验证的目的是要通过累加分次剂量来验证总照射剂量的准确性,为此,需要通过刚性配准或形变配准来验证每次照射剂量的准确性。从结果来看,无论是刚性配准或者形变配准,照射剂量都可以准确地投照。对于危及器官,大体积PTV 的执行剂量差异具有统计学意义,而较小PTV 则没有明显差异。因此,肺SBRT 的自适应放疗对于较大的靶体积减少照射剂量不失为更好的选择。
4 结论
使用Pinnacle 动态模块可以对行SBRT 的NSCLC 患者进行3D 剂量重新计算,使用治疗当天在治疗室内获得的kV-CBCT 图像计算可验证3D 剂量分布。使用kV-CBCT 对行SBRT 的NSCLC 患者进行剂量验证是可行的,并可提供相关的3D 执行剂量的信息。

