开关式氧化锌量子点荧光探针制备及其特异性检测Cu2+应用
崔 葆, 黄秋梅, 戎西林, 崔美佳, 程 昊, 冯 军, 黄文艺*
(1. 广西科技大学 生物与化学工程学院, 广西糖资源绿色加工重点实验室, 广西 柳州 545006;. 蔗糖产业省部共建协同创新中心, 广西 南宁 530004)
1 引 言
Cu2+是维持人体健康的必需微量元素之一,在许多正常生理过程中起着重要作用[1]。然而摄入过多的Cu2+会导致产生神经系统疾病[2],例如阿尔兹海默病[3-4]、帕金森氏病[5]、威尔逊氏病[6]等。另外,由于Cu2+在工业、农业以及生活中的广泛应用,其造成的环境污染问题日益突出[7-9]。传统检测Cu2+的方法主要有:原子吸收光谱法[10]、分光光度法[11]、电化学检测技术[12-13]、比色法[14]等,但是这些传统方法大多需要大量样品且检测时间较长。与这些传统检测Cu2+的方法相比,新型的荧光检测因省时又环保的优势引起了研究人员的极大关注。近年来,荧光探针在Cu2+检测方面有了长足的进展。Han等[15]设计合成了一种基于8-羟基喹啉的荧光探针,通过荧光响应信号对Cu2+进行快速识别。Samadhan等[16]开发了一种基于巯基丙酸封端的硫化镉量子点,通过分别添加D-青霉素和Cu2+来实现荧光定量检测Cu2+。Zhu等[17]成功建立了一种基于碳量子点的Cu2+和谷胱甘肽的比例荧光检测方法,通过碳量子点和2,3-二氨基吩嗪之间的荧光共振能量转移实现Cu2+的定量检测。
目前,检测Cu2+的荧光探针主要包括有机染剂、分子荧光以及量子点(QDs)。其中,有机染剂因易被光漂白而被限制了使用。QDs因具有很好的光稳定性、较大的斯托克斯位移、宽激发谱和窄发射谱等性质及比传统的有机荧光团更优异的分析性能,在光催化、太阳能电池、生物识别和检测等多种领域[18-26]具有潜在的应用价值。在各种QDs中,氧化锌量子点(ZnO QDs)具有独特的发光特性,主要发出红色、黄色、蓝色、绿色和紫外荧光[27]。其中,最常见的是500 nm处的绿色荧光。ZnO QDs具有较强的荧光发射强度以及稳定性,同时还具有安全无毒、经济实用等特点。目前,ZnO QDs已成功应用于紫外线发射器、传感器、晶体管、太阳能电池、光催化、医学、化妆品等[28-34]领域。开发ZnO QDs作为荧光探针特异性检测重金属离子,具有广泛的应用前景。
目前,基于ZnO QDs的荧光探针检测方法大多是猝灭型荧光响应,通过猝灭ZnO QDs的荧光强度来达到检测的目的。这种检测方法容易受周围环境的影响,从而降低检测方法的分析性能。“开-关-开”式荧光检测是在猝灭型荧光检测的基础上再加入另一种物质使得原本已经猝灭的荧光恢复,提高了实验结果的准确性。
本文通过溶胶凝胶法成功制备出一种荧光性能稳定的ZnO QDs,并用3-氨丙基三乙氧基硅烷(APTEs)对其进行封端处理,成功合成出具有水溶性的ZnO-NH2QDs。基于Cu2+对ZnO-NH2QDs的动态猝灭效应,且Cu2+与OPD反应生成具有荧光的配合物2,3-二氨基吩嗪(DAP)[17],设计了ZnO-NH2QDs+Cu2++OPD的“开-关-开”荧光恢复系统,构建了一种新型荧光探针。该方法不需要对样品进行前处理,减少了样品检测的繁琐性,提高了检测结果的准确度和灵敏度,可用于特异性识别Cu2+。
2 实 验
2.1 试剂与仪器
试剂:二水合乙酸锌(Zn(Ac)2·2H2O)购于西陇化工股份有限公司,氢氧化钾(KOH)、氢氧化钠(NaOH)、盐酸(HCl)购于广州市金华大化学试剂有限公司,3-氨丙基三乙氧基硅烷(APTEs)购于阿拉丁试剂有限公司,Cu2+标准溶液(1 000 μg/mL)购于美国Alfa Aesar有限公司,三(羟甲基)氨基甲烷(Tris)购于阿拉丁试剂有限公司,邻苯二胺(OPD)购于上海麦克林生化科技有限公司,六水合氯化镁(MgCl2·6H2O)、氯化钙(CaCl2)、硫酸镉(CdSO4)、氯化钡(BaCl2)、氯化锌(ZnCl2)、硫酸锰(MnSO4)、氯化汞(HgCl2)、三水合醋酸铅(Pb(Ac)2·3H2O)、六水合氯化铁(FeCl3·6H2O)、硫酸铜(CuSO4)和无水乙醇均购于成都科隆化学品有限公司。实验中所用试剂均为分析纯,所用水为本实验室自制超纯水。
仪器:透射电子显微镜(日本 JEOL,JEM-2100),X射线衍射仪(德国 Bruker,D8A A25),X射线光电子能谱(美国 THERMO,Thermo 250i),傅里叶变换红外光谱仪(德国 Bruker公司,INVENIOR),紫外-可见分光光度计(美国 THERMO,Evolution 220),稳瞬态荧光光谱仪(美国 HORIBA,FluoroMax-4),电感耦合等离子体原子发射光谱仪(美国安捷伦,Agilent ICP-OES730)。
2.2 量子点制备
取2.195 g Zn(Ac)2·2H2O分散于100 mL无水乙醇中,65 ℃搅拌溶解形成Zn(Ac)2乙醇溶液。另将0.4 g NaOH分散于100 mL无水乙醇中,65 ℃搅拌溶解形成NaOH乙醇溶液。将NaOH乙醇溶液加入Zn(Ac)2乙醇溶液中,在同温度下搅拌反应2 h生成白色沉淀,将其离心后用无水乙醇洗涤数次后于冰箱中冷藏保存,取一部分样品在50 ℃下真空干燥,得到ZnO QDs粉末并用于表征检测。
将上述得到的ZnO QDs分散在20 mL无水乙醇中,加入10 mL 0.05 mol/L APTEs乙醇溶液、0.4 mL超纯水,室温下快速搅拌,反应2 h,离心分离后用无水乙醇和超纯水分别洗涤3次,制得ZnO-NH2QDs。将部分ZnO-NH2QDs样品在50 ℃下真空干燥,制成ZnO-NH2QDs粉末,用于样品的微观形貌、晶形结构和光学性能表征。其余ZnO-NH2QDs样品分散于超纯水中,放置4 ℃冰箱中保存备用。
2.3 量子点表征
将所制备样品烘干制成粉末,通过紫外-可见分光光度计(UV-Vis)进行表征,测量样品的紫外-可见吸收光谱,检测光谱范围为300~750 nm。用X射线光电子能谱(XPS)对其元素进行表征分析,将样品固定在导电胶上进行测试。透射电子显微镜(TEM)和X射线衍射(XRD)用于表征所制备样品的形貌、晶体结构和物相分析。将样品粉末超声分散成悬浮液浸渍铜网,室温干燥后进行TEM测试,获得样品的高分辨透射电子显微镜图。将样品研磨成粉末,放置在X射线衍射仪样品架上压实后检测得到X射线衍射图。将所制备的样品与溴化钾研磨混合压片,利用傅里叶变换红外光谱仪(FT-IR)对所制备样品进行测量,进而分析其含有的官能团。使用稳瞬态荧光光谱仪对所制备样品的荧光发射光谱及最佳发射波长处的荧光强度进行检测。利用荧光光谱仪自带的荧光寿命检测配件对样品的荧光寿命衰减曲线进行检测,并通过配套软件进行拟合。
2.4 Cu2+检测及其特异性识别
ZnO-NH2QDs对Cu2+检测:取1 mL制备好的 ZnO-NH2QDs于10 mL离心管中,再加入4 mL Tris-HCl缓冲溶液混合均匀。依次加入1 mL不同浓度的Cu2+标准溶液,用涡旋振荡混合器混合1 min后,用383 nm的紫外光进行激发,通过稳瞬态荧光光谱仪检测其荧光发射光谱,记录400~650 nm的光谱。以自来水为Cu2+实际样品,采用加标法检验ZnO-NH2QDs探针测定Cu2+的实用性。
ZnO-NH2QDs对Cu2+的特异性识别:在ZnO-NH2QDs中分别加入不同金属离子(K+、Na+、Mg2+、Ca2+、Cd2+、Ba2+、Zn2+、Mn2+、Hg2+、Pb2+、Fe3+及Cu2+)溶液形成ZnO-NH2QDs+Mn+体系(Mn+为某种金属离子),然后再加入OPD水溶液,形成ZnO-NH2QDs+Mn++OPD体系,分别检测ZnO-NH2QDs、ZnO-NH2QDs+Mn+体系、ZnO-NH2QDs+Mn++OPD体系的荧光性能,研究ZnO-NH2QDs 对Cu2+的选择性识别特性。
3 结果与讨论
3.1 表征分析
图1是所制备ZnO QDs和ZnO-NH2QDs的XRD图谱,两种不同ZnO QDs的衍射峰位置均与六方纤锌矿型ZnO的XRD标准卡片(COD 9011662)基本相同,位于31.79°、34.30°、36.12°、47.56°、56.57°、62.85°、68.19°处,分别对应ZnO的(100)、(002)、(101)、(102)、(210)、(103)、(212)晶面。图中未出现其他化合物的衍射峰,说明样品纯度较高,没有杂质或是其他副产物的产生。在引入APTEs之后,ZnO-NH2QDs的每个衍射峰都出现宽化且强度也有所下降,出现了明显的尺寸效应,说明所制备的ZnO-NH2QDs是纳米级别。ZnO-NH2QDs的谱图显示在21.6°处出现了氨丙基硅氧烷的衍射峰[35],进一步说明APTEs已成功引入ZnO QDs。

图1 ZnO QDs和 ZnO-NH2 QDs的XRD图谱
图2(a)为所制备的ZnO QDs的TEM图,图2(b)为ZnO-NH2QDs的TEM图,图2(c)为ZnO-NH2QDs的HRTEM图。从图中可以看出ZnO QDs和ZnO-NH2QDs都是类球形的颗粒状,粒径均一,ZnO-NH2QDs较ZnO QDs更为分散。所制备的ZnO-NH2QDs晶体结构较为完整,晶格条纹清晰可见,经分析,图中0.26 nm的晶格条纹对应的是ZnO-NH2QDs的(002)晶面[36]。从图中大致可以判断出ZnO-NH2QDs的尺寸约为4~7 nm。

图2 (a)ZnO QDs的透射电镜图谱;(b)ZnO-NH2 QDs的透射电镜图谱;(c)ZnO-NH2 QDs的高分辨透射电镜图谱。


图3 ZnO QDs和ZnO-NH2 QDs的红外光谱
图4为ZnO QDs-NH2的XPS图。图4(a)为XPS的全谱扫描图谱。图4(b)为Zn 2p的图谱,位于1 021.18 eV和1 044.13 eV处的两个峰对应于Zn 2p3/2和Zn 2p1/2,两峰间的能量差为23.05 eV,与22.97 eV的标准值相近,表明Zn的价态为+2价[39-40]。图4(c)为O 1s的XPS图谱,使用XPSpeak41分峰软件对ZnO QDs的O 1s光谱进行分峰拟合得到3个峰,分别位于530.23 eV(Zn—O)、531.63 eV(Si—O)和532.18 eV(C—OH/C—O—C)[41-42]。图4(d)为N 1s的XPS图谱,从中可以观察到3个拟合峰,分别是位于399.18 eV(N—Si)、399.73 eV(N—C)和400.53 eV(Si—N—O)[42]。表明APTEs已经成功修饰在ZnO QDs的表面,其结果与XRD、FTIR分析结果基本一致。

图4 ZnO-NH2 QDs的XPS谱。(a)全谱扫描;(b)Zn 2p;(c)O 1s;(d)N 1s。
3.2 ZnO-NH2 QDs荧光探针检测Cu2+
3.2.1 Cu2+的定量检测
将不同浓度的Cu2+标准溶液(0~9 000 nmol/L)作为荧光猝灭剂,对ZnO-NH2QDs进行荧光猝灭检测,以发射波长为横坐标、荧光强度为纵坐标作图,得到不同浓度下ZnO-NH2QDs+Cu2+的荧光发射光谱(图5(a))。检测534 nm处荧光强度,以Cu2+浓度为横坐标,(F0-F)/F0为纵坐标,得到Cu2+的工作曲线。F0表示未添加Cu2+时体系的荧光强度,F表示添加不同Cu2+浓度体系的荧光强度。以(F0-F)/F0对Cu2+浓度进行线性回归分析,在40~9 000 nmol/L范围内,Cu2+浓度与(F0-F)/F0呈良好的线性关系,线性方程为y=0.10456x-0.00788,相关系数R2=0.999 43,根据S/N=3(N为校准曲线的斜率,S为空白溶液的标准差)得到LOD为3.93 nmol/L(图5(b))。

图5 ZnO-NH2 QDs对Cu2+的定量检测。(a)荧光发射光谱;(b)Cu2+的工作曲线。
表1列出了几种检测Cu2+的不同方法与本文方法进行比较。由表1可知,虽然其他检测方法的线性范围较宽,但检出限却远远高于本文办法的检出限,说明本文所构建的方法灵敏度高。

表1 检测Cu2+的不同方法
3.2.2 ZnO-NH2QDs荧光探针的重现性、选择性和干扰性
经过上述实验的优化,选取浓度为6 μmol/L的Cu2+标准溶液作为荧光猝灭剂,考察ZnO-NH2QDs荧光探针的重现性。将同一批次制备的ZnO-NH2QDs平行检测12次同一浓度Cu2+标准溶液(图6),检测结果的RSD值为0.16%。上述结果说明,ZnO-NH2QDs荧光探针用于检测Cu2+具有优异的重现性。

图6 ZnO-NH2 QDs荧光探针的重现性(加入Cu2+浓度为6 μmol/L)
为了评估基于ZnO-NH2QDs作为Cu2+定量检测的选择性荧光探针的实用性,我们对ZnO-NH2QDs荧光探针做了选择性检测实验。在相同实验条件下将常见的金属离子(K+、Na+、Mg2+、Ca2+、Cd2+、Ba2+、Zn2+、Mn2+、Hg2+、Pb2+、Fe3+及Cu2+)分别添加至ZnO-NH2QDs中,测定添加金属离子前后534 nm处的荧光发射强度,作荧光响应图(图7(a))。图中ΔF=F0-F1,其中,F0为未添加金属离子的ZnO-NH2QDs荧光强度,F1为ZnO-NH2QDs+Mn+的荧光强度。根据图7(a)可以看出,在实验条件下,Fe3+和Cu2+对ZnO-NH2QDs有显著的荧光猝灭现象,而K+、Na+、Mg2+、Ca2+、Cd2+、Ba2+、Zn2+、Mn2+、Hg2+、Pb2+等金属离子对ZnO-NH2QDs均无明显荧光猝灭现象。上述结果说明,除Fe3+外,ZnO-NH2QDs作为Cu2+定量检测的荧光探针具有良好的选择性。与此同时,我们还在干扰实验的基础上进行了OPD的添加,探究在干扰离子的存在下,OPD对ZnO-NH2QDs +Mn+体系的荧光恢复响应情况,结果如图7(b)所示,图中ΔF′=F2-F1。其中,F2为ZnO-NH2QDs +Mn++OPD的荧光强度。由图7(b)可以看出,在所有的ZnO-NH2QDs+Mn++OPD体系中,只有ZnO-NH2QDs+Cu2++OPD体系的荧光显著增强,其他ZnO-NH2QDs+Mn++OPD体系的荧光强度基本不变,说明OPD只会对ZnO-NH2QDs+Cu2+体系产生明显的荧光恢复,而对于Fe3+、K+、Na+、Mg2+、Ca2+、Cd2+、Ba2+、Zn2+、Mn2+、Hg2+、Pb2+等离子的ZnO-NH2QDs+Mn+体系不会产生荧光恢复。因此,通过ZnO-NH2QDs+Cu2++OPD体系可以进一步排除Fe3+对Cu2+检测的干扰,实现对Cu2+的特异性检测。
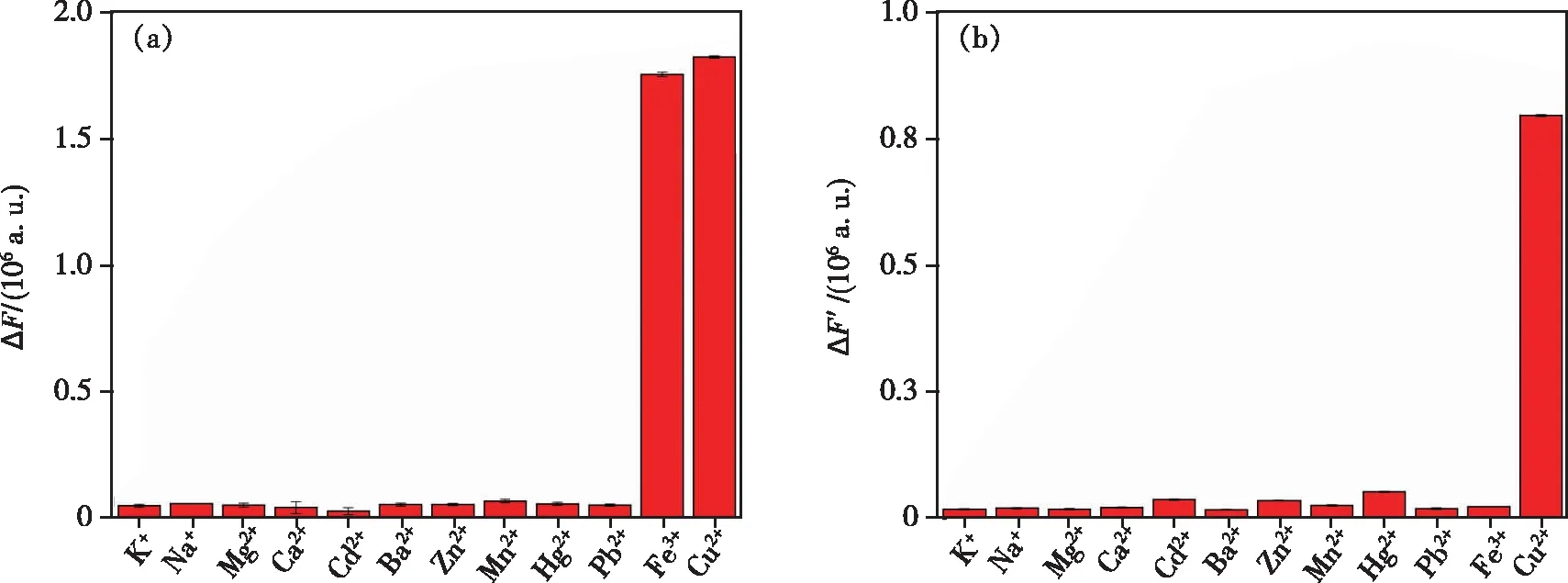
图7 选择性(Cu2+浓度:9 μmol/L;干扰物质浓度:200 μmol/L)。(a)ZnO-NH2 QDs荧光探针对干扰物质的荧光响应;(b)各干扰物质存在下OPD对ZnO-NH2 QDs荧光探针的响应。
3.2.3 Cu2+的特异性识别
在上述的选择性实验中,我们发现Cu2+和Fe3+均会对ZnO-NH2QDs荧光产生猝灭现象,但再加入OPD后,ZnO-NH2QDs+Cu2+体系的荧光能明显恢复,而ZnO-NH2QDs+Fe3+体系的荧光不能恢复。为此我们设计了一种基于ZnO-NH2QDs+Mn++OPD的荧光探针,用于特异性识别Cu2+。
实验结果如图8所示,图8(a)为ZnO-NH2QDs+Cu2++OPD的荧光激发光谱,ZnO-NH2QDs+Cu2+在添加OPD后,最佳激发波长由原来的383 nm变为419 nm。为验证ZnO-NH2QDs在没有Cu2+的情况下添加OPD后最佳激发波长是否会发生变化,在ZnO-NH2QDs中添加100 μL OPD,分别使用383 nm和419 nm作为激发波长对其进行荧光检测,结果如图8(b)所示。ZnO-NH2QDs+OPD在383 nm作为激发波长时具有很强的荧光强度,与ZnO-NH2QDs的荧光发射没有明显变化;而使用419 nm作为激发波长时,ZnO-NH2QDs+OPD几乎不产生荧光,这与ZnO-NH2QDs自身的激发光范围有关。

图8 (a)ZnO-NH2 QDs+Cu2++OPD激发光谱;(b)ZnO-NH2 QDs+OPD荧光发射光谱。
图9(a)、(b)为ZnO-NH2QDs+Cu2+和ZnO-NH2QDs+Cu2++OPD分别在激发波长为383 nm和419 nm时检测的荧光发射光谱。图9(c)、(d)为 ZnO-NH2QDs +Fe3+和ZnO-NH2QDs+Fe3++OPD分别在激发波长为383 nm和419 nm时检测的荧光发射光谱。

图9 (a)激发波长为383 nm时,加入OPD前后ZnO-NH2 QDs+Cu2+的荧光发射光谱;(b)激发波长为419 nm时,加入OPD前后ZnO-NH2 QDs+Cu2+的荧光发射光谱;(c)激发波长为383 nm时,加入OPD前后ZnO-NH2 QDs+Fe3+的荧光发射光谱;(d)激发波长为419 nm时,加入OPD前后ZnO-NH2 QDs+Fe3+的荧光发射光谱。
由图9(a)、(b)可以看出,ZnO-NH2QDs+Cu2+在引入了OPD后,体系发生荧光恢复现象。当激发波长为419 nm时,达到最佳荧光发射强度;而激发波长为383 nm时荧光发射强度明显低于前者,这个变化规律与ZnO-NH2QDs+Cu2++OPD的激发光谱的峰范围有关。结合图9(a)可知ZnO-NH2QDs+Cu2++OPD的最佳激发波长从ZnO-NH2QDs的383 nm变为419 nm,荧光发射光谱的最佳荧光发射波长也由534 nm变为560 nm,这说明OPD的加入使体系中生成了新物质。这是由于Cu2+和非荧光物质OPD反应生成具有黄色荧光的DAP。而图9(c)、(d)则表明ZnO-NH2QDs+Fe3+和ZnO-NH2QDs+Fe3++OPD在激发波长为383 nm时,荧光强度几乎没有变化,且最佳荧光发射波长依然为534 nm,最佳荧光发射峰位置没有发生改变。激发波长为419 nm时,ZnO-NH2QDs+Fe3+和ZnO-NH2QDs+Fe3++OPD几乎不产生荧光,这是因为419 nm的激发光不在ZnO-NH2QDs的激发波长范围内。上述结果说明,因为Fe3+无法与OPD配位,在ZnO-NH2QDs+Fe3++OPD中并未生成新的物质,OPD的存在对ZnO-NH2QDs+Fe3+系统不产生影响,所以无法产生荧光恢复现象。
由图10可知,ZnO-NH2QDs+Fe3+、ZnO-NH2QDs+Fe3++OPD的紫外-可见光谱基本重合,说明没有新的物质产生(图10(a)),ZnO-NH2QDs+Cu2++OPD的紫外-可见光谱在419 nm有一个明显的峰,与DAP一致,说明生成了DAP(图10(b))[17]。

图10 紫外-可见吸收光谱。(a)ZnO-NH2 QDs+Fe3+与ZnO-NH2 QDs+Fe3++OPD;(b)ZnO-NH2 QDs+Cu2+与ZnO-NH2 QDs/Cu2++OPD。
为研究ZnO-NH2QDs+Cu2++OPD系统荧光恢复的反应时间,我们利用动力学曲线研究了ZnO-NH2QDs+Cu2++OPD的荧光恢复强度随时间的变化(图11)。如图所示,横坐标为反应时间,隔0.5 min自动监测荧光发射强度,总时长为1 h,纵坐标为419 nm激发波长下560 nm处的荧光发射强度。根据动力学曲线可以发现,在反应时间0~30 min之间,560 nm处荧光强度逐渐上升;在反应发生30 min后,ZnO-NH2QDs+Cu2++OPD系统的荧光强度基本保持不变。由此可知,利用ZnO-NH2QDs+Mn++OPD系统荧光恢复进行特异性识别Cu2+的反应时长为30 min。

图11 反应时间对ZnO-NH2 QDs+Cu2++OPD荧光恢复的影响
3.2.4 荧光猝灭机制
常见的荧光猝灭过程主要包括静态猝灭和动态猝灭两种形式[47]。静态猝灭是指猝灭剂与荧光材料之间生成非荧光络合物,在该过程中可以观察到紫外-可见吸收光谱增加。而动态猝灭过程是指猝灭剂与荧光材料之间发生能量转移或电荷转移的过程。
为研究Cu2+导致ZnO-NH2QDs荧光猝灭可能的机制,测量了ZnO-NH2QDs+Cu2+体系的荧光寿命衰减曲线和紫外-可见吸收光谱。检测添加了Cu2+的ZnO-NH2QDs+Cu2+体系的荧光强度,并与Cu2+的浓度建立线性关系。检测结果如图12所示。ZnO-NH2QDs+Cu2+体系的荧光寿命衰减曲线通过如下二阶函数进行拟合:
(1)
(2)
其中,A1和A2是相应的拟合参数,C为一个常数,τ1和τ2分别为荧光寿命的快组分和慢组分,τ为平均寿命。如图所示,经过二阶指数函数拟合,得到的ZnO-NH2QDs+Cu2+体系荧光寿命。当系统中不存在Cu2+时,ZnO-NH2QDs的荧光寿命为35.71 ns;当ZnO-NH2QDs+Cu2+中Cu2+浓度为1 μmol/L时,荧光寿命为27.21 ns;当系统中Cu2+浓度为8 μmol/L时,荧光寿命减弱为13.87 ns。由此可见,随Cu2+浓度增加,ZnO-NH2QDs+Cu2+的荧光寿命明显降低。实验结果表明,Cu2+对ZnO-NH2QDs荧光猝灭存在动态猝灭过程。

图12 ZnO-NH2 QDs+Cu2+系统的荧光寿命衰减曲线
为进一步验证是否存在静态猝灭过程,测量了在ZnO-NH2QDs中添加0,1,8 μmol/L Cu2+的紫外-可见吸收光谱。检测结果如图13所示,实验结果表明,添加Cu2+对吸收光谱没有明显的影响,说明ZnO-NH2QDs+Cu2+体系中没有新物质生成,进一步证明荧光猝灭并非静态猝灭。而通过比较Cu2+紫外-可见吸收光谱与ZnO-NH2QDs的荧光发射光谱,发现它们之间几乎没有重叠,证明Cu2+对ZnO-NH2QDs的荧光猝灭作用不是内过滤(Inner filter effect,IFE)效应造成的,同时也证明了荧光共振能量转移的存在。通过检测ZnO-NH2QDs+Cu2+体系的量子产率,也进一步证明了上述结果(如表2所示)。
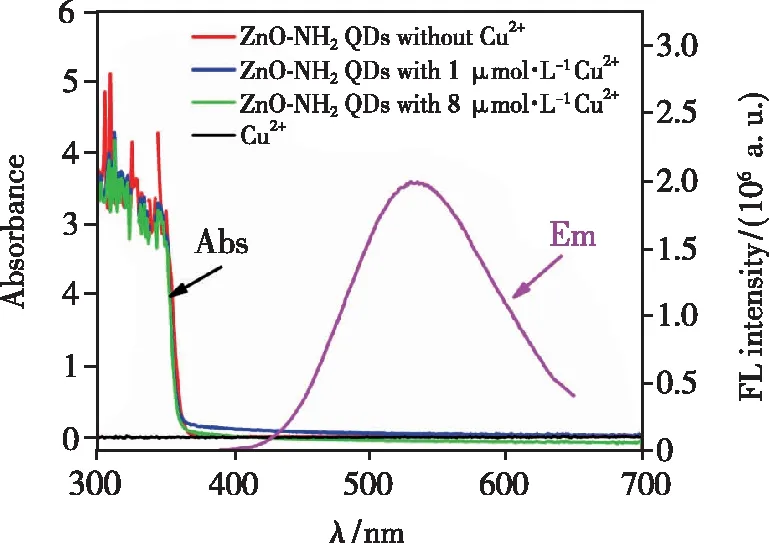
图13 ZnO-NH2 QDs+Cu2+、Cu2+的紫外-可见吸收光谱和 ZnO-NH2 QDs的荧光发射光谱。

表2 ZnO-NH2 QDs+Cu2+的量子产率
3.2.5 Cu2+实际样品检测
为评估该荧光传感系统对真实水样检测的可行性,研究了自来水以及广西省柳州市柳江水中Cu2+的含量。样品溶液中金属离子浓度可以从荧光强度(F0-F)/F0与金属离子浓度之间的线性关系(图5(b))获得。通过将测试值与添加的标准浓度金属离子的测试值进行比较,可以得出加标离子的加标回收率。测定结果如表3和表4所示,自来水中Cu2+的加标回收率范围为99.37%~100.58%,柳江水中Cu2+的加标回收率范围为97.43%~101.47%。这些实验结果表明,ZnO-NH2QDs荧光探针能够定量检测实际水样中的Cu2+。

表3 采用标准添加法测定真实水样中的Cu2+
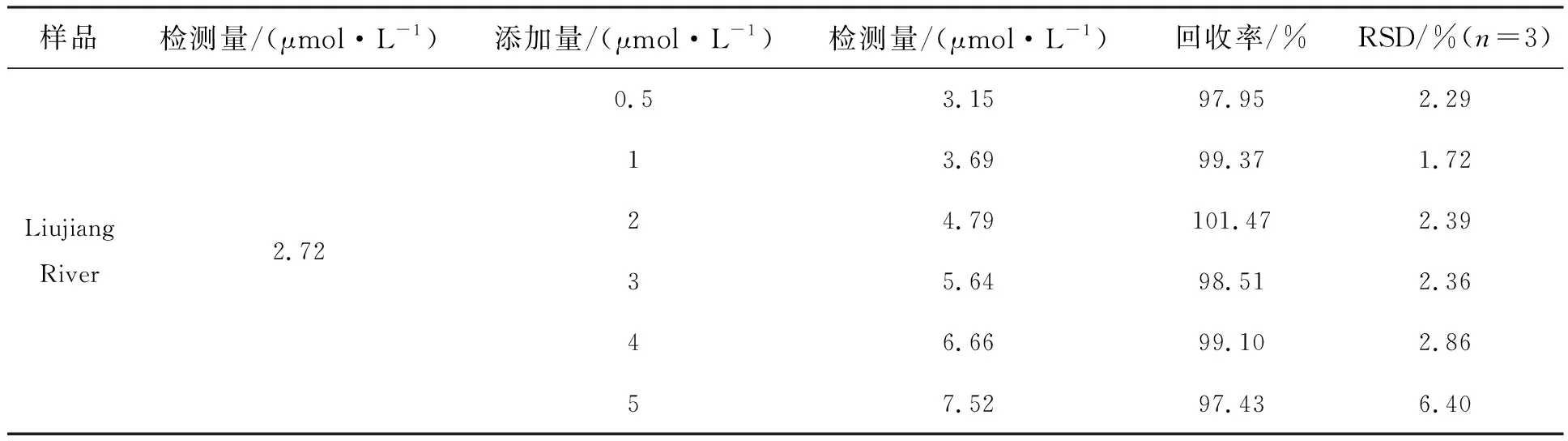
表4 采用标准添加法测定柳江水中的Cu2+
4 结 论
本文通过溶胶凝胶法成功制备出ZnO QDs,并用APTEs对其进行封端处理制得ZnO-NH2QDs。ZnO-NH2QDs具有较高的荧光稳定性和水溶性。基于Cu2+对ZnO-NH2QDs的动态猝灭效应原理,Cu2+与OPD生成具有荧光强度的配合物DAP,成功设计了ZnO-NH2QDs+Cu2++OPD荧光恢复系统,构建一种用于特异性识别Cu2+的新型荧光探针。实验结果表明,在最优检测条件下,ZnO-NH2QDs的荧光响应(F0-F)/F0与Cu2+浓度在40~9 000 nmol/L范围内呈良好的线性关系,线性方程为y=0.10456x-0.00788,相关系数R2=0.999 43,LOD为3.93 nmol/L。将该荧光传感器成功应用于自来水和柳江水中Cu2+的定量检测,通过标准样品添加法,得到在自来水中的加标回收率在98%~100.58%之间,在柳江水中Cu2+的加标回收率范围为97.43%~101.47%。结果表明该传感器对Cu2+有较好的选择性和准确度,能为金属离子的荧光快速检测提供一种新的方法。
本文专家审稿意见及作者回复内容的下载地址:http://cjl.lightpublishing.cn/thesisDetails#10.37188/CJL.20210408.

