KLF2、GBP5和DUSP3基因检测对活动性肺结核病人的诊断价值
周佳玉 隋爱华 李金凤 王芳芳 林存智


[摘要]目的探讨Krüppel样转录因子2(KLF2)、鸟苷酸结合蛋白5(GBP5)和双特异性磷酸酶3(DUSP3)基因及结核(TB)评分在肺结核病人中的诊断价值。方法选取确诊活动性肺结核(ATB)病人110例、肺部其他疾病(OPD)病人114例、潜伏结核感染(LTBI)病人52例及健康对照者63例作为研究对象,应用实时荧光定量PCR(RT-PCR)方法检测各组研究对象外周血中KLF2、GBP5和DUSP3基因表达,应用受试者工作特征曲线(ROC曲线)分析3组基因及TB评分在肺结核诊断中的价值。结果ATB组的DUSP3基因表达显著高于OPD组、LTBI组及健康对照组,差异有统计学意义(χ=145.162,P<0.01)。以ATB為阳性、健康对照组为阴性,ROC曲线分析显示,DUSP3基因的曲线下面积(AUC)为0.962,诊断灵敏度96.4%,特异度84.1%;KLF2基因AUC为0.724,GBP5基因AUC为0.710;TB评分的AUC为0.929,诊断灵敏度96.4%,特异度为82.5%。且DUSP3基因在区分ATB和LTBI时,AUC为0.805,灵敏度55.5%,特异度90.4%;而KLF2、GBP5、DUSP3基因及TB评分在区分ATB和OPD时AUC均<0.700。结论DUSP3基因和TB评分对肺结核的诊断效能高,有望成为ATB的筛选指标。
[关键词]结核,肺;潜伏性结核;基因;诊断
[中图分类号]R521[文献标志码]A[文章编号]2096-5532(2022)02-0247-06
doi:10.11712/jms.2096-5532.2022.58.048[开放科学(资源服务)标识码(OSID)]
[网络出版]https://kns.cnki.net/kcms/detail/37.1517.R.20220311.1333.005.html;2022-03-1415:18:53
VALUE OF KRPPEL-LIKE TRANSCRIPTION FACTOR 2, GUANYLATE-BINDING PROTEIN 5, AND DUAL SPECIFICITY PROTEIN PHOSPHATASE 3 GENES IN DIAGNOSIS OF ACTIVE TUBERCULOSIS ZHOU Jiayu, SUI Aihua, LI Jinfeng, WANG Fangfang, LIN Cunzhi (Department of Respiratory & Critical Care Medicine, The Affiliated Hospital of Qingdao University, Qingdao 266003, China)
[ABSTRACT]ObjectiveTo investigate the value of Krüppel-like transcription factor 2 (KLF2), guanylate-binding protein 5 (GBP5), dual specificity protein phosphatase 3 (DUSP3), and tuberculosis (TB) score in the diagnosis of active tuberculosis (ATB). Methods A total of 110 patients with a confirmed diagnosis of ATB, 114 patients with other pulmonary diseases, 52 patients with latent tuberculosis infection (LTBI), and 63 healthy controls were enrolled as ATB group, OPD group, LTBI group, and HC group, respectively. Quantitative real-time PCR was used to measure the expression of KLF2, GBP5, and DUSP3 genes in peripheral blood, and the receiver operating characteristic (ROC) curve was used to analyze the value of these three genes and TB score in the diagnosis of tuberculosis. ResultsThe ATB group had a significantly higher expression level of DUSP3 than the OPD group, the LTBI group, and the HC group (χ=145.162,P<0.01). With the ATB group as positive and the HC group as negative, the ROC curve analysis showed that the DUSP3 gene had an area under the ROC curve (AUC) of 0.962, with a sensiti-vity of 96.4% and a specificity of 84.1%; the KLF2 gene had an AUC of 0.724, and the GBP5 gene had an AUC of 0.710; TB score had an AUC of 0.929, with a sensitivity of 96.4% and a specificity of 82.5%. The DUSP3 gene had an AUC of 0.805 in differentiating ATB from LTBI, with a sensitivity of 55.5% and a specificity of 90.4%, while KLF2, GBP5, DUSP3, and TB score had an AUC of <0.700 in differentiating ATB from OPD.ConclusionThe DUSP3 gene and TB score have a high diagnostic efficiency for tuberculosis and are thus expected to become new screening indices for ATB.
[KEY WORDS]tuberculosis, pulmonary; latent tuberculosis; genes; diagnosis
结核病是由结核分支杆菌引起的慢性传染性疾病,每年新增感染结核(TB)病人1 000万人,是世界十大致死疾病之一,中国也是全球30个结核高负担国家之一[1]。结核病主要传染源是痰涂片阳性的肺结核病人,但是全球结核分支杆菌感染者多数以潜伏结核感染(LTBI)存在,而LTBI可发展为活动性结核,成为主要的传染源[2],早期、快速、有效地诊断肺结核和有效地筛查LTBI人群对有效控制结核病有重大意义。目前,用于诊断LTBI的方法有结核菌素试验(TST)和γ-干扰素释放试验(IGRAs),但是由于接种卡介苗的影响,IGRAs在LTBI中的诊断效能更高[3-4]。QuantiFERON TB-GOLD (QFT)试验为IGRAs方法之一,可用于区分LTBI和健康人群。既往有研究显示,实时荧光定量PCR(RT-PCR)技术检测结核相关基因可以用于肺结核的诊断[5-6]。SWEENEY等[7]进行的Meta分析发现,鸟苷酸结合蛋白5(GBP5)、Krüppel样转录因子2(KLF2)、双特异性磷酸酶3(DUSP3)基因在肺结核诊断中有意义,并提出TB评分可用于诊断肺结核和LTBI。本文研究外周血单个核细胞(PBMC)中KLF2、GBP5、DUSP3基因表达和TB评分在活动性肺结核(ATB)和LTBI人群中差异,并探讨其在ATB中的诊断价值。
1资料和方法
1.1一般资料
本实验采取前瞻性研究方法,研究对象来源于2019年5月1日—12月31日就诊于青岛大学附属医院呼吸与危重医学科和青岛市黄岛结核病防治所病人,以及同期青岛大学附属医院体检中心健康体检者。其中ATB病人110例,男性64例,女性46例,平均年龄(46.65±19.40)岁,诊断符合中华医学会结核病学分会《肺结核诊断和治疗指南》标准[8],排除合并免疫缺陷类疾病及服用免疫抑制剂的病人。肺部其他疾病(OPD)病人114例,男性62例,女性52例,平均年龄(54.94±15.18)岁;胸部CT检查显示肺部有阴影,QFT试验阴性,痰抗酸杆菌检测连续3次阴性,有肺部疾病症状及体征,包括肺癌、支气管扩张伴感染、慢性阻塞性肺疾病、机化性肺炎、结节病、细菌性肺炎、肺曲霉菌病、肺隐球菌病等。LTBI病人52例,男性30例,女性22例,平均年龄(54.03±16.18)岁;双肺CT检查正常,QFT试验阳性,无结核感染症状、体征及病原学依据[9]。健康对照者63例,其中男性34例,女性29例,平均年龄(46.40±18.34)岁;QFT试验阴性且无结核感染症状、体征,无肺部影像学改变。4组人群性别差异无统计学意义(P>0.05),OPD组年龄高于ATB组和健康对照组(F=16.164,P<0.05)。本研究获得研究对象或家属的知情同意,并通过青岛大学附属医院伦理委员会的批准。
1.2仪器和试剂
RT-PCR仪(Roche LightCycler480Ⅱ,Switzerland);Thermo Nano Drop 2000C核酸检测仪(Thermo Fisher Scientific,USA);人外周血淋巴細胞分离液(Ficoll配制,天津市灏洋生物制品科技有限公司);RNAiso Plus(Takara,Japan);PrimeScript RT reagent Kit with gDNA Erase(Perfect Real time,Takara,Japan);TB Green Premix Ex Taq Ⅱ(Tli R NaseH Plus,Takara,Japan);PCR引物由生工生物工程(上海)股份有限公司合成。
1.3研究方法
1.3.1标本采集和处理采集受检者外周静脉血4 mL,EDTA抗凝,采用Ficoll密度梯度离心法分离PBMC。应用Trizol法提取PBMC总RNA,用Thermo Nano Drop 2000C核酸检测仪检测RNA浓度及质量。
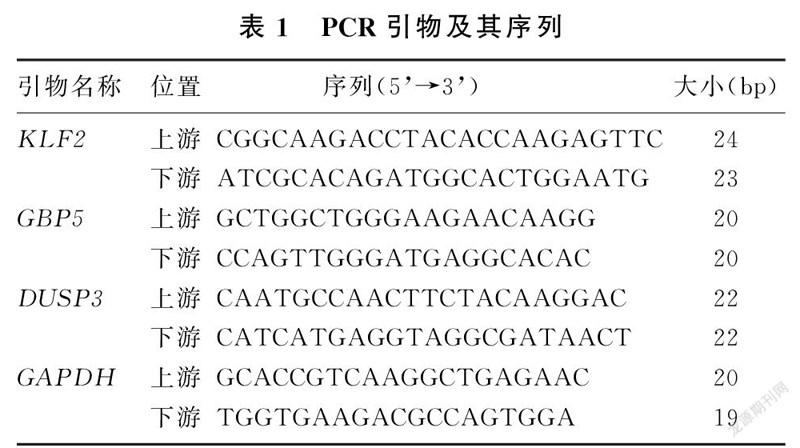
1.3.2RT-PCR方法检测KLF2、GBP5、DUSP3基因表达在0.2 mL反应管中加入5×gDNA Eraser Buffer 2 μL、gDNA Eraser 1 μL、Total RNA 1 ng、RNase Free HO至10 μL,42 ℃反应2 min;再次加入PrimeScript RT Enzyme Mix I 1 μL、RT Primer Mix 1 μL、5×PrimeScript Buffer 24 μL、RNase Free HO 4 μL混匀,37 ℃、15 min,85 ℃、5 s,得到cDNA。RT-PCR反应体系20 μL,内含:TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus,2×)10.0 μL,PCR上游和下游引物(10 μmol/L)各0.8 μL,cDNA 2.0 μL,灭菌水6.4 μL。PCR反应条件:预变性95 ℃、30 s,1个循环;95 ℃、5 s,60 ℃、30 s,40个循环;融解曲线分析95 ℃、5 s,60 ℃、60 s,95 ℃,1个循环;降温40 ℃、60 s,1个循环。反应在Roche Light Cycler 480Ⅱ RT-PCR仪中进行。反应结束后得到Ct值,以2-△Ct值(△Ct=目的基因Ct值-内参照基因Ct值)表示目的基因的表达量。以GAPDH基因作为内参照。实验所用引物由生工生物工程(上海)股份有限公司设计合成,见表1。
1.3.3TB评分的计算TB评分=(GBP5基因表达+DUSP3基因表达)/2-KLF2基因表达[8]。
1.4统计学方法
应用SPSS Statistics 23软件以及GraphPadPrism 5软件进行统计学分析。首先应用Shapiro-Wilk检验分析数据是否服从正态分布,非正态分布计量资料结果以M(P,P)表示,多组数据间比较采用Kruskal-Wallis H检验,两两比较采用Bonferroni校正多重比较的方法。应用受试者工作特征曲线(ROC曲线)下面积(AUC)评估诊断效能[7],用Youden指数计算最佳诊断界值[10]。P<0.05表示差异有统计学意义。
2结果
2.1各组KLF2、GBP5和DUSP3基因表达比较
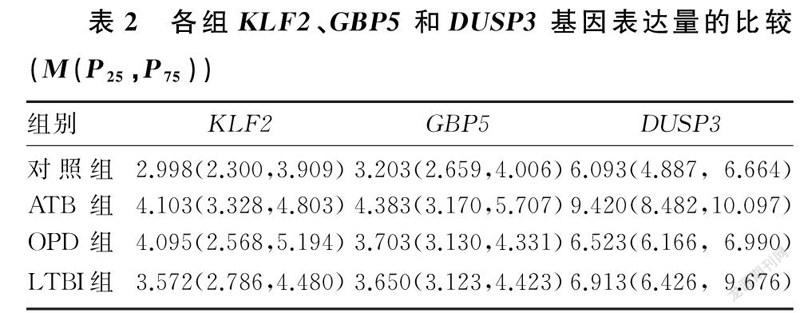
ATB组、OPD组、LTBI组以及健康对照组KLF2、GBP5和DUSP3基因表达差异有显著意义(χ2=26.842~145.162,P<0.01)。其中KLF2基因表达ATB组高于OPD组和健康对照组,差异有统计学意义(z=4.274、4.477,P<0.01),但OPD组、LTBI组和健康对照组比较差异无显著意义(P>0.05)。GBP5基因表达ATB组高于OPD组和健康对照组(z=2.785、5.108,P<0.01),OPD组高于健康对照组(z=2.770,P<0.01)。DUSP3基因表达ATB组高于OPD组、LTBI组和健康对照组,差异有显著性(z=3.793~11.524,P<0.01),OPD组高于LTBI组(z=3.505,P<0.01)和健康对照组(z=8.370,P<0.01),LTBI组高于健康对照组(z=3.882,P<0.01)。见表2。
2.2KLF2、DUSP3和GBP5基因表达及TB评分的诊断效能
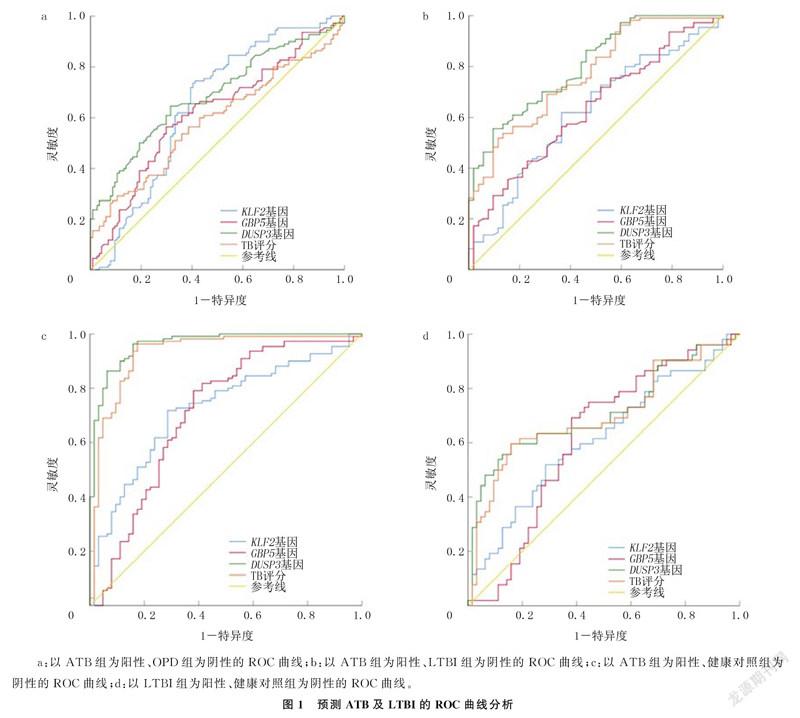
2.2.1区分ATB和OPD的诊断效能以ATB为阳性、OPD为阴性,绘制ROC曲线进行分析,结果显示,KLF2、DUSP3、GBP5基因和TB评分的AUC均<0.700。见图1a和表3。
2.2.2区分ATB和LTBI的诊断效能以ATB为阳性、LTBI为阴性,ROC曲线分析显示,DUSP3基因的AUC为0.805,灵敏度为55.5%,特异度为90.4%;TB评分的AUC为0.771,灵敏度为51.8%,特异度为88.5%。见图1b和表3。
2.2.3区分ATB和健康人群的诊断效能以ATB为阳性、健康人群为阴性,ROC曲线分析显示,DUSP3基因的AUC为0.962,灵敏度为96.4%,特异度为84.1%;TB评分的AUC为0.929,诊断灵敏度为96.4%,特异度为82.5%。GBP5、KLF2基因的AUC分别为0.710、0.724。见图1c和表3。
2.2.4区分LTBI和健康人群的诊断效能以健康人群为阴性、LTBI为阳性,ROC曲线诊断效能分析显示,DUSP3基因的AUC为0.712,诊断灵敏度为59.6%,特异度为84.1%。见图1d和表4。
3讨论
目前全球有近17亿人感染结核,多数为LTBI状态,部分可发展为ATB,且结核已成为慢性传染病中致死率最高的疾病[1]。早期诊断和治疗结核感染能够有效地改善病人预后,也是控制结核传播的重要环节。LTBI的诊断在结核防控中起着至关重要的作用。目前诊断肺结核的方法主要包括临床症状体征、影像学检查、病原学检查(痰涂片、痰培养、痰结核菌PCR+探针检测)、病理检查、免疫学检查(TST、酶联免疫吸附试验、IGRAs)等[8,11]。LTBI的诊断方法包括TST和IGRAs,IGRAs具有较高的灵敏度和阴性预测值,但是由于IGRAs价格昂贵,TST仍广泛应用[12-15]。传统的结核诊断方法存在缺陷,TST检测的假阳性率高[16],痰涂片检查的阳性率为60%~80%,但合并HIV感染者中痰涂片阳性的检出率仅有10%~30%[12]。结核分支杆菌培养为结核感染诊断的金标准,但是培养周期长。虽然IGRAs诊断结核的准确性高于TST,但是其检测结果受CD4T淋巴细胞计数影响[17],且不能区分ATB与LTBI[18]。目前,有研究显示可通过检测某些基因的表达来诊断ATB和LTBI。
本文研究对象中,OPD组的年龄高于ATB组和健康对照组,但是无证据显示结核病的发病率及3组基因的表达量与年龄相关。本文PCR检测结果显示,ATB组、OPD组、LTBI组以及健康对照组KLF2、GBP5、DUSP3基因表達差异有统计学意义。KLF2基因在人类单核细胞中高表达,在类风
2期周佳玉,等. KLF2、GBP5和DUSP3基因检测对活动性肺结核病人的诊断价值251
湿关节炎、感染性疾病、动脉粥样硬化等疾病中有重要作用。KLF2基因可调节单核细胞的功能和分化,调节炎症因子白细胞介素-1β(IL-1β)、肿瘤坏死因子α(TNFα)、核转录因子-κB(NF-κB)等,炎症情况下循环单核细胞中的KLF2基因表达下调[19-24]。本实验结果显示,KLF2基因在ATB中表达上调,与SWEENEY等[7]研究结果不一致,其原因需进一步扩大样本量进行研究。GBP5基因可诱导巨噬细胞释放γ-干扰素促进炎症反应[25],炎症时GBP5基因表达上调促进AIM2炎性体的活化及IL-1β、IL-18等炎性细胞因子的释放[26]。LAUX等[5]研究显示,联合检测外周血GBP5基因和CD64基因表达区分ATB和OPD诊断效能高。ROE等[27]研究显示,外周血中GBP5基因表达可作为预测结核发病基因之一。本实验结果亦显示,GBP5基因在ATB组的表达显著高于OPD组和健康对照组,差异有显著性,与SWEENEY等[7]研究结果一致,但不能区分ATB和LTBI。DUSP3也称为VH1相关磷酸酶(VHR),为一种丝裂原活化蛋白激酶(MAPK)磷酸化调节因子,在细胞周期调控及血管生成中起重要作用,与多种肿瘤发病及肿瘤转移有关;也可通过调节巨噬细胞中NF-κB信号转导产生促炎细胞因子[28-30]。本研究结果显示,DUSP3基因在ATB组表达上调,可用于区分ATB和LTBI;LTBI组DUSP3基因表达高于健康对照组,该基因有望成为区分LTBI和健康人群的指标之一。
本文研究结果显示,DUSP3基因表达、TB评分可以作为区分ATB和LTBI的诊断依据,二者AUC分别为0.805和0.771,特异度分别为90.4%和88.5%,但灵敏度较低;以ATB为阳性、健康人群为阴性进行ROC曲线分析,结果显示,GBP5基因和KLF2基因表达在诊断ATB中有一定的诊断准确性,AUC分别为0.710和0.724;DUSP3基因表达和TB评分的诊断效能高,AUC分别为0.962和0.929,且具有较高的灵敏度和特异度,有望成为诊断ATB的血液标志物。本文研究预测LTBI时,DUSP3基因表达的AUC为0.712,灵敏度和特异度分别为59.6%、84.1%,以其作为诊断LTBI的指标有一定临床意义;KLF2基因、GBP5基因表达对ATB的诊断效能和既往研究结果相似,但DUSP3基因的诊断效能明显高于既往研究[6]。
综上所述,KLF2基因、GBP5基因表达单独诊断ATB的效能不高,而DUSP3基因表达有较高的诊断价值,综合3组基因表达的TB评分具有较高的诊断准确性。本文研究标本来源于受试者的外周静脉血,标本较痰液易获取、污染概率更小,检测周期短,尤其是对无痰病人,这为ATB的诊断提供了新的思路。DUSP3基因表达和TB评分用于区分ATB和LTBI有一定的临床意义,因此DUSP3基因和TB评分有望成为ATB诊断的血液标志物之一,对ATB的早期诊断、治疗有重要的意义。对于LTBI的筛查,采集受试者外周血标本操作较TST试验方便,可降低人为因素带来的误差,价格也较IGRAs检测低。DUSP3基因表达在预测LTBI时有一定效能,这为LTBI的筛查研究提供了一个新的方向。本研究存在以下缺陷:实验样本较少,需进一步扩大研究样本以提高研究结果的准确性;未追踪ATB病人经过治疗后血液中相关基因表达量变化;未设置免疫缺陷组分析免疫功能对3组基因表达的影响。
[参考文献]
[1]World Health Organisation. Global tuberculosis report 2019[EB/OL]. [2020.04.24]. https://www.who.int/teams/glo-bal-tuberculosis-programme/tb-reports.
[2]彭超,王洪海. 結核分枝杆菌潜伏感染诊断方法的新进展[J]. 生物技术通讯, 2010,21(1):107-111.
[3]JANG J Y, PARK I W, CHOI B W, et al. The usefulness of the tuberculosis skin test and the interferon-gamma release assay in the diagnosis of latent tuberculosis infection in south Korea[J]. Osong Public Health and Research Perspectives, 2014,5:S18-S23.
[4]CAMPBELL J R, KROT J, ELWOOD K, et al. A systematic review on TST and IGRA tests used for diagnosis of LTBI in immigrants[J]. Molecular Diagnosis & Therapy, 2015,19(1):9-24.
[5]LAUX DA COSTA L, DELCROIX M, DALLA COSTA E R, et al. A real-time PCR signature to discriminate between tuberculosis and other pulmonary diseases[J]. Tuberculosis (Edinburgh, Scotland), 2015,95(4):421-425.
[6]FRANCISCO N M, FANG Y M, DING L, et al. Diagnostic accuracy of a selected signature gene set that discriminates active pulmonary tuberculosis and other pulmonary diseases[J]. The Journal of Infection, 2017,75(6):499-510.
[7]SWEENEY T E, BRAVIAK L, TATO C M, et al. Genome-wide expression for diagnosis of pulmonary tuberculosis: a multicohort analysis[J]. The Lancet Respiratory Medicine, 2016,4(3):213-224.
[8]中华医学会结核病学分会. 肺结核诊断和治疗指南[J]. 中华结核和呼吸杂志, 2001,24(2):70-74.
[9]中华医学会结核病学分会,《中华结核和呼吸杂志》编辑委员会.γ-干扰素释放试验在中国应用的建议[J]. 中华结核和呼吸杂志, 2014,37(10):744-747.
[10]YOUDEN W J. Index for rating diagnostic tests[J]. Cancer, 1950,3(1): 32-35.
[11]陈大川,王在义. 肺结核诊断的研究进展[J]. 临床肺科杂志, 2016,21(1):145-148.
[12]VITTOR A Y, GARLAND J M, SCHLOSSBERG D. Improving the diagnosis of tuberculosis: from QuantiFERON to new techniques to diagnose tuberculosis infections[J]. Current HIV/AIDS Reports, 2011,8(3):153-163.
[13]SHARMA S K, VASHISHTHA R, CHAUHAN L S, et al. Comparison of TST and IGRA in diagnosis of latent tuberculosis infection in a high TB-burden setting[J]. PLoS One, 2017,12(1):e0169539. doi:10.1371/journal.pone.0169539.
[14]中国防痨协会结核病临床专业委员会. 结核病临床诊治进展年度报告(2014年)(第一部分 结核病临床诊断)[J]. 中国防痨杂志, 2015,37(6):549-582.
[15]陈晶,张裕娴,芮勇宇. γ干扰素释放试验在结核病诊断中的应用价值[J]. 中国感染与化疗杂志, 2020,20(3):255-258.
[16]COOK V J, KURAMOTO L, NOERTJOJO K, et al. BCG vaccination and the prevalence of latent tuberculosis infection in an Aboriginal population[J]. The International Journal of Tuberculosis and Lung Disease, 2007,10(12):1347-1353.
[17]LI K, YANG C Y, JIANG Z C, et al. Quantitative investigation of factors relevant to the T cell spot test for tuberculosis infection in active tuberculosis[J]. BMC Infectious Diseases, 2019,19(1): 673.
[18]刘旭晖,乐军,张忠顺,等. γ-干扰素释放试验(IGRA)的诊断价值探讨(高感染率背景下的研究结果)[J]. 中国防痨杂志, 2010,32(12):801-805.
[19]MAHABELESHWAR G H, QURESHI M A, TAKAMI Y, et al. A myeloid hypoxia-inducible factor 1α-krüppel-like factor 2 pathway regulates gram-positive endotoxin-mediated Sepsis[J]. Journal of Biological Chemistry, 2012,287(2):1448-1457.
[20]DAS M, LU J, JOSEPH M, et al. Kruppel-like factor 2 (KLF2) regulates monocyte differentiation and functions in mBSA and IL-1β-induced arthritis[J]. Current Molecular Me-dicine, 2012,12(2):113-125.
[21]MAHABELESHWAR G H, KAWANAMI D, SHARMA N, et al. The myeloid transcription factor KLF2 regulates the host response to polymicrobial infection and endotoxic shock[J]. Immunity, 2011,34(5):715-728.
[22]DAS H, KUMAR A, LIN Z Y, et al. Kruppel-like factor 2 (KLF2) regulates proinflammatory activation of monocytes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006,103(17): 6653-6658.
[23]荆堂堂,倪晋泽,赵玉菲,等. Krüppel样转录因子2的功能[J]. 暨南大学学报(自然科学与医学版), 2018,39(5):376-384.
[24]JHA P, DAS H. KLF2 in regulation of NF-κB-mediated immune cell function and inflammation[J]. International Journal of Molecular Sciences,2017,18(11):2383.
[25]FUJIWARA Y, HIZUKURI Y, YAMASHIRO K, et al. Guanylate-binding protein 5 is a marker of interferon-γ-induced classically activated macrophages[J]. Clinical & Translational Immunology, 2016,5(11):e111.
[26]MEUNIER E, WALLET P, DREIER R F, et al. Guanylate-binding proteins promote activation of the AIM2 inflammasome during infection with Francisella novicida[J]. Nature Immunology, 2015,16(5):476-484.
[27]ROE J, VENTURINI C, GUPTA R K, et al. Blood transcriptomic stratification of short-term risk in contacts of tuberculosis[J]. Clinical Infectious Diseases, 2020,70(5):731-737.
[28]RUSSO L C, FARIAS J O, FERRUZO P Y M, et al. Revisiting the roles of VHR/DUSP3 phosphatase in human diseases[J]. Clinics (Sao Paulo, Brazil), 2018,73(suppl 1):e466s.
[29]VANDEREYKEN M, JACQUES S, VAN OVERMEIRE E, et al. Dusp3 deletion in mice promotes experimental lung tumour metastasis in a macrophage dependent manner[J]. PLoS One, 2017,12(10):e0185786. doi:10.1371/journal.pone.0185786.
[30]YAN Q, SHARMA-KUINKEL B K, DESHMUKH H, et al. Dusp3 and Psme3 are associated with murine susceptibility to Staphylococcus aureus infection and human Sepsis[J]. PLoS Pathogens, 2014,10(6):e1004149. doi:10.1371/journal.ppat.1004149.
(本文編辑黄建乡)

