制备条件对煤临氢液化催化剂晶相组成的影响
王昱心,李茂林,孙昱东
(中国石油大学(华东)化学工程学院,山东 青岛 266580)
我国的能源格局是富煤少油,石油资源严重依赖进口,为国家能源安全带来巨大挑战。由于煤炭燃烧会产生大量有害气体,严重污染环境,因此实现煤炭资源的清洁高效利用具有重大意义[1-3]。20世纪70年代以来,美国、德国、日本等发达国家相继开发了新一代煤直接液化技术,可以在缓和的条件下提高煤液化油的收率。其中,有代表性的煤液化工艺包括美国SRC-Ⅱ工艺和H-Coal工艺、德国IGOR+工艺以及日本NEDOL工艺等[4-5]。中国神华也开发了煤直接液化工艺,建成了百万吨级煤直接液化工艺示范装置[6]。
催化剂是影响煤液化油收率的关键因素,铁基催化剂因具有制备工艺简单、重复利用性好、价廉环保等优点而被广泛用于煤液化反应[7-8]。铁基催化剂在煤液化过程中生成的磁黄铁矿(Fe1-xS)是煤液化反应的主要催化活性相[9-11]。制备条件的不同会导致其生成磁黄铁矿的晶相、结构、分散性等存在显著差异,进而影响其催化活性:不同制备温度会影响催化剂中铁氧化合物前体的晶型,导致生成的磁黄铁矿晶粒的结构、尺寸产生差异;不同制备时间会影响催化剂中铁氧化合物前体的结晶度和晶相组成,导致生成的磁黄铁矿晶粒的结构产生差异;铁含量不同会使铁氧化合物前体的分散性产生差异,从而影响生成的磁黄铁矿的分散性[12-15]。研究发现,在较低制备温度下合成的铁氧化合物前体主要由α-FeOOH和γ-FeOOH晶相组成,由其制得的催化剂具有较高的比表面积,而且该铁氧化合物前体在煤液化反应时容易转化为细磁黄铁矿[16]。
目前,关于制备时间和铁含量对铁基催化剂性能影响的报道较少。为获得在反应时能转化为活性最优磁黄铁矿形态的铁基催化剂,本研究以灰分和挥发分含量高的鄂尔多斯煤为载体和液化反应原料、以加氢煤焦油为供氢溶剂油,考察制备温度、制备时间、铁煤比对煤液化反应催化剂的晶相组成、分布及性能的影响,确定煤临氢缓和液化催化剂的最佳制备条件。
1 实 验
1.1 原 料
鄂尔多斯煤粉,由上海新佑能源科技有限公司提供,粒径小于0.15 mm,于115 ℃下真空干燥2 h后备用。其基本性质见表1。由表1可见,该原料煤为劣质煤种,C元素含量较低,O元素含量较高。溶剂油为加氢煤焦油,由上海新佑能源科技有限公司提供,其基本性质见表2。七水合硫酸亚铁,分析纯,国药集团化学试剂有限公司产品;氨水,质量分数25%,国药集团化学试剂有限公司产品;去离子水,实验室自制。
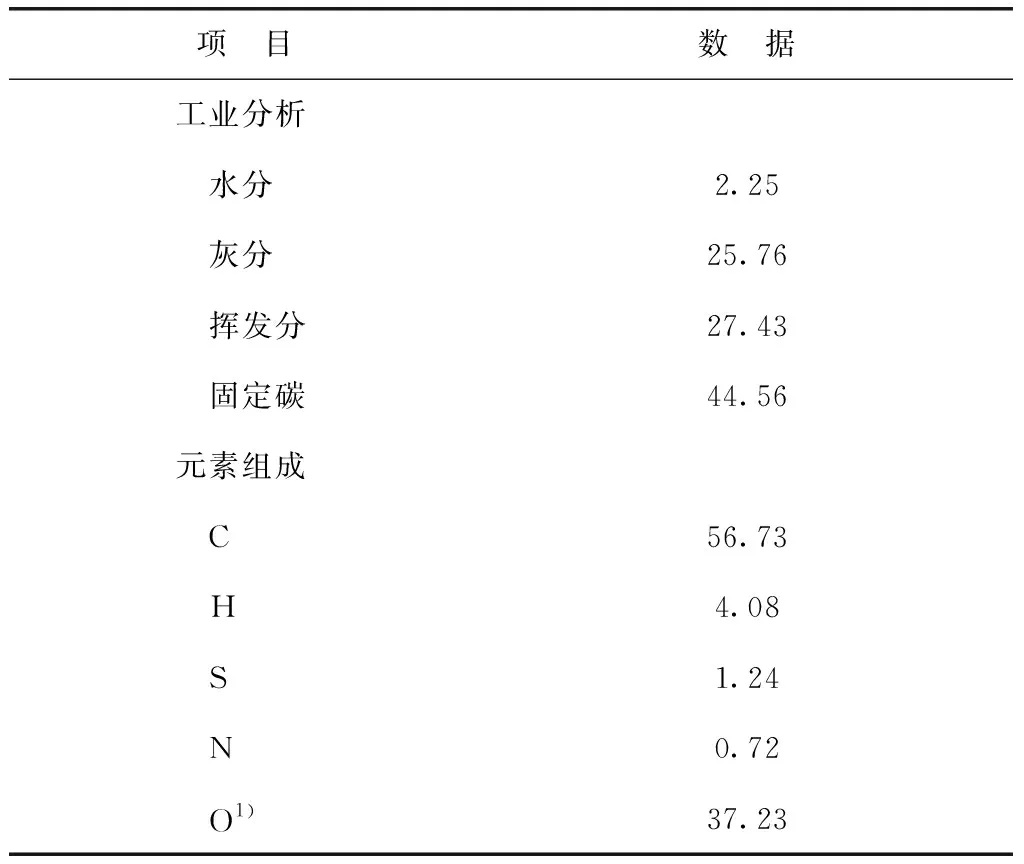
表1 鄂尔多斯煤的基本性质 w,%

表2 溶剂油性质
1.2 催化剂制备
参照赵凌云等的研究[17],按试验设计物料比将适量的七合水硫酸亚铁溶于120 mL去离子水中,加入21.0 g鄂尔多斯煤粉并搅拌混合均匀,然后加入4.4 mL氨水,与硫酸亚铁反应生成沉淀,在不同反应温度下通入空气氧化一定时间。反应完成后,将固、液混合物分离,于115 ℃真空干燥6 h,得到固体产物,研磨成粉末密封保存。
1.3 催化剂表征
使用荷兰PANalytical BV公司制造的Empyrean型X射线衍射仪对制得催化剂进行晶相(XRD)分析,Cu Kα射线源,λ=0.154 2 nm,管电流为20 mA,管电压为36 mV,扫描速率为4(°)/min,步宽为0.02°。
使用美国FEI公司制造的Quanta FEG250型扫描电子显微镜对催化剂形貌、尺寸、分布等进行表征,加速电压为200~30 000 V,场发射电子最大束流为200 nA,样品室压力最高为4 kPa。
使用美国Micromeritics仪器公司制造的ASAP-2020型N2吸附-脱附仪测定样品的孔结构参数。
1.4 催化剂性能评价
由于工业煤直接液化反应的氢压大于15 MPa,对装置要求高且投资大,大大限制了其发展。本研究采用煤临氢缓和液化试验考察催化剂的性能,并通过比较煤液化得到液相产物的收率进行评价。试验时,依次将煤焦油、煤粉、催化剂、硫助剂加入到高压反应釜中,置换通氢,接通冷却水,按5.5 ℃/min升至反应所需温度,当温度升至100 ℃时开始搅拌,转速400 r/min,进行煤临氢液化反应。根据前期研究结果[18],反应条件为:温度420 ℃、时间60 min、氢初压6 MPa。
反应结束后,分别收集气、液、固相产物,使用美国Bruker公司制造的456-GC型气相色谱仪对气体产物进行分析,通过归一法计算出产物气体质量;使用美国Agilent公司制造的CP-3800GC型气相色谱仪对液体产物进行分析;使用鹤壁市金汇煤质分析仪器有限公司制造的JHGF-3型全自动工业分析仪对固体产物进行分析。气、液、固相产物收率的计算见式(1)~式(3)。
(1)
(2)
Yl=(1-Yg-Ys)×100%
(3)
式中:Yg为气体产率,%;Ys为固体产率,%;Yl为液体产率,%;m1为原料煤质量,g;m2为催化剂质量,g;mg为气体产物质量,g;ms为固体产物质量,g。
2 结果与讨论
2.1 催化剂晶相分析
2.1.1制备温度对催化剂晶相的影响
在制备时间为60 min、铁煤质量比为0.071 0时,不同温度下制得催化剂的XRD图谱如图1所示。由图1可以看出:制备温度为30 ℃时,催化剂的XRD谱峰中主要包括α-FeOOH和γ-FeOOH晶相的衍射峰;随着制备温度升高,铁氧化合物晶相结构和结晶度逐渐转变;制备温度升至40 ℃时,α-FeOOH和γ-FeOOH晶相衍射峰的强度增强,说明随着制备温度升高,催化剂中两种晶相的结晶度有所提高;而当制备温度分别达到60 ℃和70 ℃时,α-FeOOH和γ-FeOOH晶相的衍射峰强度减弱,并出现γ-Fe2O3晶相的衍射峰。表明制备温度对催化剂中铁氧配位和连接结构单元的结构有明显影响,较低的制备温度有利于在γ-FeOOH中形成氢键,适中的制备温度有利于形成晶型较完整、晶粒较大的α-FeOOH,而较高温度有利于形成立方体结构的γ-Fe2O3晶相。这与谢晶等[16]的研究结果一致。因此,煤粉负载铁基催化剂的最佳制备温度为40 ℃。

图1 不同温度下制得催化剂的XRD图谱
2.1.2制备时间对催化剂晶相的影响
在温度为40 ℃、铁煤质量比为0.071 0时,不同制备时间下制得催化剂的XRD图谱见图2。由图2可知:制备时间较短时,铁氧化合物主要为α-FeOOH和γ-FeOOH;随着制备时间增加,铁氧化合物的晶相变化不大,但其结晶度不断提高;当制备时间为70 min时,除α-FeOOH和γ-FeOOH峰外,开始出现弱的γ-Fe2O3峰,说明当制备时间过长时,催化剂的晶相发生改变。

图2 不同制备时间下制得催化剂的XRD图谱
2.1.3铁煤比对催化剂晶相的影响
在制备温度为40 ℃、制备时间为60 min时,不同铁煤比下制得催化剂的XRD图谱见图3。由图3可以看出,随铁煤比增加,铁氧化合物晶相发生了明显变化。当铁煤比分别为0.035 5和0.071 0时,催化剂中铁氧化合物均为α-FeOOH和γ-FeOOH晶相;但当铁煤质量比为0.106 5时,α-FeOOH和γ-FeOOH晶相峰不再明显,而出现明显的γ-Fe2O3峰。说明在催化剂制备过程中,铁煤比较低时合成产物主要是α-FeOOH和γ-FeOOH晶相的铁氧化合物,而且铁煤比对铁氧化合物晶型的影响不明显;而铁煤比较高时,催化剂中铁氧化合物的晶核密集分布,抑制了晶核向α-FeOOH晶相发展,进而形成立方体的γ-Fe2O3。因此,催化剂的最佳铁煤质量比为0.071 0。

图3 不同铁煤比下制得催化剂的XRD图谱
2.2 催化剂形貌和孔结构
2.2.1不同温度下制得催化剂的形貌与孔结构
图4为不同温度下制得煤载铁系催化剂的扫描电镜照片。由图4可见:制备温度为30 ℃时,合成的大部分铁氧化合物为未生长成晶体的晶核结构,少部分为棒状晶体,这种结构不利于其在煤液化过程中向催化活性结构(Fe1-xS)转化;当制备温度为40 ℃时,铁氧化合物的晶体主要为针状及叠加片层结构,晶体的结晶度明显升高,针状结构交错生长并附着在煤粉表面,易于向Fe1-xS结构转化;当制备温度为70 ℃时,合成铁氧化合物主要为球形晶体颗粒,主要为γ-Fe2O3晶相颗粒,其在煤表面密集分布,而且粘连、团聚现象严重,导致其很难向高活性的Fe1-xS转化[18]。

图4 不同温度下制得催化剂的SEM照片
不同温度下制得催化剂的BET比表面积、孔体积和平均孔径如表3所示。由表3可以看出,随着制备温度的升高,催化剂的比表面积、孔体积和平均孔径均先小幅提高后再明显降低。这可能是由于制备温度由30 ℃升至40 ℃时,铁氧化合物的晶粒分布更加均匀,且不同晶粒之间相互交错生长,使催化剂的比表面积、孔体积和平均孔径均有所提高;当制备温度提高到70 ℃时,铁氧化合物晶体转变为球形颗粒,生成了γ-Fe2O3晶相,且部分团聚现象严重,导致催化剂的比表面积、孔体积和平均孔径均明显下降。因此,制备温度为40 ℃时,所得煤粉负载铁基催化剂的性能最佳。
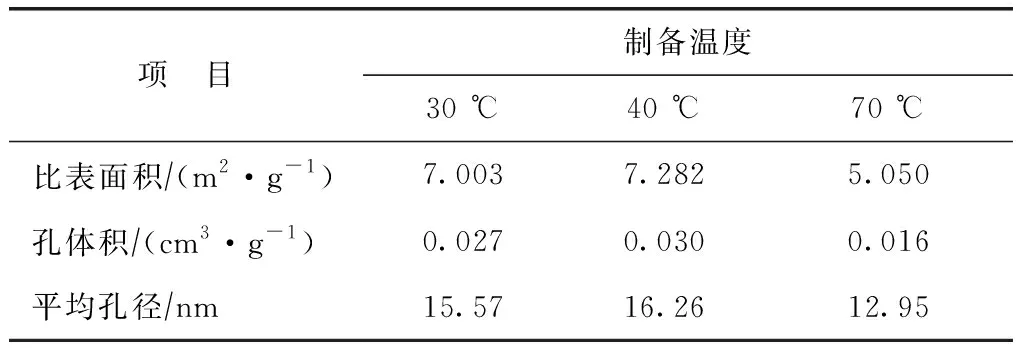
表3 催化剂的比表面积、孔体积和平均孔径
不同温度下制得催化剂的孔径分布见图5。由图5可以看出:温度为30 ℃和40 ℃时,催化剂的孔径分布相似;与40 ℃时制得的催化剂相比,30 ℃时催化剂上孔径小于20 nm的孔道略多,孔径为20~50 nm的孔道略少;当制备温度为70 ℃时,催化剂中孔径小于9 nm的孔道分布与低温下制得的催化剂相似,但孔径为9~50 nm的孔道数量明显减少,这是因为制备温度过高时,铁氧化合物晶体转变为球形颗粒,分布密集且粘连、团聚现象严重,导致较大孔径孔道显著减少。此外,由图5还可以看出,不同温度下制得的催化剂均存在部分孔径为2~4 nm的孔道,而且其分布趋势大致相同,为生成的FeOOH初级粒子聚集形成的微孔[19]。

图5 不同温度下制得催化剂的孔径分布
2.2.2不同制备时间制得催化剂的形貌
图6为不同制备时间下制得催化剂的扫描电镜照片。由图6可见:制备时间为40 min时,合成的铁氧化合物为针状、棒状、纺锤状的混合晶相,混合晶相间相互交错生长,从而导致不同晶相反应时相互抑制,难以向高活性的Fe1-xS转化;制备时间为60 min时,铁氧化合物为针状及叠加片层结构,而且晶体的结晶度明显提高,针状结构在煤液化过程中易于向高活性的Fe1-xS转化;当制备时间增加到70 min时,铁氧化合物的晶体仍为针状与片层结构,其中片层结构较多,并伴有少量小球形颗粒生成,由于片层结构数量过多且相互叠加,抑制了铁氧化合物在煤液化过程中向高活性的Fe1-xS转化[19],导致催化剂催化活性降低。因此,催化剂最佳制备时间为60 min。

图6 不同时间下制得催化剂的SEM照片
2.2.3不同铁煤比下制得催化剂的形貌
图7为不同铁煤比下制得催化剂的扫描电镜照片。由图7可见:铁煤质量比为0.035 5时,铁氧化合物为短棒状晶体结构且分布稀疏,因铁含量过低,导致催化剂晶体的结晶度也较低;当铁煤质量比为0.071 0时,铁氧化合物为针状晶体及针状叠加片层结构,晶体间相互交错生长,分布相对密集,晶体结晶度明显提高;当铁煤质量比为0.106 5时,铁氧化合物为纺锤状晶体和棒状混合晶体结构,混合晶体间没有交错生长,但团聚现象明显。蒋中山等[8]也发现,随FeOOH负载量增加,铁基催化剂比表面积和催化活性明显下降。
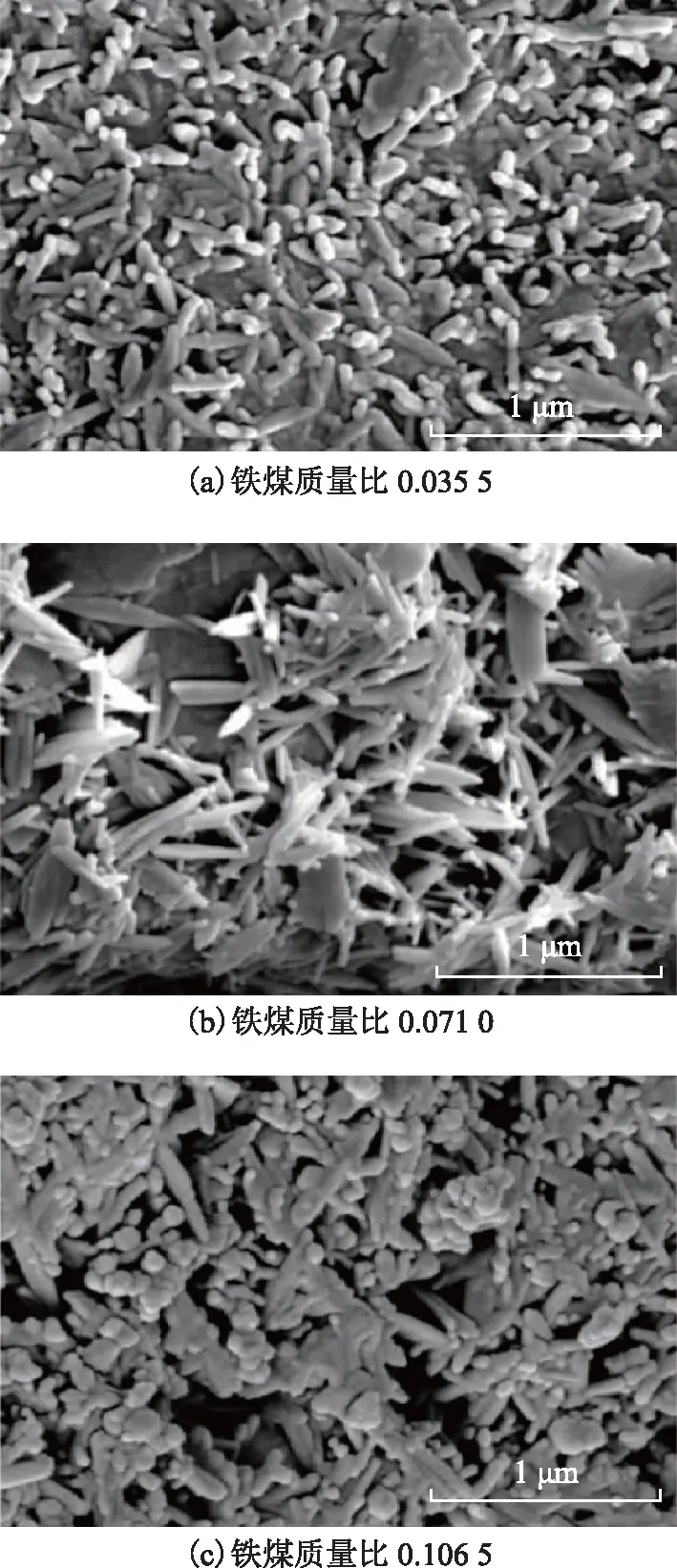
图7 不同铁煤比下制得催化剂的SEM照片
2.3 催化剂的性能
为考察不同制备条件下制得催化剂的性能,在制备时间为60 min、铁煤质量比为0.071 0时,分别在温度为30,40,70 ℃下制得煤粉负载铁基催化剂A30,A40,A70;在制备温度为40 ℃、铁煤质量比为0.071 0时,分别在时间为40,60,70 min下制得煤粉负载铁基催化剂B40,B60,B70;在制备温度为40 ℃、制备时间为60 min时,分别在铁煤质量比为0.035 5,0.071 0,0.106 5下制得煤粉负载铁基催化剂C1,C2,C3。通过煤临氢液化试验,考察在上述催化剂作用下煤临氢液化反应的液相产物收率,结果如表4所示。
由表4可以看出,在不同温度下制得的催化剂中,以40 ℃下制得催化剂的性能最好,液相产物收率为45.98%。这是因为:制备温度较低时,催化剂存在大量晶核结构,晶体结晶度较低,不利于向高活性的Fe1-xS转化,因此催化活性较低;制备温度过高时,催化剂的晶相主要为γ-Fe2O3,颗粒分布密集且粘连、团聚现象严重,催化剂比表面积、孔体积和平均孔径明显降低,抑制其向高活性的Fe1-xS转化,催化剂性能较差;40 ℃下制得的催化剂,主要为α-FeOOH和γ-FeOOH晶相,铁氧化合物为针状及叠加片层结构,且结晶度明显提升,因而催化活性最高。
此外,比较不同制备时间下制得催化剂的性能,发现时间为60 min时催化剂的性能最佳。这是因为当制备时间为60 min时,催化剂的晶相组成均为α-FeOOH和γ-FeOOH,形貌为针状或片层结构交错生长,结晶度高,在煤液化过程中易于向高活性的Fe1-xS转化;制备时间较短或过长,均会影响催化剂的晶相结构,进而影响其在煤液化过程中向高活性的Fe1-xS的转化,导致催化剂性能降低。
由表4还可以看出,当铁煤质量比为0.071 0时,催化剂的性能最优,液相产物收率最高。这是因为:当铁煤比较低时,铁氧化合物含量低、分布稀疏且晶体结晶度较低,在煤液化过程中转化为高活性Fe1-xS的数量有限,导致催化性能较低;当铁煤比过高时,铁含量过高使铁氧化合物晶核分布过度密集,抑制了晶核向α-FeOOH晶相的转变,而是形成了立方体结构的γ-Fe2O3,团聚现象严重,难以向高活性的Fe1-xS转化,导致催化剂性能降低;当铁煤比适宜时,催化剂晶相分布密集度适中,晶体结晶度高,易于向高活性的Fe1-xS转化,因而催化剂性能明显提升。

表4 不同催化剂作用下煤液化反应的液相产物收率
综上所述,煤载铁系催化剂的最佳制备温度为40 ℃,最佳制备时间为60 min,最佳铁煤质量比为0.071 0。
3 结 论
制备条件对煤载铁系催化剂的晶相组成有明显影响,催化剂的晶相组成与其表面性质和活性有重要联系。
煤载铁系催化剂的最佳制备温度为40 ℃,最佳制备时间为60 min,最佳铁煤质量比为0.071 0。在最佳条件下制得催化剂的晶相主要为α-FeOOH和γ-FeOOH,无γ-Fe2O3晶相,晶体结晶度高,形貌主要为针状或片层结构,分布密集度较好,无粘连、团聚现象,在煤液化反应过程中易于转化为具有高催化活性的Fe1-xS结构,因而催化剂活性最高,煤临氢液化液相产物收率最高,为45.98%。
制备温度、时间和铁煤比过低或过高,均会影响催化剂中铁氧化合物的晶相类型、结构和结晶度,以及其存在形貌、分布密集度,从而导致催化剂性能下降。

